眼針對局灶性腦缺血大鼠模型海馬組織TGF-β1表達的影響*
宓 丹 馬賢德 王 建
(1.遼寧中醫藥大學,遼寧 沈陽 110032;2.遼寧中醫藥大學附屬第二醫院,遼寧 沈陽110034;3.遼寧中醫藥大學附屬醫院,遼寧 沈陽 110032)
近年來研究表明腦缺血、缺氧后可刺激機體產生各種生長相關因子,這些生長因子可以減輕神經元的損傷,促進神經元的再生。轉化生長因子-β1(TGF-β1)是一種多功能生長因子,可延長神經元的存活,具有神經保護作用。已有研究表明眼針可以通過抑制TNF[1]等炎癥因子來治療腦缺血,但是否可以通過促進各種生長因子來治療缺血性腦血管疾病尚未見報道。本研究通過觀察眼針對局灶性腦缺血大鼠模型海馬組織TGF-β1表達影響,來進一步探討眼針治療缺血性腦血管疾病的機制。
1 材料與方法
1.1 試劑 兔抗鼠TGF-β1抗體、即用型SABC免疫組化染色試劑盒及DAB染色試劑均購自武漢博士德生物工程有限公司。
1.2 動物與分組 健康SPF級SD大鼠90只,雌雄不拘,體質量(280±20)g,由上海西普爾必凱實驗動物有限公司提供,許可號:SCXK(滬)2008-0016。適應性喂養1周,自由飲水、攝取標準顆粒飼料,室內溫度22℃,相對濕度45%。按隨機數字表法將大鼠分為空白組、假手術3 h組、假手術24 h組、假手術72 h組、模型3 h組、模型24 h組、模型 72 h組、眼針3 h組、眼針24 h組、眼針72 h組,共10組,每組9只。
1.3 模型制備 參照文獻[2],模型組及眼針組采用改良線栓法復制大鼠大腦中動脈缺血再灌注損傷模型。大鼠于缺血2 h后進行再灌注,再灌注后進行神經功能缺損程度評分,參照Longa 5分制評分標準[3]:0分為無癥狀;1分為不能完全伸展對側前爪;2分為向對側轉圈;3分為向對側傾倒;4分為不能自發行走,意識喪失。評分為1~3分者納入,未達標準者排除。假手術組術式同模型、眼針組,區別在于魚線插入深度為0.5~1 cm。空白組未做處理。
1.4 干預方法 眼針組:用31號13 mm毫針,于大鼠眶周2 mm處針刺,定位參照人體取穴方法[4],取肝區、上焦區、下焦區、腎區針刺。手法:平刺,進針3 mm。留針20 min,留針期間捻轉行針3次,每次1 min。治療時機:眼針組于腦缺血再灌注即刻進行眼針治療,存活期間每12小時1次;眼針3 h組于取材前30 min再進行眼針治療1次。
1.5 標本采集與處理 動物完成觀察時間后,以10%水合氯醛(3.5 mL/kg體質量)腹腔麻醉,開胸暴露心臟,將灌注針頭插入心臟,剪開右心耳,依次迅速灌注0.9%氯化鈉注射液200 mL、4℃的4%多聚甲醛200 mL,灌注至無血色止,灌畢迅速取腦,在視交叉平面前后5~10 mm處將腦冠狀切面切開,留取中間部分置于4℃的4%多聚甲醛固定液中過夜。常規上行脫水、透明后用石蠟包埋,連續切片,切片厚5 μm,每隔10張取1張,使每張切片上都有海馬組織。
1.6 指標檢測 采用免疫組化(SABC法)檢測。切片脫蠟至水,抗原修復液修復,滴加封閉液,滴加1∶100兔抗鼠抗體,過夜,加SABC。DAB顯色、復染、脫水、透明,封片。采用BI2000醫學圖像分析系統對采集的圖像測定陽性反應物的灰度,細胞膜或細胞漿內出現清晰棕褐色顆粒為陽性。每例動物隨機取3~4張切片,且各組所選部位相同。
1.7 統計學處理 應用SPSS10.0統計軟件。數據以 (±s)表示。組間比較采用單因素方差分析處理。P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠神經功能缺損程度評分比較 見表1。模型組和眼針組大鼠均出現不同程度的神經功能障礙,如提尾時左側前肢不能伸直,行走向對側旋轉或傾倒等;假手術組大鼠無神經功能障礙表現。模型組大鼠神經功能障礙在24 h達到高峰,隨時間延長,72 h時大鼠神經功能障礙減輕但無明顯差異。眼針組與模型組相比,在再灌注損傷3 h后神經功能缺損程度評分無差異,隨時間延長眼針組大鼠神經功能障礙減輕,與模型組比各時間點大鼠神經功能缺損程度評分有差異(P<0.05)。
表1 眼針對局灶性腦缺血大鼠神經功能缺損程度評分比較(分,±s)

表1 眼針對局灶性腦缺血大鼠神經功能缺損程度評分比較(分,±s)
與模型組比較,*P<0.05,**P<0.01。 下同。
組 別 24 h 72 h空白組 0 0 n 3 h 9 0假手術組 0 0 9 0模型組 9 2.2±0.6 2.7±0.4 2.3±0.5眼針組 9 2.1±0.6 2.0±0.7* 1.5±0.9*
2.2 各組大鼠海馬組織TGF-β1表達比較 見表2。空白組和假手術組可見TGF-β1蛋白微量表達,模型組和眼針組大鼠各時間點TGF-β1蛋白含量與假手術組比較,差異均有統計學意義(P<0.01)。模型組TGF-β1蛋白含量在腦缺血再灌注3 h開始增加,隨缺血時間延長逐漸升;在相應各時間點,眼針組TGF-β1蛋白含量較模型組增高,差異均具有統計學意義,以腦缺血再灌注72 h升高最為明顯(P<0.05或0.01)
表2 各組大鼠海馬組織TGF-β1表達比較(±s)
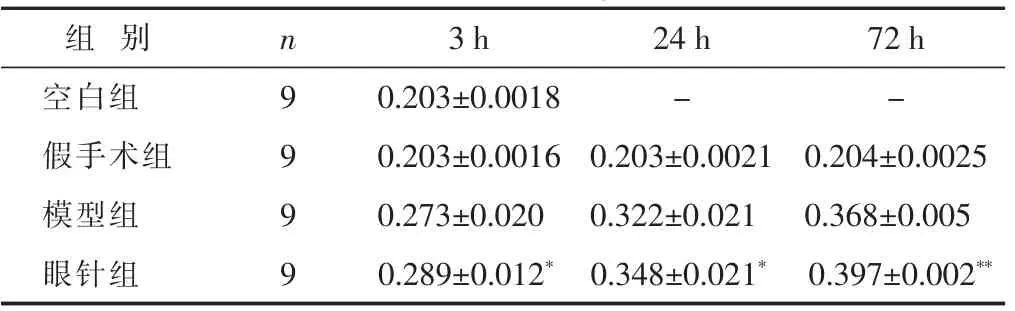
表2 各組大鼠海馬組織TGF-β1表達比較(±s)
組 別 24 h 72 h空白組 - -n 3 h 9 0.203±0.0018假手術組 0.203±0.0021 0.204±0.0025 9 0.203±0.0016模型組 9 0.273±0.020 0.322±0.021 0.368±0.005眼針組 9 0.289±0.012* 0.348±0.021* 0.397±0.002**
3 討 論
TGF-β是一種生物效應比較廣泛的生長因子,參與細胞的增殖和分化、胚胎發育、細胞外基質的合成以及血管生成等體內生理學過程,在纖維化、損傷修復和腫瘤生長等許多病理學過程中發揮重要作用[5]。其中TGF-β1在哺乳動物體細胞體系中所占的比例最高(>90%),活性最強,與疾病關系最密切,成為研究的熱點。在生理情況下,TGF-β1呈低水平表達;缺血、缺氧可以刺激TGF-β1的表達。Kyupinski等[6]對10例缺血性卒中患者死亡24 h內的腦組織進行病理學檢查發現,所有神經元、膠質細胞,特別是少突膠質細胞均表達TGF-β1mRNA,微血管周圍的巨噬細胞和梗死組織的內皮細胞也有較強表達。對側腦組織中TGF-β1mRNA水平最低,缺血半暗帶最高。李華軍等[7]通過對小鼠全腦缺血再灌注TGF-β1在缺血組織中的表達檢測,結果表明缺血30 min及再灌注早期TGF-β1表達增強,但隨著再灌注時間延長,壞死加重,TGF-β1表達下降。而缺血半影區TGF-β1表達隨缺血再灌注時間延長逐漸增強。此趨勢說明,它在調節神經細胞死亡的機制中起著重要作用,參與腦缺血后神經元的保護與修復作用。缺乏TGF-β1基因表達的新生小鼠會出現廣泛的神經元變性,同時伴有突觸素和層黏蛋白表達下降以及顯著的小膠質增生。這種缺乏TGF-β1基因小鼠的神經元在體外培養時存活時間明顯縮短,并且成年小鼠易受到興奮性毒性損傷[8]。作為一種活性很強的血管生成調節因子,TGF-β1還可激活缺血半暗帶的內皮細胞,促進微血管再生。研究表明,TGF-β1能夠與堿性成纖維生長因子和巨噬細胞一起誘導血管生成,并有利于轉運壞死組織和神經重塑[9]。體內和體外實驗均已經證實了TGF-β1的神經保護作用。但是由于TGF-β1無法通過血腦屏障,因此對于利用外源性TGF-β1治療缺血性腦血管疾病的研究一直無法應用于臨床。
名老中醫彭靜山教授根據中醫學 “五輪八廓”等理論結合“八卦”學說,建立“八區十三穴絡腦通臟腑”理論。臨床上通過觀察眼睛各區中脈絡形態和色澤變化以診斷疾病,依據 “觀眼識病”創立了彭氏眼針療法。40多年的臨床百余萬病例實踐證明,眼針療法對腦梗死病患者治療效果確切顯著,是一種簡便有效、無不良反應、易于推廣的療法。
中風病的基本病機之一為肝腎陰虛,偏癱的上、下肢分別歸屬上焦區、下焦區,故本實驗用眼針取肝區、腎區以滋補肝腎治病求本,取上焦區、下焦區以活血通絡治其標。實驗結果表明,假手術組和空白組TGF-β1微量表達;模型組3 h可見TGF-β1表達上升與假手術組比有差異(P<0.05),隨缺血時間延長,TGF-β1蛋白表達持續升高,說明缺血缺氧可刺激其表達;眼針組TGF-β1蛋白表達趨勢與模型組一致,各時間點與模型組比有明顯差異,以72 h時間點差異最為明顯。而眼針組大鼠模型神經功能缺損評分明顯下降 (P<0.05)。說明眼針可以通過刺激肝區、腎區、上焦、下焦,對內源性TGF-β1的生成加以干預調節使其增,從而通過一系列免疫介導減輕神經元的損傷,改善神經功能障礙。但是眼針如何促進TGF-β1表達的機理目前尚不清楚,還需進一步研究。
[1]王鵬琴,周鴻飛,王健,等.眼針對局灶腦缺血再灌注大鼠腦組織及血液腫瘤壞死因子含量的影響[J].上海針灸雜志,2011,30(2);71-72.
[2]馬賢德,孫宏偉.線栓法制備大鼠腦缺血再灌注模型的方法研究[J].中華中醫藥學刊,2009,27(6):1200-1201.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]彭靜山.眼針療法[M].沈陽:遼寧科學技術出版社,1990:11.
[5]Azhar M,Schultz J,Grupp I,et al.Transforming growth factor beta in cardiovascular development and function[J].Cytokine Growth Factor Rev,2003,14(5):391-407.
[6]Krupinski J,Kumar P,Kumar S,et al.Increased expression of TGF-batal in brain tissue after is chemic stroke inhumans[J].Stroke,1996,27(5):852-869.
[7]李華軍,尹嬌,陳東,等.轉化生長因子β-1在全腦缺血再灌注后遲發性神經元壞死時的表達[J].中風與神經疾病,2003,2(20):52-54.
[8]Brionne TC,Tesseur I,Masliah E,et al.Loss of TGF-β1leads to increased neuronal cell death and microglios is in mouse brain [J].Neuron,2003,40:1133-1145.
[9]Clemetson KJ,Clemetson JM.Integrins and cardiovascular disease[J].Cell MolLife Sci,1998,54:502-513.

