坎地沙坦酯片的處方工藝研究
包汝潑,左 鋒,陳 誠
(浙江省寧波市天衡制藥有限公司,浙江 寧波 315201)
坎地沙坦酯是一種新型血管緊張素Ⅱ(AngⅡ)受體拮抗劑,可以選擇性地阻斷AngⅡ在人體組織中的作用,具有良好的降壓效果,并對心衰也有明顯治療作用,目前在抗高血壓市場上應(yīng)用較廣[1-2]。本試驗采用原研廠家產(chǎn)品為參比制劑,通過篩選不同處方,考察不同制備工藝參數(shù)對雜質(zhì)及溶出特性的影響,以獲得質(zhì)量穩(wěn)定的產(chǎn)品。
1 儀器和試藥
Agilent 1200型高效液相色譜儀(美國安捷倫公司);GL-5C型全自動干法制粒機(浙江明天機械有限公司);ZPS008型旋轉(zhuǎn)壓片機(上海天祥健臺制藥機械有限公司);GKZ快速整粒機(寧波市華拳機械有限公司);YPD-200C型片劑硬度儀(上海黃海藥檢儀器有限公司);RCZ-8M溶出試驗儀(天津天大天發(fā)科技有限公司)和激光粒度儀(英國Malvern公司)。坎地沙坦酯及有關(guān)物質(zhì)A,B,E(寧波市天衡制藥有限公司);參比制劑必洛斯(天津武田藥品有限公司,批號為020B);乳糖(荷蘭DMV國際有限公司);玉米淀粉(法國羅蓋特公司);硬脂酸鎂(安徽山河輔料有限公司);羧甲基纖維素鈣(日本五德藥業(yè));聚乙二醇(PEG6000,三洋化成工業(yè)株式會社);檸檬酸三乙酯(蚌埠豐原醫(yī)藥科技發(fā)展有限公司);甘油(浙江萬聯(lián)藥業(yè)有限公司);微晶纖維素PH-101(日本旭化成株式會社);乙腈等試劑為色譜純。
2 方法與結(jié)果
2.1 含量及有關(guān)物質(zhì)測定方法[3]
色譜條件:色譜柱為diamonsil ODS柱(250 mm×4.6 mm,5 μm);以乙腈-水-乙酸(57∶43∶1)為流動相A,以乙腈-水-乙酸(90∶10∶1)為流動相B,流動相梯度洗脫程序見表1;檢測波長254 nm;流速1.0 mL/min;柱溫30℃;進(jìn)樣量10 μL;理論板數(shù)按主峰計不低于2 000,主峰與相鄰雜質(zhì)峰的分離度大于1.5。上述色譜條件下,各輔料對主峰檢測無干擾,主峰峰形良好,保留時間約為19.8 min。主藥質(zhì)量濃度在5.0~200.0 μg/mL范圍內(nèi)與峰面積線性關(guān)系良好,日間和日內(nèi)RSD均小于0.5%,回收率為98.3%~100.2%。
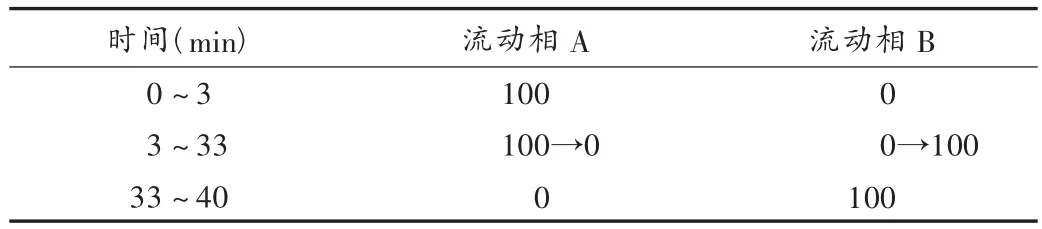
表1 梯度洗脫條件
樣品溶液制備與測定:精密稱取坎地沙坦酯和雜質(zhì)對照品各25 mg,置于50 mL容量瓶中,加入乙腈適量試溶解并稀釋至刻度,搖勻,精密量取1 mL,置100 mL容量瓶中,加入乙腈-水(3∶2)稀釋至刻度作為對照品溶液。另精密稱取坎地沙坦酯片細(xì)粉適量(約相當(dāng)于坎地沙坦西酯10.0 mg),置于100 mL容量瓶中,加入乙腈-水(3∶2)適量,超聲處理 10 min,并稀釋至刻度,搖勻,12 000 r/min轉(zhuǎn)速離心10 min,取上清液作為供試品溶液,精密量取對照品溶液和供試品溶液10 μL,分別注入液相色譜儀。
2.2 溶出曲線測定及相似因子f2計算[4]
參考美國食品和藥物管理局溶出數(shù)據(jù)庫,用槳法進(jìn)行溶出曲線測定,具體試驗條件,溶出介質(zhì)為0.35%吐溫20的0.05 mol/L磷酸鹽緩沖液(pH=6.8),體積為900 mL,溫度為(37±0.5)℃,轉(zhuǎn)速為 50 r/min。分別在 5,10,15,20,30,45 min 時取樣,樣品溶液經(jīng)過0.45 μm微孔濾膜過濾,移取一定體積,采用高效液相色譜法測定藥物的濃度,計算出藥物的溶出度。采用美國食品和藥物管理局推薦的相似因子f2比較自研制劑和參比制劑溶出曲線的匹配程度。相似因子f2計算公式,f2=50×log{[1+1/n×Σ(Rt-Tt)2]-1/2×100}。其中Rt和Tt分別表示自研制劑與參比制劑在第n個取樣點時的平均累積溶出度,f2大于50,可認(rèn)為是溶出匹配,f2越大,匹配程度越好。
2.3 處方篩選
根據(jù)預(yù)試驗發(fā)現(xiàn)坎地沙坦酯本身不穩(wěn)定,在壓片和貯藏過程中會分解,造成雜質(zhì)易升高,添加一些低熔點的油性物質(zhì)有助于其穩(wěn)定,本試驗選擇3種油性物質(zhì)組成不同處方,具體處方見表2。按表2稱取相應(yīng)的原輔料,將油性物質(zhì)先與坎地沙坦酯及部分乳糖混勻,過45目篩,再與除羧甲基纖維素鈣和硬脂酸鎂的其他輔料混勻,用干法制粒機制粒,過30目篩整粒,外加羧甲基纖維素鈣和硬脂酸鎂混合,壓片,將片劑分別用鋁袋包裝后放置在高溫高濕條件[60℃,RH(90 ±5)%]下,于 0,5,10 d 取樣,按 2.1 項下檢測含量及有關(guān)物質(zhì),統(tǒng)計含量及總雜的變化,結(jié)果見表3。從表3可見,相對不加油性物質(zhì)的處方4,PEG6000、檸檬酸三乙酯和甘油的加入可提高坎地沙坦酯的穩(wěn)定性,其中含PEG6000的處方在高溫、高濕條件下有關(guān)物質(zhì)增幅最低,含量沒有明顯下降,與原研參比制劑穩(wěn)定性相似。因此,以下處方采用含PEG6000的處方。
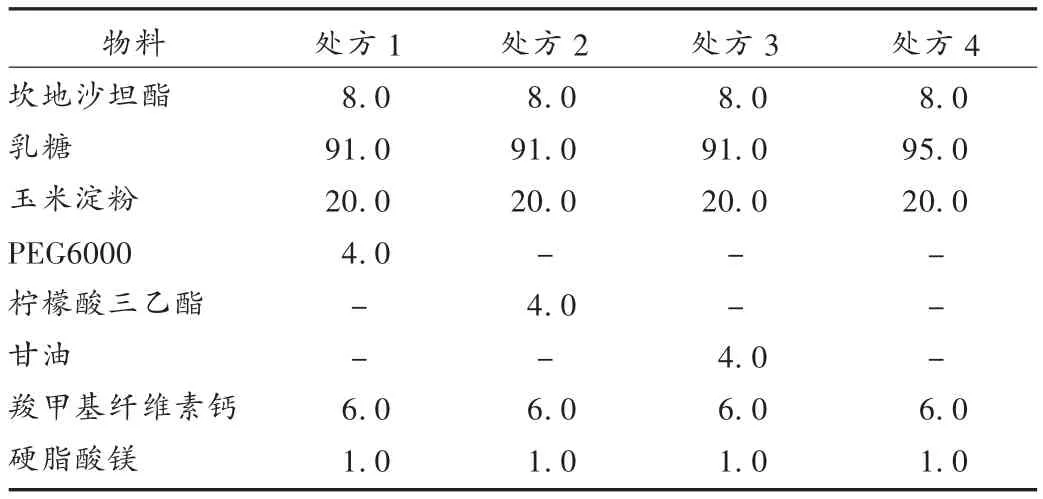
表2 處方組成
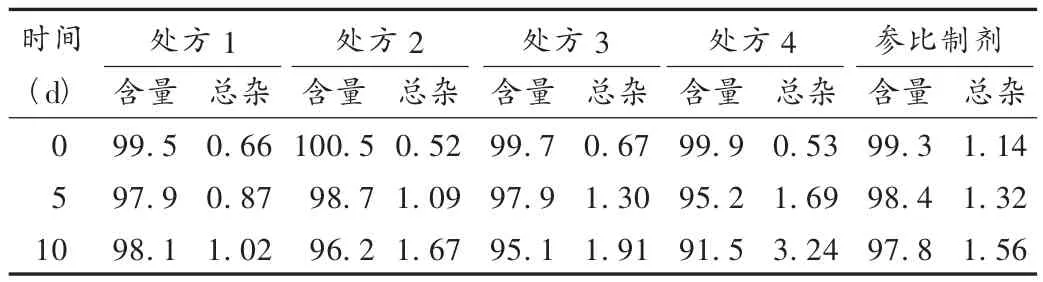
表3 影響因素條件下含量及雜質(zhì)變化(%)
2.4 處方工藝優(yōu)化
在預(yù)試驗時,發(fā)現(xiàn)羧甲基纖維素鈣單片用量、原料粒徑和片劑硬度對溶出影響比較大,原料粒徑系采用Malvern scirocco 2000型激光子粒度儀檢測所得。采用L9(34)正交設(shè)計法進(jìn)行試驗,考察因素及水平設(shè)置見表4,片劑處方以2.3項下的處方1為基礎(chǔ),因羧甲基纖維素鈣用量調(diào)整導(dǎo)致片重不足時以乳糖填充,采用2.3項下工藝,制成片劑后按2.2項下測定溶出曲線并計算f2值。結(jié)果見表5和表6。從表6可知,因素A與因素B對片劑的溶出特性有顯著的影響,主要原因是坎地沙坦酯在水及緩沖液中溶解度比較低,原料粒徑及崩解劑用量的變化對藥物崩解溶出影響比較敏感,考慮到原料粒徑是一范圍,根據(jù)補充試驗發(fā)現(xiàn)原料粒徑在1 μm≤D(V,0.9)≤15 μm之間對溶出曲線相似因子f2影響不明顯。綜合表5、表6得出最終確定最佳處方工藝參數(shù),即原料粒徑在1 μm≤D(V,0.9)≤15 μm之間,羧甲基纖維素鈣單片用量為6 mg,片劑硬度為50 N。
2.5 驗證試驗
按2.4項下篩選出的最佳處方工藝制備3批坎地沙坦酯片(批號分別為111201,111202,111203),測定3批樣品的溶出曲線,結(jié)果見表7,根據(jù)f2計算原則取小于30 min的5個點的累積溶出度計算f2值,與參比制劑比較,3批自研片的f2值分別為64,62,78,根據(jù)相似性判定,自研片和參比制劑的溶出行為一致。

表4 因素水平表

表5 正交試驗方案及結(jié)果
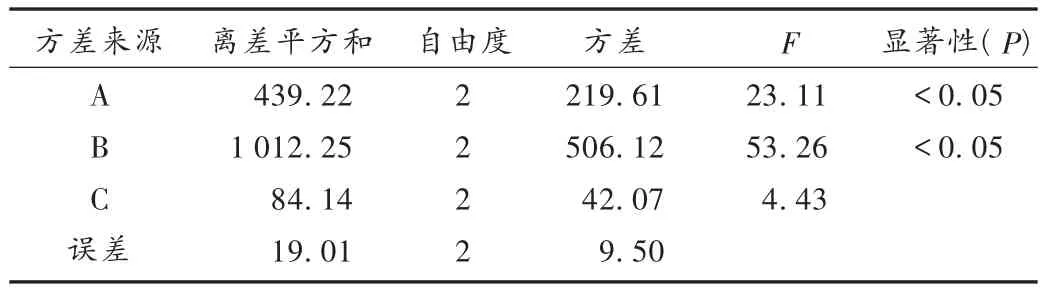
表6 方差分析結(jié)果
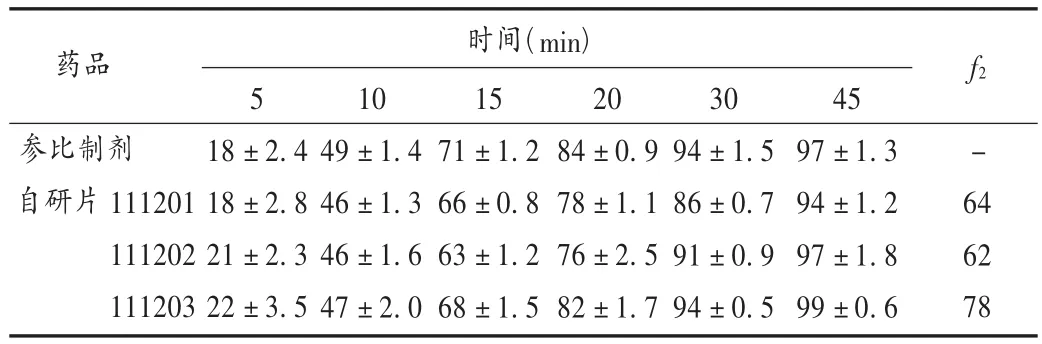
表7 自研片和參比制劑的累積溶出率(%,n=6)
3 討論
目前,口服固體制劑研發(fā)要求仿制藥與參比制劑在多種介質(zhì)中溶出行為一致,本試驗篩選出的處方工藝在標(biāo)準(zhǔn)介質(zhì)pH=6.8磷酸鹽緩沖液溶出曲線匹配好,但仍需進(jìn)一步研究在pH=4.5醋酸緩沖液和pH=1.0鹽酸中的匹配性。
本試驗利用影響因素試驗篩選合適的輔料時,沒有按照《化學(xué)藥物穩(wěn)定性研究技術(shù)指導(dǎo)原則》中對溫度、濕度、光線等的要求來做,而是選擇比較劇烈的高溫、高濕條件,主要考慮初步篩選處方時這樣既能節(jié)省一定的資源,又能放大原輔料之間的相互影響,在基本確定處方工藝后,再細(xì)致地按照相關(guān)規(guī)定進(jìn)行研究。
[1]楊 綱.坎地沙坦的臨床研究[J].國外醫(yī)藥,2000,20(1):39-41.
[2]Easthope SE,Jarvis B.Candesartan cilexetil:an update of its use in essential hypertension[J].Drugs,2002,62(8):1 253-1 287.
[3]EDQM.European Pharmacopeia 7.3[M].Liguge:Aubin,2012:3 906-3 908.
[4]夏錦輝,劉昌孝.固體藥物制劑的體外溶出度的統(tǒng)計學(xué)評價分析[J].中國藥學(xué)雜志,2000,35(2):130-131.

