不同證型頸動(dòng)脈粥樣硬化患者Hp感染狀況及相關(guān)基因檢測(cè)分析
劉麗芳,竇逾常,于紅霞
(1.長(zhǎng)春中醫(yī)藥大學(xué)附屬醫(yī)院 神經(jīng)內(nèi)科,吉林 長(zhǎng)春 130021;2.吉林大學(xué)中日聯(lián)誼醫(yī)院 中醫(yī)科,吉林 長(zhǎng)春 130033;3.空軍航空大學(xué)門(mén)診部,吉林 長(zhǎng)春 130000)
傳統(tǒng)的脂質(zhì)浸潤(rùn)學(xué)說(shuō)和損傷反應(yīng)學(xué)說(shuō)認(rèn)為動(dòng)脈粥樣硬化的形成與高血壓、高血脂、糖尿病和吸煙等因素相關(guān),并且是缺血性腦卒中發(fā)病的主要病因。我們發(fā)現(xiàn)Hp感染與缺血性腦卒中有一定的相關(guān)性[1],Hp感染及相關(guān)基因是否參與了不同證型頸動(dòng)脈粥樣硬化的形成尚未清楚,為此本文對(duì)此進(jìn)行研究,為動(dòng)脈粥樣硬化的防治提供科學(xué)依據(jù)。
1 資料與方法
1.1 臨床資料 治療組103例均為2009年2月-2011年8月長(zhǎng)春中醫(yī)藥大學(xué)附屬醫(yī)院神經(jīng)內(nèi)科住院的缺血性腦卒中合并頸動(dòng)脈粥樣硬化患者,男65例,女38例,年齡54~78,平均年齡(63.3±10.1)歲,均為48 h之內(nèi)發(fā)病患者。對(duì)照組為同期年齡、性別、體質(zhì)量指數(shù)、居住環(huán)境和生活習(xí)慣的頻數(shù)相匹的健康體檢合并頸動(dòng)脈粥樣硬化者136例,男85例,女51例,年齡52~79,平均年齡(62.5±11.4)歲。觀察對(duì)象4周內(nèi)均未接受過(guò)抗生素治療。
診斷標(biāo)準(zhǔn)符合國(guó)家中醫(yī)藥管理局制定的《中風(fēng)病診斷療效評(píng)定標(biāo)準(zhǔn)》(試行)和中華醫(yī)學(xué)會(huì)修訂的《各類腦血管疾病診斷要點(diǎn)》。頸動(dòng)脈內(nèi)膜中層厚度(IMT)的檢測(cè)結(jié)果作為頸動(dòng)脈粥樣硬化的判定標(biāo)準(zhǔn),采用飛利浦IU-22型彩色多普勒對(duì)頸內(nèi)外動(dòng)脈分叉處及其上、下1.0~1.5 cm的范圍內(nèi)進(jìn)行檢測(cè),以1.0 mm≤IMT<1.5 mm為頸動(dòng)脈硬化病變期;IMT≥1.5 mm,且增厚的內(nèi)膜向血管腔內(nèi)凸出確定為有斑塊形成。參照國(guó)家中醫(yī)藥管理局制定的《中醫(yī)病證診斷療效標(biāo)準(zhǔn)》,將頸動(dòng)脈粥樣硬化辨證為精髓虧虛證、痰濁內(nèi)阻證、氣血滯瘀證、氣血兩虛型。
1.2 實(shí)驗(yàn)方法
1.2.1 血清抗-Hp-IgG、抗-Hp CagA-IgG及抗-Hp VacA-IgG的檢測(cè) 研究對(duì)象均以間接酶聯(lián)免疫法(ELISA)測(cè)定抗-Hp-IgG來(lái)判斷Hp感染率,試劑由鄭州華美生物工程公司提供;對(duì)抗-Hp-IgG陽(yáng)性血清均以免疫印記法(Weston-Blotting)測(cè)定抗-Hp CagA-IgG和抗-Hp VacA-IgG,判定Hp不同毒力亞型感染率,試劑由上海元谷科技發(fā)展有限公司提供。
1.2.2 動(dòng)脈粥樣斑塊螺桿菌16SrRNA和Hp CagA、VacA和glmM基因檢測(cè) 對(duì)6例CagA+VacA+菌株感染的患者,經(jīng)頸動(dòng)脈內(nèi)膜切除術(shù)獲得的動(dòng)脈粥樣斑塊,用3S柱提取法,以Hp的SS1菌株為陽(yáng)性對(duì)照,去離子水代替模板作為陰性對(duì)照,進(jìn)行PCR方法擴(kuò)增,將擴(kuò)增產(chǎn)物進(jìn)行凝膠電泳、DNA測(cè)序分析。
1.3 統(tǒng)計(jì)學(xué)方法 樣本均數(shù)的比較采用t檢驗(yàn),率的比較采用χ2檢驗(yàn)和Fisher精確檢驗(yàn);并用條件logistic回歸進(jìn)行多因素分析;所有統(tǒng)計(jì)分析用SPSS 16.0軟件完成。
2 結(jié)果
2.1 2組及不同證型患者血清抗-Hp-IgG、抗-Hp CagA-IgG及抗-Hp VacA-IgG的檢測(cè)結(jié)果比較 見(jiàn)表1。
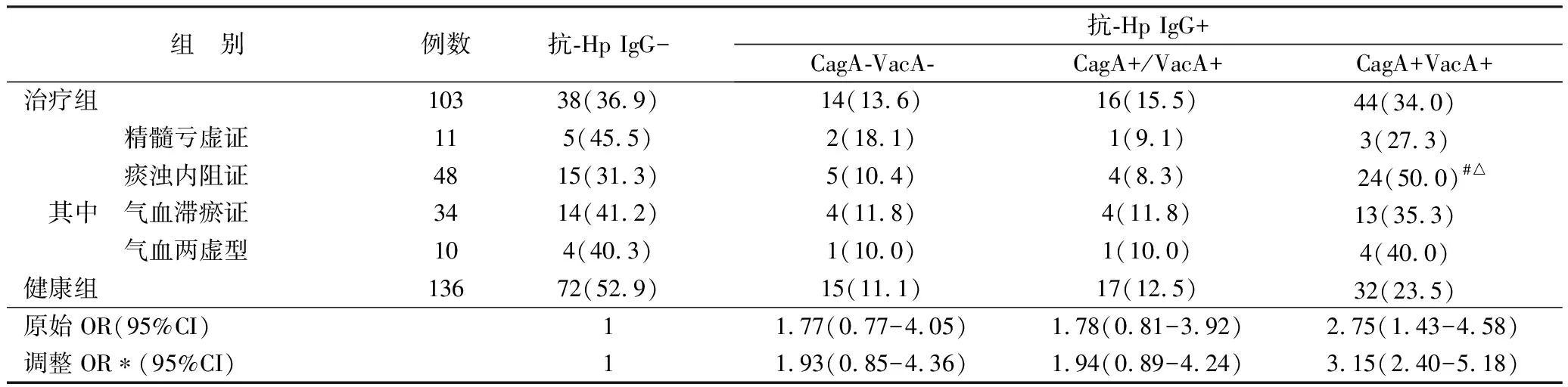
表1 2組及不同證型患者血清抗HP-IgG、抗-Hp CagA-IgG及抗Hp-VacA-IgG檢測(cè)結(jié)果比較 例(%)
表1結(jié)果顯示頸動(dòng)脈粥樣硬化組Hp感染率(63.1%)明顯高于健康對(duì)照組(47.1%)(P<0.05);CagA+VacA+感染率(34.0%)明顯高于CagA-VacA-(13.6%)和CagA+/VacA+(15.5%)(P<0.05),其中痰濁內(nèi)阻證CagA+VacA+感染率(50.0%)優(yōu)勢(shì)更加明顯(P<0.05)。
2.2 2組動(dòng)脈粥樣斑塊螺桿菌16SrRNA和HpCagA、VacA和glmM基因檢測(cè) 對(duì)6例CagA+VacA+菌株感染的患者的動(dòng)脈粥樣斑塊,用3S柱提取法,經(jīng)進(jìn)行PCR方法擴(kuò)增,將擴(kuò)增產(chǎn)物進(jìn)行凝膠電泳、DNA測(cè)序分析,結(jié)果顯示均陰性。
3 討論
近年來(lái),由于對(duì)Hp感染和動(dòng)脈粥樣硬化的相關(guān)性認(rèn)識(shí)存在著爭(zhēng)議[2-3],研究者一直致力于在動(dòng)脈粥樣斑塊組織中尋找Hp-DNA,但未得到有力和可信的證據(jù)[4]。結(jié)合以前的研究,對(duì)不同證型頸動(dòng)脈粥樣硬化患者Hp感染狀況及相關(guān)基因進(jìn)行了分析,結(jié)果發(fā)現(xiàn)痰濁內(nèi)阻證型頸動(dòng)脈粥樣硬化患者是Hp感染的主要證候,且CagA+VacA+感染率具有更顯著的優(yōu)勢(shì);雖然未檢出螺桿菌16SrRNA、Hp CagA、VacA和glmM相關(guān)基因,但不能否認(rèn)此相關(guān)性。
中醫(yī)學(xué)認(rèn)為,動(dòng)脈粥樣硬化和毒邪、痰濁、血瘀密切相關(guān)。外感邪毒,內(nèi)傷脾胃,轉(zhuǎn)輸失利,津液不行,痰瘀相關(guān),痰濁內(nèi)生,阻于脈絡(luò),血行不暢,痰瘀互結(jié),郁久腐化,漸而形成毒、痰、瘀相互交結(jié)之病機(jī),故以痰濁內(nèi)阻證型為主要癥候。Hp和動(dòng)脈硬化形成的機(jī)制可能是:1)Hp感染時(shí)常引起全身或局部血管炎癥反應(yīng),或促進(jìn)TNF-α、IL-1、6、8及細(xì)胞間黏附因子以及E-選擇素水平升高,誘導(dǎo)單核細(xì)胞黏附到血管內(nèi)皮、趨化白細(xì)胞聚集并損傷血管內(nèi)皮,加重局部炎癥反應(yīng)導(dǎo)致動(dòng)脈粥樣硬化血栓的形成[5]。2)Hp作為外源性抗原可增強(qiáng)動(dòng)脈局部免疫應(yīng)答,激活局部的免疫反應(yīng),誘導(dǎo)動(dòng)脈內(nèi)膜損傷,或通過(guò)增高氧自由基水平來(lái)介導(dǎo)免疫機(jī)制;尤其CagA陽(yáng)性菌株可通過(guò)加重免疫炎癥反應(yīng),參與早期動(dòng)脈粥樣硬化的形成,或通過(guò)抗原模擬與血管壁的表面抗原發(fā)生交叉反應(yīng)誘導(dǎo)血管損傷,在動(dòng)脈粥樣硬化機(jī)制中起重要作用[6]。3)Hp感染的低度炎癥可誘導(dǎo)體內(nèi)脂質(zhì)過(guò)氧化,引起低密度脂蛋白升高和高密度脂蛋白下降,導(dǎo)致血小板持續(xù)激活和不可逆性聚集,促進(jìn)血栓形成[7]。
本研究通過(guò)對(duì)不同證型頸動(dòng)脈粥樣硬化患者Hp感染狀況及相關(guān)基因的分析,Hp感染有可能通過(guò)誘導(dǎo)免疫和炎癥反應(yīng),導(dǎo)致脂質(zhì)代謝紊亂,促進(jìn)動(dòng)脈粥樣硬化的發(fā)生發(fā)展。Hp感染可能是痰濁內(nèi)阻證型頸動(dòng)脈粥樣硬化患者的危險(xiǎn)因素,其中CagA+VacA+優(yōu)勢(shì)顯著。
[1]李霞,竇逾常.缺血性中風(fēng)患者幽門(mén)螺旋桿菌感染狀況調(diào)查[J].北京中醫(yī)藥大學(xué)學(xué)報(bào),2008,31(2):138-144.
[2]Sawayama Y,Ariyama I,Hamada M,et al.Association between chronic Helicobacter pylori infection and acute ischemic stroke:Fukuoka Harasanshin Atherosclerosis Trial(FHAT)[J].Atherosclerosis,2005,178(2):303-309.
[3]Khairy P,Rinfret S,Tardif JC,et al.Absence of association between infection agents and endothelial function in healthy young men[J].Circulation,2003,107:1966-1971.
[4]Manolakis A,Kapsoritakis AN,Potamianos SP,et al.A review of the postulated mechanisms concerning the association of Helicobacter pylori with ischemic heart disease[J].Helicobacter,2007,12(4):287-297.
[5]Innocenti M,Thoreson AC,Ferrero RL,et al.Helicobacter pylori-induced activation of human endothial cells[J].Infect Immun,2002,70(8):4581-4590.
[6]Masoud SA,Arami MA,Kucheki E.Association between Infection with Helicobacter Pylori and Cerebral Non cardioembolic Ischemic Stroke [J].Neurol India,2005,53(3):303-306.
[7]Harangi M,Seres I,Magyar MT,et al.Association between human paraoxonase 1 activity and intima-media thickness in subjects under 55 years of age with carotid artery disease[J].Cerebrovasc Dis,2008,25(1-2):122-8.

