頭孢克洛膠囊溶出度質(zhì)量評(píng)價(jià)
顧 珉 扈春萍
(蘇州市藥品檢驗(yàn)所,江蘇 蘇州 215002)
頭孢克洛是第二代半合成頭孢菌素類(lèi)抗生素,1976年由美國(guó)禮來(lái)公司研制成功,1979年獲FDA批準(zhǔn),1982年在美國(guó)、日本等國(guó)上市,由于該藥物分子穩(wěn)定、對(duì)多數(shù)流行革蘭陽(yáng)性和陰性呼吸道病原菌有抑制活性、吸收迅速、>90%的生物利用度以及對(duì)呼吸道黏膜很好的滲透性,使該藥物在隨后的幾十年應(yīng)用廣泛,臨床用于治療呼吸道感染、泌尿道感染、淋病菌感染、膽道感染、外科創(chuàng)傷感染、乳腺炎、急性中耳炎、急性咽炎、扁桃體炎、麥粒腫、猩紅熱以及皮膚及軟組織感染[1]。目前國(guó)內(nèi)外有多個(gè)廠家生產(chǎn)頭孢克洛膠囊,本研究通過(guò)對(duì)市售的12個(gè)廠家生產(chǎn)的頭孢克洛膠囊的溶出度進(jìn)行比較研究,測(cè)定1個(gè)參比公司和11個(gè)仿制公司的頭孢克洛膠囊在四介質(zhì)的溶出度,使用相似因子法考察其溶出行為,比較不同公司藥品的內(nèi)在品質(zhì),以期能對(duì)不同廠家頭孢克洛膠囊的質(zhì)量作出客觀性評(píng)價(jià),為標(biāo)準(zhǔn)制訂提供參考。
1 儀器與試藥
1.1 儀器
RCZ-8B智能溶出度測(cè)定儀(天津市天大天發(fā)科技有限公司),UV2550型紫外可見(jiàn)分光光度計(jì)(島津儀器蘇州有限公司)。
1.2 藥品與試劑
頭孢克洛對(duì)照品(來(lái)源:中國(guó)藥品生物制品檢定所,批號(hào)130481-200503)。頭孢克洛膠囊(A廠,批號(hào):L01428;B廠,批號(hào):40510017;C廠,批號(hào):100621;D廠,批號(hào):100605;E廠,批號(hào):100401;F廠,批號(hào):100302;G廠,批號(hào):0T2C17;H 廠,批號(hào):1001222;I廠,批號(hào):100301,J廠,批號(hào):1001001;K廠,批號(hào):100502;L廠,批號(hào):1005010),規(guī)格均為0.25g。所用試劑均為分析純,水為純化水。
2 方法與結(jié)果
2.1 溶出介質(zhì)的配制
水:脫氣的蒸餾水。pH1.2緩沖液:取鹽酸7mL和氯化鈉2.0g,加水稀釋至1000mL,混勻,即得。pH 4.0緩沖液:取0.05mol/L醋酸溶液和0.05mol/L醋酸鈉溶液按16.4∶3.6的比例混合,即得。pH 6.8緩沖液:取0.2mol/L磷酸二氫鉀溶液250mL,加0.2mol/L氫氧化鈉溶液118mL,用水稀釋至1000mL,搖勻,即得。
2.2 對(duì)照品溶液
精密稱(chēng)取頭孢克洛對(duì)照品約25mg,置100mL容量瓶中,加溶出介質(zhì)溶解并稀釋至刻度,搖勻,精密吸取該溶液5mL置50mL容量瓶中,加溶出介質(zhì)稀釋至刻度,搖勻,作為對(duì)照品溶液。
2.3 溶出度測(cè)定條件
取“2.1”項(xiàng)下的四種溶液900mL為溶出介質(zhì),轉(zhuǎn)速為100r/min,照溶出度測(cè)定法(《中國(guó)藥典》2010年版二部附錄X C第一法)測(cè)定[2],分別于5、10、15、30、45、60定點(diǎn)取樣10mL,過(guò)濾,同時(shí)補(bǔ)充同溫度的溶出介質(zhì)10mL,過(guò)濾,精密量取上述續(xù)濾液5mL置50mL量瓶中,再加水稀釋至刻度,在264nm波長(zhǎng)處測(cè)定吸光度[2],計(jì)算溶出量。
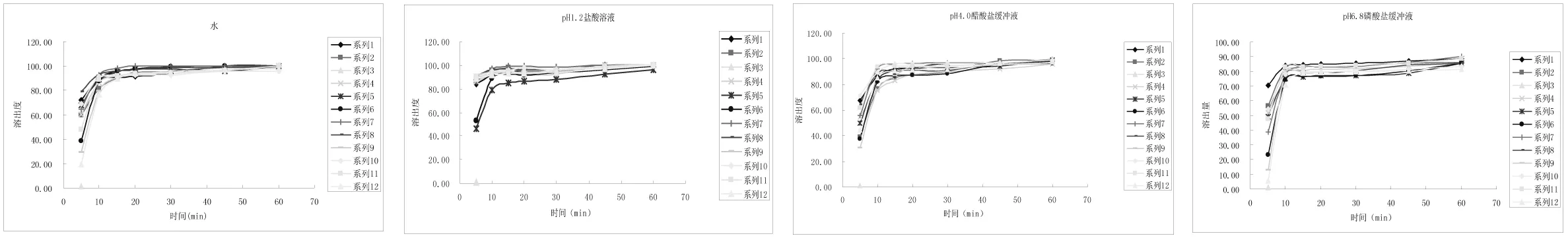
圖1 十二個(gè)廠家頭孢克洛膠囊溶出曲線
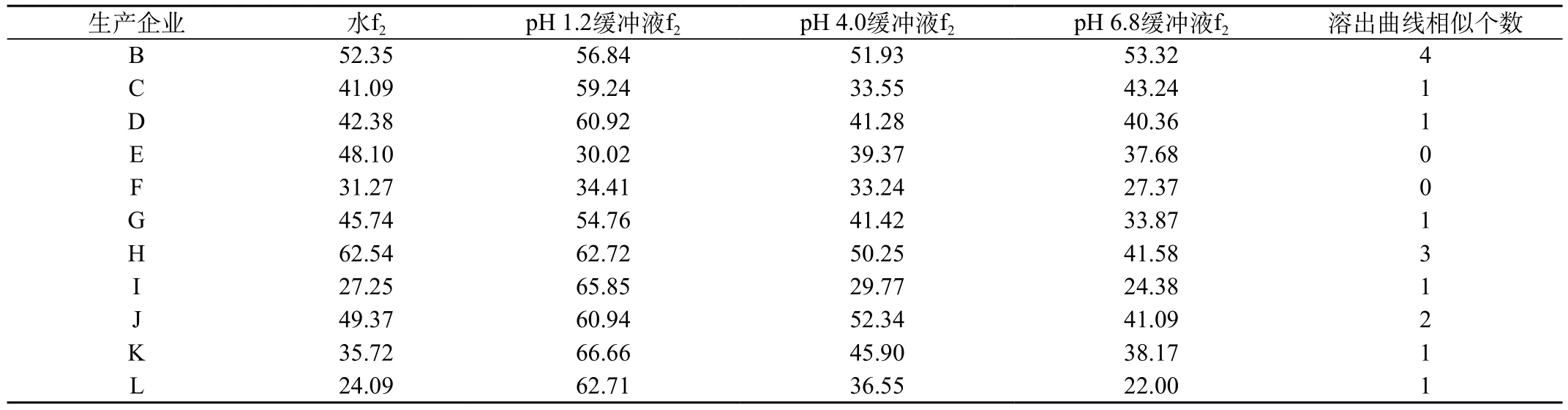
表1 以A公司為參比制劑其他公司樣品相似因子比較結(jié)果
2.4 溶出度的測(cè)定
取A公司(禮來(lái)蘇州制藥有限公司)的頭孢克洛膠囊為參比制劑,其他11家國(guó)內(nèi)公司生產(chǎn)的頭孢克洛膠囊為仿制制劑,照“2.3”項(xiàng)下的溶出條件測(cè)定溶出度。結(jié)果見(jiàn)圖1。
2.5 溶出曲線比較
目前,已報(bào)道有多種方法可以進(jìn)行溶出曲線的比較,常見(jiàn)方法有相似因子比較法、對(duì)數(shù)曲線法、機(jī)率單位法、指數(shù)模型法、Weibull法和Gompertz法等[3]。本文選擇A公司的產(chǎn)品為參比制劑,評(píng)價(jià)其他11家公司的產(chǎn)品,通過(guò)計(jì)算相似因子f2比較溶出行為的相似性(如果50≤f2≤100,則表示2個(gè)藥品的溶出度相似)以確定后者的溶出度與前者是否相似,統(tǒng)計(jì)結(jié)果見(jiàn)表1。
11家企業(yè)產(chǎn)品4條溶出曲線全部與參比制劑相似的僅有1家,3條相似的1家,2條相似的1家,1條相似的6家,4條均不相似的2家。比較仿制制劑與參比制劑的溶出行為,11家仿制制劑的質(zhì)量有顯著差異。結(jié)果也進(jìn)一步表明,即使同種藥品,由于不同廠家使用的原料來(lái)源、處方各異和生產(chǎn)過(guò)程中生產(chǎn)工藝條件的不同,產(chǎn)品的內(nèi)在質(zhì)量也可能存在差異。這些差異是否會(huì)導(dǎo)致生物利用度和臨床療效的不同,尚有待進(jìn)一步研究證實(shí)。
3 討 論
3.1 數(shù)據(jù)評(píng)價(jià)方法的選擇
溶出曲線可以對(duì)口服固體制劑的溶出過(guò)程進(jìn)行全面、準(zhǔn)確的監(jiān)測(cè),獲得的數(shù)據(jù)較單點(diǎn)溶出測(cè)定法更加完整、真實(shí)、可靠。四介質(zhì)溶出曲線的繪制和比較則全面考慮了人體內(nèi)對(duì)藥物的實(shí)際各個(gè)吸收部位的pH環(huán)境,已經(jīng)成為評(píng)價(jià)固體口服制劑內(nèi)在品質(zhì)和生物利用度的一個(gè)重要方法。本文采用相似因子比較法來(lái)比較不同藥品溶出曲線的相似度,該方法特點(diǎn)是對(duì)溶出度全過(guò)程進(jìn)行整體評(píng)價(jià),目前已被美國(guó)FDA和日本厚生省藥品管理部門(mén)等主流官方機(jī)構(gòu)所采納[4]。本文試驗(yàn)時(shí),選取了5、10、l5、30、45、60min共計(jì)6個(gè)時(shí)間點(diǎn)來(lái)計(jì)算f2因子值。
3.2 溶出介質(zhì)的選擇
3.2.1 《中國(guó)藥典》2010年版規(guī)定頭孢克洛膠囊溶出度的溶出介質(zhì)為水。通過(guò)各廠家樣品溶出曲線比較,用水或pH1.2鹽酸溶液作為溶出介質(zhì)來(lái)考察頭孢克洛膠囊的溶出量區(qū)分性并不是很好,所有樣品在這兩個(gè)介質(zhì)中15min以?xún)?nèi)溶出量均超過(guò)85%,并且水的pH值無(wú)法控制,在試驗(yàn)過(guò)程中易發(fā)生改變,用水作為溶出介質(zhì)不是很理想。
3.2.2 12個(gè)廠家的樣品在四種溶出介中的溶出趨勢(shì)總體上是一致的,總體而言溶出速率從快到慢依次為pH1.2鹽酸溶液>水>pH4.0醋酸鹽緩沖液>pH6.8磷酸鹽緩沖液。總體上隨著pH值的升高,頭孢克洛膠囊的溶出曲線趨于平緩,溶出速率變慢,從嚴(yán)格要求溶出度試驗(yàn)的前提下,應(yīng)該選擇四條溶出曲線中最難溶、溶出最慢的介質(zhì)[4]。
3.2.3 考慮到頭孢克洛膠囊經(jīng)口服后主要從腸道吸收,然后分布于全身組織中,胃的pH范圍從1.2~7.6,十二指腸pH值范圍在3.1~6.7,小腸pH值范圍在5.2~6.0,建議使用與在體內(nèi)釋放、吸收的主要部位的生理pH值接近的緩沖液作為質(zhì)量標(biāo)準(zhǔn)中的溶出介質(zhì)。
3.3 溶出度與處方工藝的相關(guān)性
根據(jù)實(shí)驗(yàn)結(jié)果,各家企業(yè)產(chǎn)品的質(zhì)量存在著明顯差異,這些差異是否系處方和生產(chǎn)工藝差異造成的,有待進(jìn)一步考察和研究。由于無(wú)法獲得所有12家企業(yè)的處方和生產(chǎn)工藝,目前還無(wú)法判斷各企業(yè)處方的科學(xué)性和合理性。從部分企業(yè)提供的資料來(lái)看,處方和工藝的差異確實(shí)造成了樣品溶出行為的差異性。
[1] 許思忠.頭孢克洛的合成[J].國(guó)外醫(yī)藥:抗生素分冊(cè),1994,15(6):414-418.
[2] 國(guó)家藥典委員會(huì).中國(guó)藥典(二部)[S].北京:中國(guó)醫(yī)藥科技出版社,2010:188.
[3] 夏錦輝,劉昌孝.固體藥物制劑的體外溶出度的統(tǒng)計(jì)學(xué)評(píng)價(jià)分析[J].中國(guó)藥學(xué)雜志,2000,35(2):130-131.
[4] 謝沐風(fēng).溶出曲線相似性的評(píng)價(jià)方法[J].中國(guó)醫(yī)藥工業(yè)雜志,2009,40(4):308-311.

