角蛋白酶的研究進展
華南農業大學天然農藥與化學生物學教育部重點實驗室 王秋影 廖美德*
羽毛角蛋白的主要結構是β-角蛋白,該類蛋白中存在大量的二硫鍵、氫鍵和疏水鍵,交聯度大,不可溶,不能被常見蛋白酶所降解(Wang等,2008)。因此,這些羽毛廢棄物大多未被充分利用,有的甚至污染環境,造成公害,同時也存在蛋白質資源浪費問題(Gousterova等,2005)。角蛋白酶是能夠有效水解不溶性角蛋白的一類蛋白水解酶,可由一些昆蟲和微生物產生(Gradiar等,2005;Suntornsuk等,2005)。利用角蛋白酶的生物方法降解羽毛角蛋白,可將羽毛等廢棄角蛋白直接轉變成蛋白質或復合氨基酸,變廢為寶,既保護環境又可以實現資源再利用,產生顯著的經濟和社會效益(張啟等,2008)。本文就角蛋白酶的微生物來源、生化性質、基因工程研究等方面進行探討,以期為相關研究提供參考。
1 角蛋白酶的微生物來源
角蛋白酶主要來自具有角蛋白降解活性的微生物,包括真菌、放線菌和細菌。產生角蛋白酶的微生物品種繁多(表1),但只有很少的菌株具有商業開發價值。運用分子生物學及基因工程學手段,加強微生物表達和分泌角蛋白酶的研究,進而實現其在工業領域的應用價值,是當前該領域的熱門課題之一。
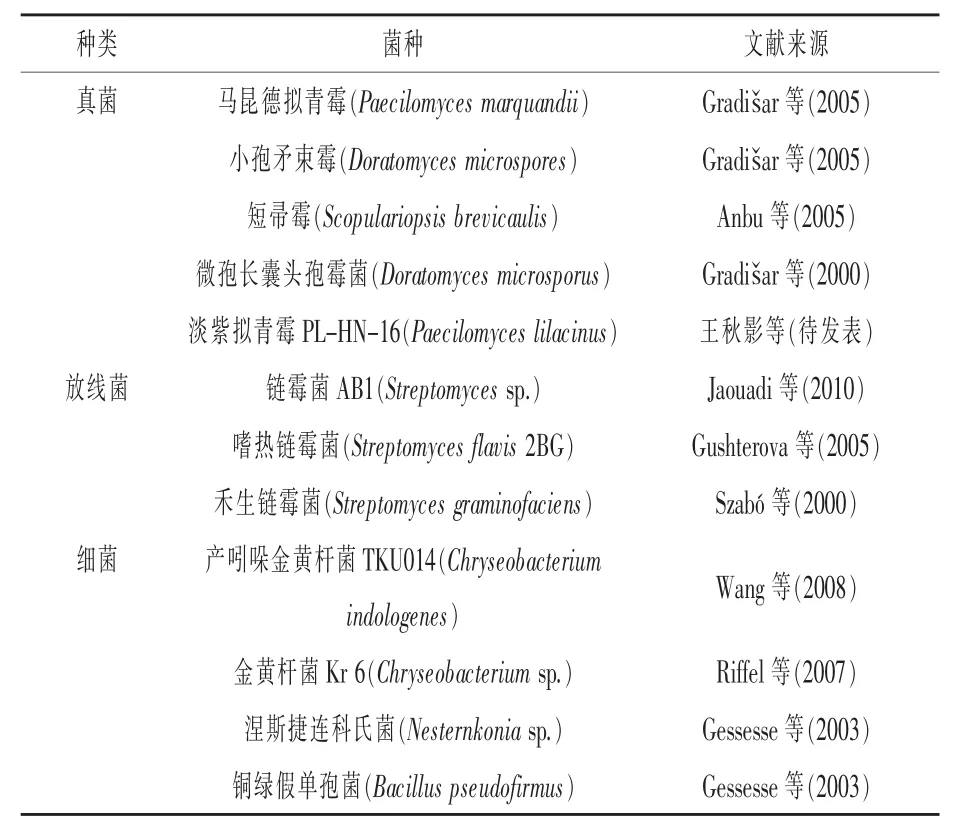
表1 產角蛋白酶的菌株
在篩選羽毛角蛋白降解菌過程中發現,淡紫擬青霉PL-HN-16具有良好的羽毛降解活性(王秋影等,待發表)。淡紫擬青霉屬于擬青霉屬真菌。目前關于擬青霉屬降解角蛋白的報道較少。譚盈盈等(2005)和Tan等(2004)從畜禽養殖場污水污泥中分離到了一株羽毛降解菌,初步鑒定為擬青霉菌株(Paecilomyces sp),并對該菌株進行了初步研究。Gradiar等(2005)研究發現,馬昆德擬青霉MZKI B639可產角蛋白酶。此外,Cavello等(2012)研究報道,淡紫擬青霉LPS 876可產角蛋白酶。
2 角蛋白酶的理化性質
角蛋白酶來源不同,其結構、理化性質、水解活性以及最佳作用底物不同。目前已發現的角蛋白酶多為絲氨酸蛋白酶和金屬蛋白酶,以絲氨酸蛋白酶居多。根據其最佳作用pH,可以把角蛋白酶分為酸性酶和堿性酶,大多角蛋白酶屬于堿性酶。角蛋白酶大多屬于胞外酶,少數屬于胞內酶,如雞禽毛癬菌(Trichophytongallinae)角蛋白酶(李明珠等,2010;Wawrzkiewicz等,1987)。 酶學性質研究的結果表明,該酶類的分子質量為18~240kDa,大多數是為30 kDa左右,最適溫度范圍為30~80℃,多數在40~60℃,最適pH 7.5~10,少數偏微酸性,如須毛癬菌角蛋白酶 (Tsuboi等,1989)。如上所述,王秋影等(待發表)研究表明,淡紫擬青霉PL-HN-16角蛋白粗酶的最適作用溫度為40℃,最佳作用pH為8.0,是一個比較溫和的堿性角蛋白降解酶。
角蛋白酶作用底物除角蛋白外,還包括多種多肽和其他蛋白質,如:膠原蛋白、酪蛋白、彈性蛋白、血紅蛋白、明膠和卵蛋白等(Jaouadi等,2010;Wang等,2008)。也有一些角蛋白酶的底物范圍很窄,如密旋鏈霉菌(Streptomyces pactum)所產的角蛋白酶,對底物表現出高度的立體選擇性和二級結構專一性,能快速分解鳥類羽毛,但較難利用其他天然角蛋白(Bo·ckle等,1995)。角蛋白酶活性受到多種因素的影響,多數角蛋白酶的活性表達依賴低濃度二價金屬離子Ca2+、Mg2+等的存在,而一些金屬離子 (Hg2+、A13+等)則抑制其活性(Jaouadi等,2010;Cai等,2008)。 絲氨酸角蛋白酶酶活可被苯甲基磺酰氟(PMSF)所抑制,金屬角蛋白酶酶活可被EDTA等所抑制(Jaouadi等,2010;Thys等,2004)。來源不同的角蛋白酶具有不同的專一性抑制劑,這或許暗示著角蛋白酶的進化起源不同(李江等,2006)。
由于角蛋白、明膠和膠原等結構纖維蛋白具有緊密的空間結構,限制了蛋白酶與其潛在的裂解位點靠近與結合,其只能被很少的蛋白酶所降解。Kim等 (2004)研究報道了角蛋白酶Fervidolysin酶原的晶體結構,發現該酶原為1.7A0的晶體結構,由4個結構域組成,即1個催化結構域(CD)、2 個 β-折疊結構域(SDs)以及 1 個肽鍵結構域(PD),Fervidolysin酶原與降解一般蛋白底物的subtilisin E酶原PD~SD亞結構親緣關系較遠;與人類降解纖維聚合體底物—明膠的metalloprotease-2酶原的空間結構類似,暗示著 Fervidolysin酶原與 metalloprotease-2酶原的纖連蛋白樣結構域有著功能相關性。這表明,角蛋白酶與降解不溶性底物的蛋白酶可能具有更相似的空間結構特性。多結構域蛋白Fervidolysin酶原的晶體結構為解釋酶原激活以及非催化結構域的作用提供了新視野。
3 角蛋白酶的基因工程研究
3.1 角蛋白酶編碼基因 目前,雖然篩選到了大量的角蛋白酶產生菌,但克隆到的角蛋白酶基因卻相對較少。部分角蛋白酶基因見表2,其中以源自地衣芽胞桿菌的KerA研究得最為透徹。

表2 微生物角蛋白酶編碼基因
3.2 角蛋白酶的表達 在角蛋白酶的表達研究中,對KerA基因研究得最多,涉及大腸桿菌、枯草芽孢桿菌和酵母3類表達系統。Lin等(1997)將KerA基因轉入蛋白酶缺陷的枯草芽孢桿菌(Bacillus subtilis)菌株 DB104 中,轉化子 FDB-3、FDB-108和FDB-29可以在含羽毛的LB培養基中分泌角蛋白酶,而原始菌株在LB培養基中無角蛋白酶活性。轉化子FDB-29的角蛋白酶產量是原始菌株的3.5倍,推測是因在其啟動子Pker上結合了營養型啟動子P43而增強KerA基因的表達所致。Porres等(2002)把KerA基因和編碼前肽的1.2 kb DNA片段克隆后轉化至巴斯德畢赤酵母(Pichia pastoris)X33中表達,轉化子 pPICZa-A-kerA在甲醇誘導后可產生重組酶,144 h后產量為124 mg/L。重組的角蛋白酶為糖基化酶,與天然地衣芽孢桿菌角蛋白酶的性質相似。
角蛋白酶的基因工程研究已日漸開展 (表3),但仍存在表達蛋白以包涵體形式存在,不利于蛋白活性的研究;異源蛋白的表達對宿主菌產生毒性,限制宿主菌的生長;在表達量積累過程中,堿性蛋白酶會造成自身降解;單位表達量低,高效表達較困難等諸多問題,難以在生產實踐中應用(李明珠等,2010)。
4 角蛋白酶的發酵調控技術研究
多數產角蛋白酶微生物發酵起始pH為6~9,發酵溫度為28~50℃,少數嗜熱微生物發酵溫度控制在70℃左右,如熱厭氧桿菌屬(Thermoanaerobacter)和閃爍桿菌屬(Fervidobacterium sp.)等(蔡成崗,2007)。 在培養基組成方面,羽毛、羽毛粉、羊毛、角、毛發等角蛋白為碳和氮源時可以誘導角蛋白酶的產生,其他碳源和氮源類物質對角蛋白酶的發酵具有一定的影響。Wang和Shih(1999)對原始地衣芽孢桿菌PWD-1和重組枯草芽孢桿菌FDB-29的最佳發酵過程進行了探討。結果表明,兩者產生的角蛋白酶均可由蛋白類物質誘導,而被糖類物質抑制。發酵過程中6~10 h的種齡對于PWD-1后續發酵產酶很關鍵,而FDB-29對種齡不敏感。培養過程中發酵液pH由7.0上升到8.5。PWD-1生長最適溫度為50℃,兩菌株產酶最適溫度均為37℃,最佳溶氧水平分別為10%和20%。當在50℃培養PWD-1菌體8 h后,轉移到37℃發酵使酶產量提高了10倍。在發酵條件分別優化后,PWD-1比FDB-29菌株的終產酶水平高40%。Harde等(2011)采用單因子法、L8正交表設計試驗和響應面分析法,探討了碳源、氮源和pH對角蛋白酶產量的影響,研究認為,羽毛、氯化銨、磷酸氫二鉀以及硫酸錳是顯著因子,最終優化后的培養基使角蛋白酶的最大產量提高到12.32 kU/mL。Ni等(2011)研究發現,羽毛濃度為20 g/L,發酵起始pH為8.0時,地衣芽孢桿菌ZJUEL31410角蛋白酶產生效果最理想,酶活達54.9 U/mL,羽毛降解率為72.4%,氨鹽和硝酸鹽可強烈抑制角蛋白酶的產量和羽毛的降解。

表3 微生物角蛋白酶基因的表達
5 角蛋白酶降解角蛋白的機理研究
角蛋白的降解是一個非常復雜的過程。由于不同微生物所產生的角蛋白酶性質不同,其降解角蛋白的機制也不盡相同。由最初的高級結構降解為次級結構到角蛋白分子的完全溶解存在著明顯的差異,這一過程如何由微生物或角蛋白酶主導并完成至今還未完全闡明。目前普遍認為,微生物降解角蛋白的過程可分為變性作用、水解作用和轉氨基作用三個步驟。
黃林等(2006)提出,角蛋白酶是一種復合酶,其中含有特異裂解二硫鍵的二硫鍵還原酶和使多肽水解的多肽水解酶。其降解過程為:首先,二硫鍵還原酶作用于角蛋白二硫鍵,將胱氨酸 (-SS-)還原為半胱氨酸(-SH),使角蛋白高級結構解體而形成變性角蛋白,變性角蛋白在多肽水解酶作用下逐漸水解成多肽、寡肽和游離氨基酸,最后由轉氨基作用產生氨氣和硫化物而使角蛋白徹底水解。在角蛋白降解過程中,角蛋白中的硫主要轉化成巰基化合物、硫化氫(H2S)和硫酸鹽三種含硫化合物存在于分解產物中。
有研究表明,淡紫擬青霉PL-HN-16在以鵝毛為氮源的培養過程中,培養液會出現胨化現象,培養至第3天時,培養液開始變稠呈胨狀,鵝毛幾乎全部消失,發酵液呈乳白色,會附著在瓶壁上,隨著發酵時間的延長,發酵液會越來越黏稠,胨化更加顯著,繼續培養1周后,發酵液會再次逐步液化,整個過程約需20 d。研究認為,這可能是由于淡紫擬青霉角蛋白酶為復合酶,具有二硫鍵還原酶活性,能首先打開底物的二硫鍵,使角蛋白的高級結構被破壞,將角蛋白解聚變成單體并進一步將其變為纖絲;盡管培養液中的蛋白總濃度不變,但角蛋白解聚后,培養液中的絲蛋白濃度變大,導致培養液出現胨狀物;而后在復合蛋白酶的作用下,將絲蛋白進一步水解為多肽、寡肽和游離氨基酸,這樣就會增加其溶解度,最終呈現液化狀態。但由于角蛋白的降解機制非常復雜,淡紫擬青霉角蛋白酶作用機理尚待進一步研究(王秋影等,待發表)。
6 展望
綜上所述,角蛋白的微生物降解與利用備受關注。然而,目前對角蛋白酶的認識還不夠深入。國外一些學者的研究工作,已涉及角蛋白酶高級結構、活性表達分子基礎以及酶工程等分子生物學研究。而國內對角蛋白酶的研究還停留在角蛋白酶產生菌的分離、篩選,角蛋白酶的分離純化與理化性質的研究,以及角蛋白酶的作用機制的初步階段,研究的對象也極其有限,且以胞外酶的研究為主,對胞內酶的研究甚少。已報道的角蛋白酶表達菌株的產量及酶活相對天然菌株并不是完全具有明顯的優勢,與工業生產的要求還存在一定距離,因而在菌種篩選、基因改造和載體選擇方面還需進一步研究,以提高角蛋白酶的產量和活性,使其更好的應用于工業生產。
[1]蔡成崗.角蛋白酶生產菌株選育、發酵與分離純化研究:[博士學位論文][D].杭州:浙江大學,2007.
[2]黃林,熊智強,蔡華靜,等.鏈霉菌降解角蛋白的生化機制研究[J].微生物學通報,2006,33(4):36 ~ 42.
[3]李江,石鵬君,張王照,等.弗氏鏈霉菌絲氨酸蛋白酶基因的克隆及表達[J].生物工程學報,2005,21(5):782 ~ 788.
[4]李江,姚斌,范云六.微生物角蛋白酶的分子生物學研究進展[J].工業微生物,2006,36(3):37 ~ 42.
[5]李明珠,王雁萍,秦廣雍.角蛋白酶的研究現狀及發展前景[J].安徽農業科學,2010,38(4):1689 ~ 1692.
[6]閔杰.金黃桿菌來源的角蛋白酶的分離純化和酶學性質研究:[碩士學位論文][D].杭州:浙江大學,2008.
[7]譚盈盈,馮繼勤,鄭平.擬青霉菌株Z-1降解羽毛角蛋白特性的研究[J].浙江大學學報,2005,31(1):82 ~ 87.
[8]張啟,魏冬凱,曹張軍,等.嗜麥芽窄食單胞菌DHHJ角蛋白酶的純化及酶解研究[J].環境污染與防治,2008,30(4):40 ~ 43.
[9]王秋影,廖美德,王劉慶,等.淡紫擬青霉角蛋白酶特性初步研究[J].西北農林科技大學學報,2012,待發表.
[10]Anbu P,Gopinath S C B,Hilda A,et al.Purifcation of keratinase from poultry farm isolate-Scopulariopsis brevicaulis and statistical optimization of enzyme activity[J].Enzyme Microb Technol,2005,36:639 ~ 647.
[11]B·ockle B,Galunsky B,Müller R.Characterization of a keratinolytic serine proteinase from Streptomyces pactum DSM 40530[J].Appl Environ Microbiol,1995,61:3705 ~ 3710.
[12]Cai C G,Chen J S,Qi J J,et al.Purification and characterization of keratinase from a new Bacillus subtilis strain[J].Journal of Zhejiang University,2008,9:713 ~ 720.
[13]Cavello I A,Cavalitto S F,Hours R A.Biodegradation of a keratin waste and the concomitant production of detergent stable serine proteases from Paecilomyces lilacinus[J].Appl Biochem Biotechnol,2012,167:945 ~ 958.
[15]Gessesse A,Hatti-Kaul R,Gashe B A,et al.Novel alkaline proteases from alkaliphilic bacteria grown on chicken feather[J].Enzyme Microb Technol,2003,32:519 ~ 524.
[16]Gousterova A,Braikova D,Goshev I,et al.Degradation of keratin and collagen containing wastes by newly isolated thermoactinomycetes or by alkaline hydrolysis[J].Lett Appl Microbiol,2005,40:335 ~ 340.
[18]Gushterova A,Vasileva-Tonkova E,Dimova E,et al.Keratinase production by newly isolated Antarctic actinomycete strains[J].World J Microbiol Biotechnol,2005,21:831 ~ 834.
[19]Harde S M,Bajaj I B,Singhal R S.Optimization of fermentative production of keratinase from Bacillus Subtilis NCIM 2724[J].Agric Food Anal Bacterio,2011,1:54 ~ 65.
[20]Jaouadi B,Abdelmalek B,Fodil D,et al.Purification and characterization of a thermostable keratinolytic serine alkaline proteinase from Streptomyces sp.strain AB1 with high stability in organic solvents[J].Bioresour Technol,2010,101:8361 ~ 8369.
[21]Kluskens L D,Voorhorst W G,Siezen R J,et al.Molecular characterization of fervidolysin,a subtilisin-like serine protease from the thermophilic bacterium Fervidobacterium pennivorans[J].Extremophiles,2002,6:185 ~ 194.
[22]Kim J S,Kluskens L D,de Vos W M,et al.Crystal structure of fervidolysin from Fervidobacterium pennivorans,a keratinolytic enzyme related to subtilisin[J].J Mol Biol,2004,335:787 ~ 797.
[23]Lin X,Kelemen D W,Miller E S,et al.Nucleotide sequence and expression of kerA,the gene encoding a keratinolytic protease of Bacillus licheniformis PWD-1[J].Appl Environ Microbiol,1995,61:1469 ~ 1474.
[24]Lin X,Wong S L,Miller E S,et al.Expression of the Bacillus licheniformis PWD-1 keratinase gene in B.subtilis[J].J Ind Microbiol Biotechnol,1997,19:134 ~ 138.
[25]Li J,Shi P J,Han X Y,et al.Functional expression of the keratinolytic serine protease gene sfp2 from Streptomyces fradiae var.k11 in Pichia pastoris[J].Protein Expres Purif,2007,54:70 ~ 86.
[26]Mitsuiki S,Ichikawa M,Oka T,et al.Molecular characterization of a keratinolytic enzyme from an alkaliphilic Nocardiopsis sp.TOA-1[J].Enzyme Microb Technol,2004,34:482 ~ 489.
[27]Macedo A J,da Silva W O B,Gava R,et al.Novel keratinase from Bacillus subtilis S14 exhibiting remarkable dehairing capabilities[J].Appl Environ Microb,2005,71:594 ~ 596.
[28]Ni H,Che n Q H,Chen F,et al.Improved keratinase production for feather degradation by Bacillus licheniformis ZJUEL31410 in submerged cultivation[J].Afr J Biotechnol,2011,10:7236~7244.
[29]Porres J M,Benito M J,Lei X G.Functional expression of keratinase(ker-A)gene from Bacillus licheniformis in Pichia pastoris[J].Biotechnol Lett,2002,24:631 ~ 636.
[30]Riffel A,Brandelli A,Bellato C M,et al.Purifcation and characterization of a keratinolytic metalloprotease from Chryseobacterium sp.kr6[J].J Biotechnol,2007,128:693 ~ 703.
[31]Radha S,Gunasekaran P.Cloning and expression of keratinase gene in Bacillus megaterium and optimization of fermentation conditions for the production of keratinase by recombinant strain[J].J Appl Microbiol,2007,103:1301~1310.
[32]Szabó I,Benedek Aˊ,Mihály Szabó I,et al.Feather degradation with a thermotolerant Streptomyces graminofaciens strain [J].World J Microbiol Biotechnol,2000,16:253 ~ 255.
[33]Suntornsuk W,Tongjun J,Onnim P,et al.Purification and characterisation of keratinase from a thermotolerant feather-degrading bacterium[J].World J Microbiol Biotechnol,2005,21:1111 ~ 1117.
[34]Saravanabhavan S,Aravindhan R,Thanikaivelan P,et al.A source reduction approach:Integrated bio-based tanning methods and the role of enzymes in dehairing and fibre opening[J].Clean Technol Envir,2005,7:3 ~ 14.
[35]Tsuboi R,Ko I,Takamori K,et al.Isolation of a keratinolytic proteinase from Trichophyton mentagrophytes with enzymatic activity at acidic pH[J].Infect Immun,1989,57:3479 ~ 3483.
[36]Tan Y Y,Zheng P,Hu B L,et al.Feather degradation by Paecilomyces sp.isolated from sewage sludge[J].Journal of Zhejiang University,2004,30:618~623.
[37]Thys R C,Lueas F S,Riffcl A,et al.Characterization of a protease of a feather-degrading microbacterium species[J].Lett Appl Microbiol,2004,39:181~186.
[38]Thanikaivelan P,Rao J R,Nair B U,et al.Progress and recent trends in biotechnologicalmethodsforleatherprocessing [J].TrendsBiotechnol,2004,22:181 ~ 188.
[39]Tiwary E,Gupta R.Extracellular expression of keratinase from Bacillus licheniformis ER-15 in Escherichia coli[J].J Agric Food Chem,2010,58:8380~8385.
[40]Varbanets L D.Current trends in the study of microbial glycopolymers[J].Mikrobiol Z,2003,65:182 ~ 190.
[41]Wawrzkiewicz K,Lobarzewski J,Wolski T.Intracellular keratinase of Trichophyton gallinae[J].J Med Vetern Mycol,1987,25:261 ~ 268.
[42]Wang J J,Shih J C H.Fermentation production of keratinase from Bacillus licheniformis PWD-1 and a recombinant B.subtilis FDB-29[J].J Ind Microbiol Biotechnol,1999,22:608 ~ 616.
[43]Wang S L,Hsu W T,Liang T W,et al.Purification and characterization of three novel keratinolytic metalloproteases produced by Chryseobacterium indologenes TKU014 in a shrimp shell powder medium[J].Bioresour Technol,2008,99:5679 ~ 5686.

