玉米ACE抑制肽水解酶的篩選及酶解條件的優化
宋 亮,曹龍奎,,*,刁靜靜,佟萬兵,劉洪儒
(1.黑龍江八一農墾大學食品學院,黑龍江大慶163319;2.黑龍江省農產品加工工程技術研究中心,黑龍江大慶163319)
玉米ACE抑制肽水解酶的篩選及酶解條件的優化
宋 亮1,曹龍奎1,2,*,刁靜靜2,佟萬兵1,劉洪儒1
(1.黑龍江八一農墾大學食品學院,黑龍江大慶163319;2.黑龍江省農產品加工工程技術研究中心,黑龍江大慶163319)
酶解玉米蛋白粉(蛋白含量為70%)制備血管緊張素轉換酶(angiotensin converting enzyme,ACE)抑制肽,通過酶的篩選實驗確定了AS.1398中性蛋白酶作為最佳水解酶,在此基礎上,進行pH、溫度、底物濃度、加酶量[E]∶[S]的單因素實驗,并且確定4種因素的參數值進行L9(34)正交實驗,采用體外檢測ACE抑制率和肽得率為指標來確定最佳工藝條件。研究結果表明,選用AS.1398中性蛋白酶作為水解酶,水解時間在2h時,pH7.0,溫度50℃,底物濃度5%,加酶量[E]∶[S]為1.5∶100,得到的最大ACE抑制率為85.65%,肽得率為58.64%。
玉米蛋白,ACE抑制肽,ACE抑制率,肽得率
Abstract:Enzymatic hydrolysis of corn protein powder(protein content 70%) to produce ACE inhibitory peptides,by the enzymatic screening test to determine the AS.1398 neutral protease enzyme as the best,on this basis,used the pH,temperature,substrate concentration,the amount of enzyme[E]∶[S]in the single-factor test and determined the four factors in L9(34) orthogonal test,through vitro study to detect ACE inhibition rate and yield of peptide as indicators to determine the optimum technology conditions.The result indicated that AS.1398 neutral protease was the best hydrolytic enzyme,when the hydrolysis time in 2h,pH7.0,temperature 50℃,5%substrate concentration,the amount of enzyme[E]∶[S]1.5∶100,and the maximum ACE inhibition rate was 85.65%,the yield of peptide was 58.64%.
Key words:corn protein;ACE inhibitory peptides;ACE inhibition rate;yield of peptide
高血壓是影響人類健康最常見的慢性非傳染性疾病,主要通過腎素-血管緊張素系統(RAS)調節。在RAS系統中,腎素血管緊張素轉換為血管緊張素I(AT-I),然后通過ACE轉換為血管緊張素II(AT-II),從而導致了不良的血管收縮率而發生高血壓;另外ACE也可以使得舒緩基肽失活,進而失去使血管壁收縮的能力,使血壓升高。目前使用化學合成藥物如:卡托普利,阿拉普利等治療高血壓,然而,這些藥物會產生一些不良反應,例如:咳嗽,味覺紊亂和皮疹;因此它們治療高血壓的應用得到了限制。雖然天然的ACE抑制肽降壓效果不如體外藥物效果好,但是具有無毒副作用和低醫療成本的優點,而且,這些肽有多種功能特性,很容易被人體吸收并且具有較高的營養價值,有助于人體健康,具有廣闊的應用前景[1-3]。我國對降血壓肽的研究起步較晚,但報道漸多,前景看好。于勝男[4]等利用堿性蛋白酶酶解大豆蛋白,在6h左右達到最大抑制率68.54%;辛志宏[5]等則從酶解小麥胚芽蛋白中分離純化得到Val-Trp和Ala-Met-Tyr兩種降血壓肽;王婷[6]等酶解葵花籽粕蛋白并確定了最佳參數組合,得到產品IC50值為6.06mg/mL。而在國外,Suh等[7]從玉米黃粉中分離出序列為Pro-Ser-Gln-Tyr-Tyr的一種膜結合蛋白肽,IC50為100μmol/L;S Yano[8]等在此基礎上又分離出30余種玉米短肽,具有較低的IC50值。S Miyoshi等[9]報道了玉米醇溶蛋白酶解得到的Leu-Pro-Pro是迄今發現的蛋白水解得到最好的ACE抑制肽。蛋白質序列中具有ACE抑制活性的區域可通過酶解的方法釋放出來,也就是說人們可以從食品蛋白質中通過酶降解的方法獲得降血壓肽,這將成為研究開發治療高血壓藥物的又一新途徑[10]。本實驗以蛋白含量為70%的玉米蛋白粉為原料,通過進行酶的篩選實驗得出最佳水解用酶,經單因素實驗篩選出性能較好的制備玉米ACE抑制肽的水解酶并確定其最優的水解時間,以水解溫度、水解pH、加酶量[E]∶[S]、底物濃度為單因素,選出適合正交實驗的參數范圍,進行正交實驗和方差分析,選出最優組合,為工業化生產提供可行性的工藝。
1 材料與方法
1.1 材料與儀器
玉米蛋白粉(蛋白含量70%) 黑龍江昊天玉米開發有限公司;Alcalase 2.4L堿性蛋白酶(酶活力為1.2×105U/g)、AS.1398中性蛋白酶(酶活力為2.0×105U/g)、風味蛋白酶Flavourzyme(酶活力為1.5×105U/g)、胰蛋白酶(酶活力為2.5×105U/g) 丹麥諾維信公司;馬尿酰組氨酸亮氨酸Hip-His-Leu(HHL) ACE sigma公司;其他試劑 均為國產分析純。
LNK—871型凱式定氮儀 江蘇省宜興市科教儀器研究所;AR2140型電子分析天平、Delta-320型pH計 上海梅特勒—托利多儀器有限公司;DK-S24型電熱恒溫水浴鍋 上海森信實驗儀器有限公司;JJ-1精密增力電動攪拌器 常州國華電器有限公司;TGL-16B型臺式離心機 上海安亭科學儀器廠制造;T6紫外可見分光光度計 北京普析通用儀器有限公司;B-191型噴霧干燥器 BUCHI SWITERLAND。
1.2 實驗方法
1.2.1 蛋白質含量的測定 采用凱式定氮法。
1.2.2 玉米蛋白粉的預處理 將原料玉米蛋白粉經粉碎機粉碎后過100目篩,收集過篩后的淡黃色粉末,再95%乙醇作為浸提劑去掉玉米黃色素,得到酶解底物[11]。
酶解底物在水解前應進行預熱處理,將玉米蛋白粉溶解于蒸餾水中,在100℃下煮沸5~10min,目的是打破蛋白分子內部的結構,使蛋白酶的作用位點增加,不僅提高酶解速度,還能增加水解液中肽含量,增加肽水解得率,使其盡可能的水解完全。所以,水解前進行短時間高溫預處理對整個水解過程是必要的[12]。
1.2.3 ACE抑制多肽的制備 稱取一定量處理過的玉米蛋白粉,加蒸餾水溶解,100℃加熱10min,降至酶的最適溫度,使pH達到酶作用的最適范圍,加入一定量酶,啟動反應。水解過程中,滴加1mol/L的NaOH使pH保持在酶作用的最適pH,水解一定時間后,結束反應,加熱煮沸滅酶,以4000r/min離心20min后即得到上清液[13];之后經過噴霧干燥得到粉末狀ACE抑制多肽。
1.2.4 肽得率的測定 采用半微量凱式定氮法測定肽得率。將水解液于4000r/min離心20min,澄清玉米肽液,收集上清液。準確稱取沉淀質量,并用其中蛋白質含量,計算玉米肽得率[14]。
肽得率(%)=[1-(沉淀物中的蛋白質含量×沉淀物質量)/水解蛋白質總質量]×100
1.2.5 ACE抑制活性檢測[15]本實驗采取體外檢測法,取100μL HHL(5mmol/L)和40μL玉米ACE抑制劑(濃度5%)混合于37℃下保溫3min后,加入ACE(活力單位0.33U/mL)10μL,混勻后于37℃下保溫30min,再加入250μL的1mol/L HCl,終止反應,再加入1.7mL的乙酸乙酯經15s振蕩后,以10000r/min離心10min,吸取1.0mL的乙酸乙酯層,放入85℃烘箱干燥1h,加入3mL去離子水,混勻后于228nm下測定吸光值。對照組除了不加抑制劑,空白組除在反應前后加入0.2mL 1mol/L HCl外,其余操作與反應管相同。
ACE抑制率(%)=(ODa-ODb)/(ODa-ODc)×100
式中,ODa為對照組;ODb為樣品組;ODc為空白組。
1.2.6 酶解單因素實驗 酶解單因素實驗的基本條件:pH7.0,底物濃度5%,加酶量[E]∶[S]為1∶100,溫度50℃,改變其中一個條件,固定其他條件以分別考察pH、底物濃度、加酶量、溫度對ACE抑制率和肽得率的影響。各因素水平梯度分別為:pH:5.0、6.0、7.0、8.0、9.0;底物濃度:3%、5%、7%、9%、11%;加酶量[E]∶[S]:0.5∶100、1∶100、1.5∶100、2∶100、2.5∶100;溫度:40、45、50、55、60℃。
1.2.7 酶解正交實驗及方差分析 通過對酶的篩選及單因素實驗的結果進行分析,選擇影響ACE抑制率最大的幾個因素進行正交實驗,正交實驗水平設計如表1,選擇最優參數組合,并且進一步進行驗證實驗。

表1 正交實驗設計因素水平表Table 1 The levels and factors of orthogonal experiment design
1.2.8 數據分析 所得數據均為3次重復的平均值,原始數據的整理及作圖采用Microsoft Excel(Office2003)軟件完成;數據處理采用正交助手軟件。
2 結果與分析
2.1 不同酶對ACE抑制率和肽得率的影響
蛋白酶是水解肽鍵的專一酶類,其來源豐富,種類繁多,各種蛋白酶對肽鍵的作用方式和作用位點有很大區別,所以生成的肽段結構和數量也不一樣,因而產生了不同的抑制作用,如表2所示。
根據賈俊強等[16]對降血壓肽結構的分析,與降血壓肽活性密切相關的是C端氨基酸性質。因此,在選酶時,主要考慮蛋白被水解后水解產物C端的氨基酸性質,當Tyr、Pro、Trp、Phe和Leu出現在小肽的C端時,該肽可能具有極強的降血壓活性。因此,選酶時應首先選擇酶切位點在Tyr、Pro、Trp、Phe和Leu的疏水性蛋白酶。雖然原料玉米蛋白粉中的疏水性氨基酸含量較高,但是堿性蛋白酶、風味蛋白酶作用位點廣譜,酶解出來的肽含量比較多,有降血壓功效的肽就比較少,胰蛋白酶作用位點在Lys和Arg之后,酶解出的肽降壓效果就更小;而AS.1398中性蛋白酶的作用位點在Leu和其他氨基酸殘基,而原料玉米蛋白粉中亮氨酸(Leu)含量為16.3%,遠遠高于其他氨基酸含量,所以從酶的專一性和降壓肽結構特點來說,采用AS.1398中性蛋白酶酶解出的肽的降血壓效果比其他蛋白酶酶解出的肽的降壓效果要好。

表2 蛋白酶及水解特性Table 2 The hydrolysis characteristics of different proteases
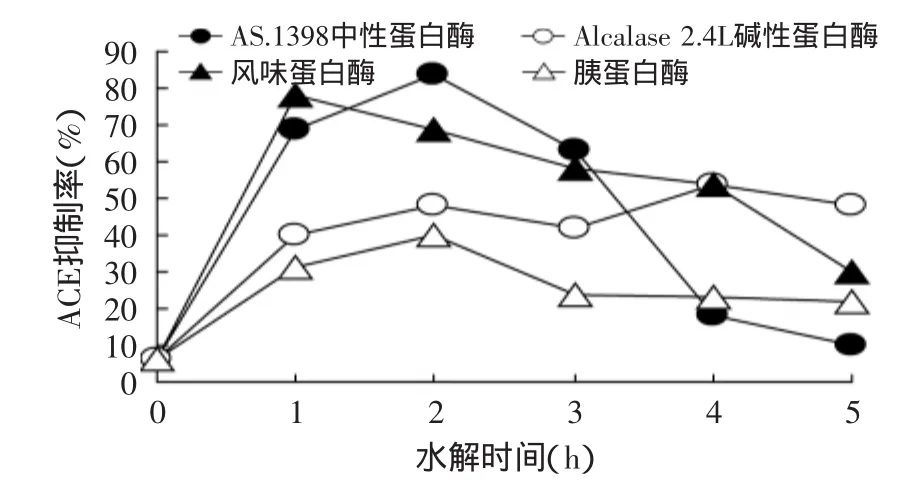
圖1 不同蛋白酶對ACE抑制率的影響Fig.1 Effect of different protease on ACE inhibition
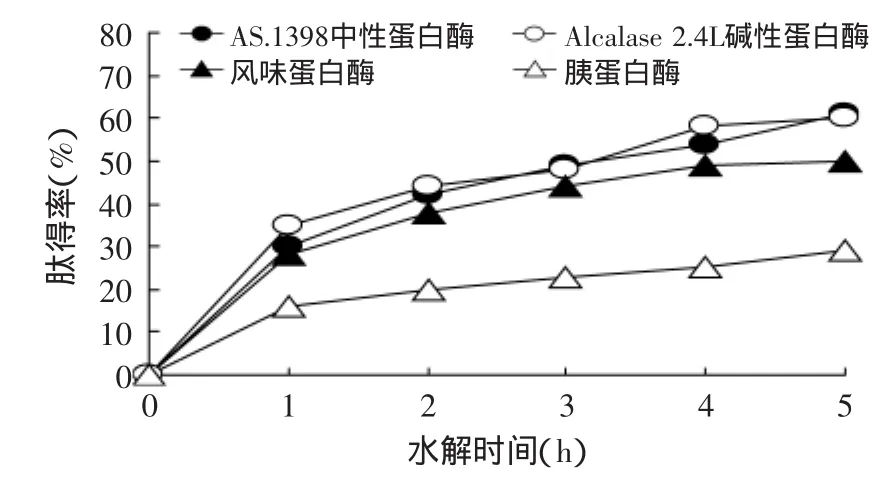
圖2 不同蛋白酶對肽得率的影響Fig.2 Effect of different protease on the yield of peptide
圖1、圖2為水解時間在1、2、3、4、5h內的AS.1398中性蛋白酶、Alcalase 2.4L堿性蛋白酶、風味蛋白酶、胰蛋白酶的篩選情況,其他因素為底物濃度5%,pH7.0,[E]∶[S]為1∶100,溫度為50℃,每個小時取樣并進行ACE抑制率和肽得率的測定進行水解,將每小時取樣離心后的上清液經過噴霧干燥得到粉末狀ACE抑制多肽,之后均以5%濃度溶于水中測定其ACE抑制率和肽得率。從圖1中看出AS.1398中性蛋白酶在2h達到了最大ACE抑制率84%(3次重復實驗結果差異較小),Alcalase 2.4L堿性蛋白酶和胰蛋白酶的ACE抑制率都偏低,風味蛋白酶在1h ACE抑制率雖達到78.7%,但1h后ACE抑制率逐漸下降,到5h時,其抑制率下降到30%;在圖2中可以看出,4種蛋白酶的肽得率都隨著時間的增加而增加并且呈線性,Alcalase 2.4L堿性蛋白酶和AS.1398中性蛋白酶在5h的肽得率分別為62.05%和61.37%,均高于胰蛋白酶和風味蛋白酶,可能是由于Alcalase 2.4L堿性蛋白酶和AS.1398中性蛋白酶的作用位點在底物蛋白質中的含量較多,所以肽得率就高,但是Alcalase 2.4L堿性蛋白酶的ACE抑制率與AS.1398中性蛋白酶的酶解產物相比較低。
所以在相同的蛋白水解物(濃度為5%)的條件下,AS.1398中性蛋白酶的ACE抑制率和肽得率均較高并且在2h時ACE抑制率達到了的84%,比其他三種蛋白酶在相同蛋白水解物濃度下的ACE抑制率和肽得率較高,蛋白酶的篩選和最適水解時間為下一步單因素和正交實驗的重要參數;這與何慧等[17]的玉米大豆復配蛋白制備降血壓肽水解酶篩選研究基本一致。Mullally[18]的研究也表明,ACE的抑制率在反應初期是隨著反應時間和肽得率的增加而增加的,但反應達到一定程度的時候,ACE的抑制率反而會隨時間和肽得率的增加而降低。這有可能是酶解物隨著酶解時間的延長,對具有ACE活性的基團產生影響,從而導致ACE抑制率下降。
綜上,從酶的專一性,降壓肽結構特點和實際酶解實驗來說,采用AS.1398中性蛋白酶為最佳用酶。
2.2 不同pH對玉米ACE抑制肽ACE抑制率和肽得率的影響
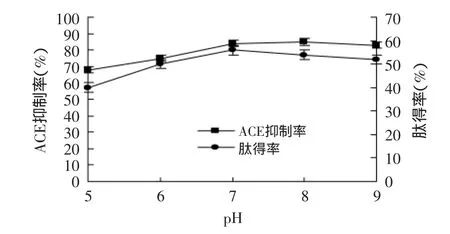
圖3 不同pH對ACE抑制率和肽得率的影響Fig.3 Effect of different pH on the rate of yield of peptide and ACE inhibitory
圖3為pH在5.0~9.0的范圍體系下玉米ACE抑制肽的ACE抑制能力和肽得率,其他因素為底物濃度5%,[E]∶[S]1∶100,溫度50℃,水解時間2h進行水解,水解結束后,取不同pH的水解上清液進行噴霧干燥,之后均配成5%溶液測定ACE抑制率和肽得率,每個實驗水平進行三次重復實驗。從圖3中可以看出隨著pH的增加,其ACE抑制率和肽得率不同程度的增加,當pH8.0~9.0時ACE抑制率和肽得率趨于平緩,并且肽得率下降的幅度更大一些,可見AS.1398中性蛋白酶在中性環境更適合些,所以選擇pH6.0~8.0為下一步正交實驗的三個水平。
2.3 不同底物濃度對玉米ACE抑制肽ACE抑制率和肽得率的影響
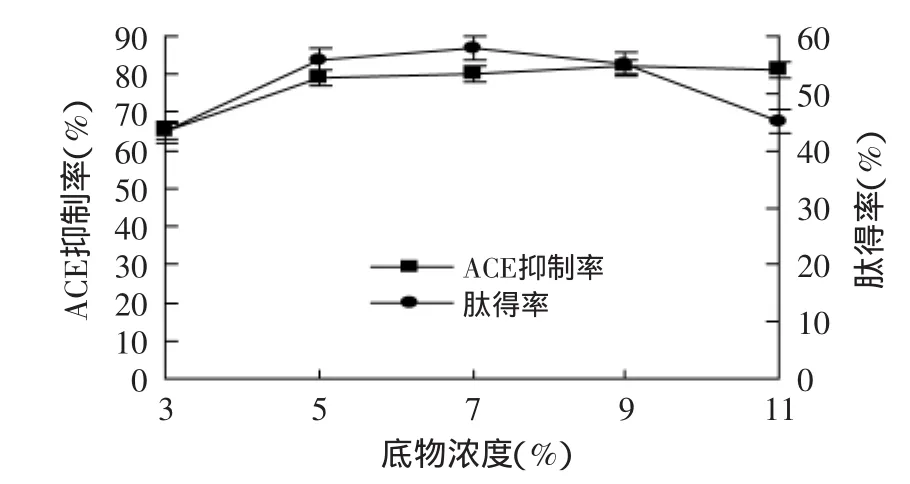
圖4 不同底物濃度對ACE抑制率和肽得率的影響Fig.4 Effect of different substrate concentration on the rate of yield of peptide and ACE inhibitory
圖4為3%、5%、7%、9%、11%底物濃度下的水解產物的肽得率與ACE活性抑制能力。其他因素為pH7.0,[E]∶[S]1∶100,溫度50℃,取不同底物濃度的水解上清液進行噴霧干燥,之后均配成5%溶液測定ACE抑制率和肽得率,結果均為3次重復平均值。從圖4中可以看出5%、7%、9%、11%底物濃度的玉米蛋白肽在2h時水解產物的ACE抑制率都有增加的趨勢,但當底物濃度增加到11%時,由于底物濃度過高,加熱變性使底物黏度過大,從而使反應難以進行[19],可能是由于體系底物濃度過大會造成體系中的有效水分濃度過低,因此降低了底物和蛋白酶的擴散和運動,從而對水解產生抑制作用[20]。所以,ACE抑制率沒有變化,肽得率有所下降,故選擇底物濃度為5%、7%、9%作為因素水平。
2.4 不同[E]∶[S]對玉米ACE抑制肽ACE抑制率和肽得率的影響
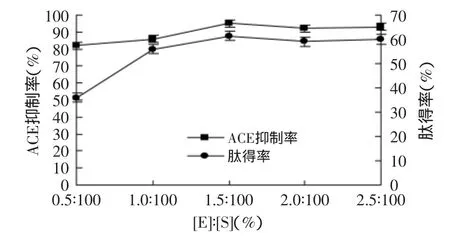
圖5 不同[E]∶[S]對ACE抑制率和肽得率的影響Fig.5 Effect of different[E]∶[S]on the rate of yield of peptide and ACE inhibitory
圖5為不同[E]∶[S]下的水解產物的肽得率與ACE活性抑制能力,[E]∶[S]分別為0.5∶100、1∶100、1.5∶100、2∶100、2.5∶100,其他因素為底物濃度5%,pH7.0,溫度50℃,水解時間2h,取不同[E]∶[S]的水解上清液進行噴霧干燥,之后均配成5%溶液測定ACE抑制率和肽得率,3次重復實驗的結果差異性不大。由圖5可以看出,隨著[E]∶[S]的增加,肽得率和ACE抑制率的總趨勢逐漸增加,當底物濃度一定、[E]∶[S]未達到飽和時,酶的加入量提高,酶的位點大大增加,有利于酶與底物的結合,促進酶解,使得大部分大分子蛋白在較短時間內被降解成為小分子肽,使肽得率增大;并且隨著加酶量的增加,ACE抑制率也隨著增加,但酶加入量過大,一是增加成本,二是不利于后續酶解液的精制。綜合考慮,以[E]∶[S]為1∶100、1.5∶100、2∶100最為合適。
2.5 不同溫度對玉米ACE抑制肽ACE抑制率和肽得率的影響
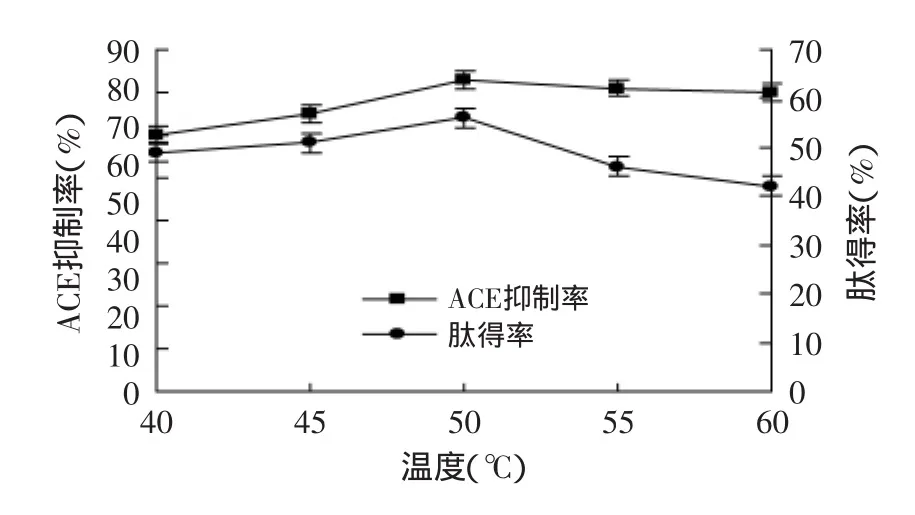
圖6 不同溫度對ACE抑制率和肽得率的影響Fig.6 Effect of different temperature on the rate of yield of peptide and ACE inhibitory
如圖6所示,在相同的其他因素條件下,取不同水解溫度的上清液進行噴霧干燥,得到的粉末狀均配成5%溶液測定ACE抑制率和肽得率,3次重復實驗的結果差異性不大。當溫度從40℃升至50℃時,ACE抑制率和肽得率有明顯的增加,但50℃以后下降較快,這可能由于在一定范圍內溫度上升有利于酶促反應的進行,但溫度過高,會導致酶蛋白變性,從而使酶活性減弱,主要因為酶分子吸收了過多的能量,引起了維持酶分子結構的次級鍵解體,導致酶蛋白變性,從而使酶活性減弱或喪失[21]。所以因素水平選擇40、45、50℃。
2.6 玉米ACE抑制肽制備工藝的正交實驗結果與分析正交實驗
經過篩酶實驗,本工藝采用AS.1398中性蛋白酶進行酶解實驗,選擇pH、底物濃度、[E]∶[S]加酶量、溫度4個因素設計L9(34)正交實驗,以酶解產物的肽得率和ACE抑制率為指標共同考察酶解效果。在篩選酶的實驗中,AS.1398中性蛋白酶在2h時達到了最大ACE抑制率,所以,正交實驗選擇的酶解時間為2h。
如表3、表4所示,從肽得率的指標考慮,通過直觀分析中極差結果發現,4個酶解因素對肽得率的影響從大到小依次為:C>D>B>A,即:[E]∶[S]>溫度>底物濃度>pH,最優組合為A2B1C2D3,但是k值檢驗后的最優組合為A2B2C2D3,沒有出現在9個實驗組中,但是進行比較對比這2個組合,只是差在底物濃度的選擇上,而底物濃度對肽得率指標的影響較小,因此認為2個方案基本一致,并且如果底物濃度較大的話,會使后期的實驗很難進行。除此之外,通過三次的重復實驗進一步驗證得到的實驗組中的最優組合A2B1C2D3(59.58%)大于組合為A2B2C2D3(57.5%),所以確定A2B1C2D3為肽得率的最優組合。采用F檢驗對各因素進行方差分析(α=0.05)可以看出,[E]∶[S]對肽得率有顯著的影響,pH和底物濃度對其影響較小,并且方差分析的結果與極差分析的結果一致。
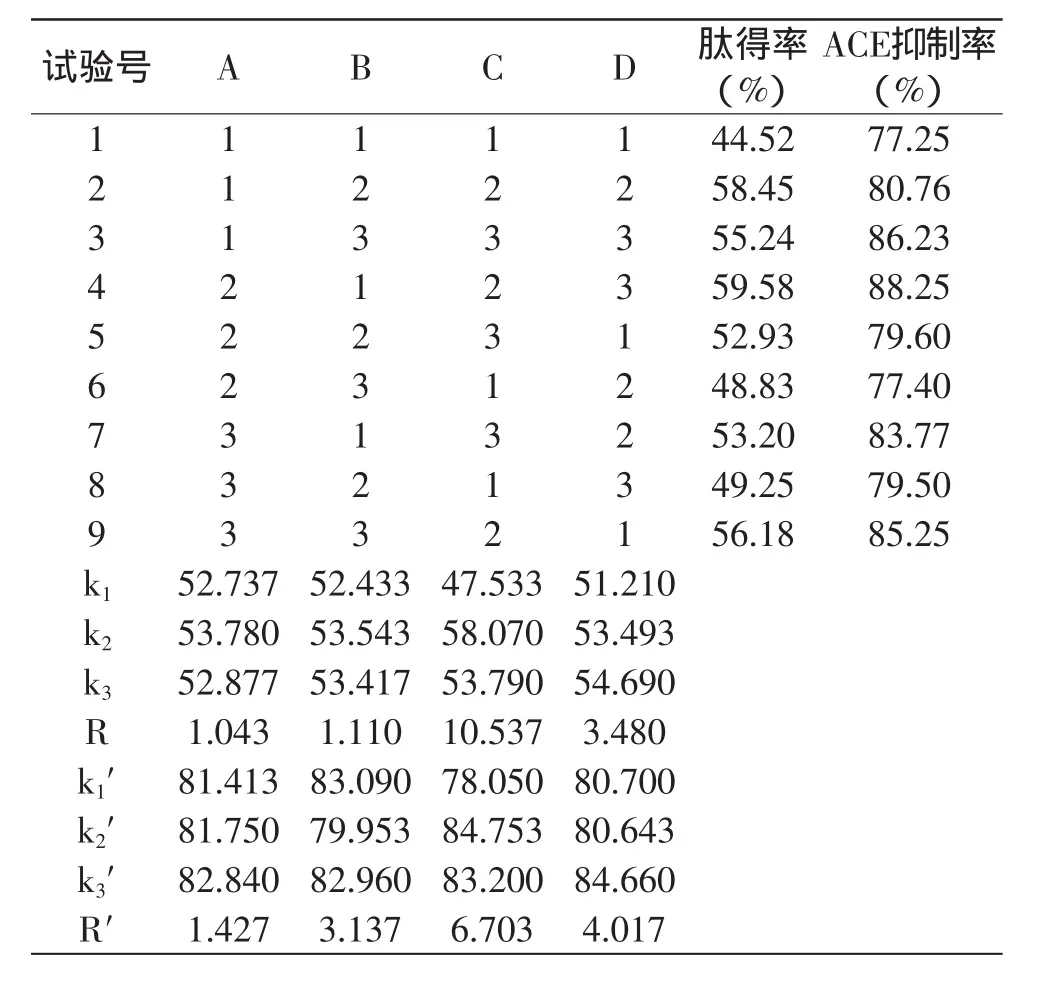
表3 正交實驗設計與結果Table 3 Design and results of orthogonal experimental

表4 肽得率方差分析表(Fα=0.05)Table 4 Yield of peptide analysis of variance table(Fα=0.05)

表5 ACE抑制率方差分析表(Fα=0.05)Table 5 ACE inhibition analysis of variance table(Fα=0.05)
如表3、表5所示,從ACE抑制率的指標考慮,通過直觀分析中極差結果發現,對ACE抑制率的影響從大到小依次為:C>D>B>A,即:[E]∶[S]>溫度>底物濃度>pH,最優組合為A2B1C2D3,但是經k值檢驗后的最優組合為A3B1C2D3,沒有出現在9個實驗組中,但是進行比較對比分析2個組合,發現只是在pH的選擇上有差異,但是pH是4種因素中影響最小的,并且AS.1398中性蛋白酶適合在中性的條件下進行反應,所以選擇A2(pH7.0)為最佳,同時通過三次的重復實驗得到的最優組合A2B1C2D3(88.25%)大于組合為A3B1C2D3(82.77%),所以確定A2B1C2D3為最優組合。通過F檢驗對各因素進行方差分析(α=0.05)可以看出,[E]∶[S]對ACE抑制率有顯著的影響,溫度和底物濃度對ACE抑制率影響不大,pH對ACE抑制率影響最小,并且方差分析的結果與極差分析的結果一致。
比較肽得率和ACE抑制率這2個指標得到相同最佳方案A2B1C2D3,即pH7.0,底物濃度5%,[E]∶[S]為1.5∶100,溫度50℃。為了進一步驗證最佳方案的可行性,在A2B1C2D3的條件下進行酶解實驗,重復3次,測得的肽得率平均值為58.64%,ACE抑制率平均值為85.65%,與實驗結果差異不大。
3 結論
酶種類是酶解過程中最重要的影響因素,用不同蛋白酶酶解玉米蛋白均可以獲得具有血管緊張素轉換酶(ACE)抑制活性的酶解產物,但不同酶所產生的酶解產物的ACE抑制率和肽得率相差較大。一方面,在選酶時,主要考慮蛋白被水解后水解產物C端的氨基酸性質,當Tyr、Pro、Trp、Phe和Leu出現在小肽的C端時,該肽可能具有極強的降血壓活性。因此,選酶時應首先選擇酶切位點在Tyr、Pro、Trp、Phe和Leu的羧基端的蛋白酶。本實驗采用的AS.1398中性蛋白酶的酶切位點主要為Leu,堿性蛋白酶和風味蛋白酶作用位點廣譜,胰蛋白酶作用位點在Lys和Arg之后,所以從酶的專一性和降壓肽結構特點來說采用AS.1398中性蛋白酶為最佳用酶。
另一方面,經過酶的篩選實驗,AS.1398中性蛋白酶的ACE抑制率在2h時達到了較高的84%,遠高于其他蛋白酶;即使堿性蛋白酶的肽得率略高于AS.1398中性蛋白酶,但是本文研究的側重點是ACE抑制率,肽得率只是輔助指標,所以本實驗采用AS.1398中性蛋白酶為最佳用酶。
在AS.1398中性蛋白酶水解2h作用下,通過L9(34)正交實驗得到最佳優化組合:pH7.0,溫度50℃,底物濃度5%,加酶量[E]∶[S]為1.5∶100;并且加酶量[E]∶[S]在ACE抑制率和肽得率的方差分析(Fα=0.05)中有顯著的影響。在最佳水解條件下檢測肽得率與ACE抑制活性的關系表明,肽得率為58.64%時,水解液的抑制活性最大85.65%。
酶解后的玉米蛋白肽仍為混合物,建議下一步工作應分離并收集一系列單體化合物,以便專門研究結構與構效的關系,對具強ACE抑制性的肽段氨基酸序列作進一步分析和研究。
[1]Abraham T G, Chibuike C U, Huan Li, et al.Kinetics of Enzyme Inhibition and Antihypertensive Effects of Hemp Seed(Cannabis sativa L.) Protein Hydrolysates[J].Journal of the American Oil Chemists’ Society,2011(10):1007.
[2]楊鋒,馬千里,黃永春.醋蛋中ACE抑制肽的分離及穩定性研究[J].食品科學,2009,30(24):77-79.
[3]Coates D.The angiotensin converting enzyme(ACE)[J].Int J Biochem Cell Biol,2003,35(6):769-773.
[4]于勝男,吳非.制備大豆降壓肽最佳用酶的篩選[J].食品工業科技,2010,31(5):199-201.
[5]辛志宏,吳守一,馬海樂.從麥胚蛋白質中制備降血壓肽的研究[J].食品科學,2003,24(10):120-123.
[6]王婷,何榮海,楊進妹,等.酶解葵花籽粕蛋白制備降血壓肽的工藝研究[J].食品工業科技,2010,31(11):268-271.
[7]Suh H J,Whang J H,Lee H.A peptide from corn gluten hydrolysate that is inhibitory toward angiotensin I—converting enzyme[J].Biotechnology Letters,1999,21:1055-1058.
[8]Yano S,Suzuki K,Funatsu G.Isolation from α -zein of thermolysin peptides with angiotensin I—converting enzyme inhibitory activity[J].Bioscience Biotechnology Biochemistry,1996,60(4):661-663.
[9]Miyoshi S,Ishikawa H,Kaneko T,et al.Structures and activity of angiotensin I-converting enzyme inhititor in an α-zein hydrolysate[J].Agricultural Biological Chemistry,1991,55(3):1313-1318.
[10]王茵,劉淑集,吳成業.紫菜降血壓肽酶法制備工藝的優化[J].福建水產,2008,12(4):64-68.
[11]魯曉翔,陳新華,唐津忠.酶法改性玉米蛋白功能特性研究[J].食品科學,2000(12):25-27.
[12]翟瑞文,李雁群,佘世望.用玉米渣生產玉米蛋白肽飲料.[J]食品科學,1997,18(9):31-33.
[13]劉萍,陳黎斌,楊嚴俊.酶解玉米蛋白制備降血壓肽的研究[J].食品工業科技,2006,27(5):117-119.
[14]張毅,華欲飛,孔祥珍,等.酶解制備高得率大豆肽工藝條件優化[J].糧食與飼料工業,2009,(11):16-19.
[15]Cushman D W,Onderri M A.Desgin of potene competitive inhibition of Angiotensin Converting Enzyme[J].Biochemistry,1977,16:5484-5488.
[16]賈俊強,馬海樂,王振斌,等.降血壓肽的構效關系研究[J].中國糧油學報,2009,24(5):110-114.
[17]何慧,郭會俠,孔林,等.用玉米大豆復配蛋白制備降血壓肽水解酶篩選研究[J].中國糧油學報,2005,20(6):25-29.
[18]Mullally M M,Meisel,H.,Fitzgerald,R.J.Angiotensin-fconverting enzyme inhibitory activities of gastric and pancreatic proteinase digests of whey proteins[J].Int Dairy J,1997,7:299-303.
[19]金嫘,李新華.中性蛋白酶酶解蛋清制備活性肽的研究[J].安徽農業科學,2007,35(11):3258-3259.
[20]Telio P G.Enzymatic hydrolysis of whey protein:I kinetic modeis[J].Biotechnology and Bioengineering,1994,44:523-528
[21]Otte J,Shalaby S M,Zakora M,et al.Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates:Effect of substrate,enzyme and time of hydrolysis[J].International Dairy Journal,2007(17):488-503.
Screenning of corn ACE inhibitory peptides hydrolase and optimization of enzymatic hydrolysis conditions
SONG Liang1,CAO Long-kui1,2,*,DIAO Jing-jing2,TONG Wan-bing1,LIU Hong-ru1
(1.College of Food,Heilongjiang Bayi Agricultural University,Daqing 163319,China;2.Heilongjiang Agri-food Processing Development Centre,Daqing 163319,China)
TS201.2+5
A
1002-0306(2012)16-0204-06
2011-11-21 *通訊聯系人
宋亮(1986-),男,碩士研究生,研究方向:農產品加工與貯藏。
大慶市高新區創新基金項目(DQGX08YF007)。

