甜葉菊糖基轉移酶UGT76G1的克隆表達及其性質研究
劉 歡,李 艷,嚴 明,陳 圣,郝 寧,許 琳
(南京工業大學生物與制藥工程學院,江蘇南京210009)
甜葉菊糖基轉移酶UGT76G1的克隆表達及其性質研究
劉 歡,李 艷*,嚴 明,陳 圣,郝 寧,許 琳
(南京工業大學生物與制藥工程學院,江蘇南京210009)
目的:利用甜葉菊糖基轉移酶UGT76G1特異性催化甜菊糖中含量高并且具有較強后苦味的甜菊甙生成高甜度的萊鮑迪甙A。方法:將合成的UGT76G1編碼基因插入pYES2載體的EcoRⅠ和XhoⅠ酶切位點之間,成功構建了pYES2-UGT重組質粒。重組質粒導入表達宿主釀酒酵母YPH499中,利用2%半乳糖對重組菌進行誘導表達。結果:確定了最佳誘導時機為菌體培養后48h,誘導表達時間為12h。并對重組酶粗酶液性質進行了初步研究,確定其最適反應pH為8.0,最適反應溫度為40℃,最佳反應時間為36h。結論:為建立經濟高效的生物催化法對甜菊糖口味改質奠定了基礎。
甜葉菊,萊鮑迪甙A,糖基轉移酶UGT76G1
Abstract:Objective:Stevioside which was high in content but has a strong bitter sweet in Steviosides is specifically catalyzed to generate Rebaudioside A high in sweetness by the use of glycosyl transferase UGT76G1.Methods:The synthetic glycosyl-transferase UGT76G1 coding gene after modified was inserted into the vector pYES2 with the restriction site of EcoR I and Xho I in order to construct the recombinant plasmid pYES2-UGT which was then imported to Saccharomyces cerevisiae YPH499.The recombinant strain was induced to express by 2%galactose.Results:Determined the best induction start time was 12h.The nature of this restructuring enzyme was investigated and the optimal conditions were investigated as following:the pH of phosphate salt solution was 8.0,the reaction temperature was 40℃,the reaction time was 36h.Condusion:This study laid a foundation for building an economic and efficient biological catalysis method to modify the taste of Stevioside.
Key words:Stevioside;Rebaudioside A;glycosyl-transferase UGT76G1
甜菊糖(Steviosides)是從菊科草本植物甜葉菊(Stevia rebaudiana)葉中提取的新型天然甜味劑。它是一種發展前景廣闊的健康新糖源,具有高甜度(為蔗糖的250~300倍)、低熱量(僅為蔗糖的1/300)的特性,無毒副作用,無致癌物,食用安全,對高血壓、糖尿病、肥胖癥、心臟病、齲齒等病癥還有一定的藥理作用和輔助療效,是理想的蔗糖替代品[1]。我國是世界上最大的甜菊糖生產國和出口國,甜菊糖被廣泛用于食品、醫藥、日用化工等行業[2]。但由于目前市售甜菊糖在口感上存在后苦味,嚴重影響了其市場占有份額。研究表明,甜菊糖實際上是多種糖甙的混和物,不同糖甙在甜度或口感上存在較大的差異[3]。其中,甜菊甙(Stevioside,St甙)最早被人們發現,是甜菊葉中主要甜味成分,通常占總甙的50%以上,但甜菊甙具有較強的后苦味;萊鮑迪甙A(Rebaudioside A,RA甙)甜度和口感均佳,且不含任何不良余味,是甜菊糖甙中味質最好的成分,但RA甙僅占總甙的20%左右[3-4]。甜菊糖甙的甜度和口感主要取決于RA甙和St甙的含量比例,提高RA甙相對含量是改善甜菊糖品質的關鍵。在甜菊糖的生物合成過程中,甜菊醇在不同的UDP-糖基轉移酶(UDP-glycosyltransferases,UGTs)作用下,在C-19和C-13位上分別連接不同數量的葡糖基以及鼠李糖基形成不同的甜度和甜味的甜葉菊糖甙,如圖1所示[3-5]。植物UGTs是糖基轉移酶家族中的一個重要分支,每種植物中有多種UGTs,各種酶對底物的作用位點具有高度特異性。Richman等[5]從甜葉菊的EST中分離到3種參與甜菊糖甙合成的UGTs(UGT85C2、UGT74G1、UGT76G1)的基因。體外活性分析表明,UGT85C2催化甜菊醇到甜菊單甙(steviolmonoside)的反應,UGT74G1主要催化甜菊雙甙(steviolbioside)的糖基化反應,生成St甙。而St甙到RA甙由UGT76G1一步糖基化反應完成。Humphrey等[6]的實驗結果也證實了此過程。可見甜葉菊St甙與RA甙含量的比例,主要取決于UGT76G1活性的高低。因此,無論是采用植物代謝工程或是利用生物酶轉化獲得高含量的RA甙,對于UGT76G1的研究至關重要。本文主要采用了基因工程手段在釀酒酵母中實現UGT76G1的重組表達,并對其催化特性進行了初步研究,以期為今后該酶的深入研究奠定基礎。
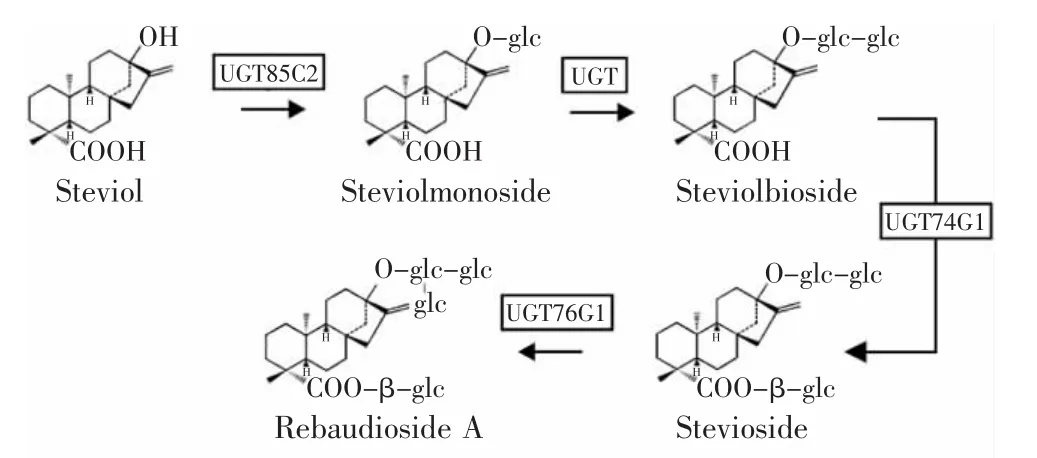
圖1 UDP-糖基轉移酶催化甜菊甙生成萊鮑迪甙A的合成途徑[3,5]Fig.1 Synthetic pathway of Rebudioside A by UDP-glycosyltransferases[3,5]
1 材料與方法
1.1 材料與儀器
大腸桿菌菌株E.coli DH5α和釀酒酵母菌株S.cerevisiae YPH499 為本實驗室保藏;pMDTM18-T載體 購自TaKaRa公司;質粒pYES2 為本實驗室保藏;pYES2-UGT 本實驗構建的帶UGT76G1糖基轉移酶基因的重組質粒;基因和引物 分別由南京金思瑞公司和上海申能博彩公司合成;各種酶及Marker 購自大連寶生物公司;標準品St甙和RA甙 購自曲阜海根甜菊制品有限公司;大腸桿菌完全培養基液體LB蛋白胨10g/L,酵母提取物5g/L,氯化鈉10g/L;釀酒酵母完全培養基液體YPD 10g/L酵母提取物,20g/L蛋白胨,20g/L葡萄糖;選擇培養基液體SC-U(SC基本培養基[7]缺乏尿嘧啶) 其中碳源為20g/L葡萄糖;SCGal-U 即將SC-U培養基中葡萄糖用半乳糖代替。
高效液相色譜(DIONEX)、Lichrospher NH2江蘇漢邦科技有限公司;紫外分光光度計 上海精密儀器有限公司;高速冷凍離心機 Hettich;PCR儀Biometro。
1.2 實驗方法
1.2.1 基因合成 根據AY345974基因序列,進行密碼子優化,優化后的基因序列命名為UGT。
1.2.2 引物設計與合成 根據UGT基因序列設計引物P1:5’-CGGAATTCAAACAATGTCTGAAAATAA GACTGAAACTACTG-3’和P2:5’-CCGCTCGAGTTA TAATGATGAAATATAAGAAACCAA-3’,分別帶有EcoR I和Xho I酶切位點。
1.2.3 表達載體pYES2-UGT的構建 以合成的帶有UGT基因的質粒為模板,用引物P1和P2進行PCR擴增。PCR在50μL體系中進行,反應條件為:94℃變性5min;按如下參數循環30次:94℃變性30s,60℃退火30s,72℃延伸2min;最后72℃延伸10min。將純化后的PCR產物通過“TA”克隆的方式連接到克隆載體pMDTM18-T-UGT上,構建克隆質粒pMDTM18-T-UGT并測序。然后用EcoR I和Xho I雙酶切測序結果正確的pMDTM18-T-UGT和表達質粒pYES2,純化后將兩者連接,連接產物轉化大腸桿菌DH5α感受態細胞,用質粒電泳和酶切篩選并鑒定陽性克隆,至此獲得重組質粒pYES2-UGT。
1.2.4 UGT76G1的誘導表達 將經鑒定后的pYES2-UGT重組質粒電擊法轉化到釀酒酵母YPH499感受態中,30℃培養,在SC-U篩選平板上得到重組YPH499(pYES2-UGT)單菌落。挑取單菌落到SC-U培養液中,30℃振蕩培養活化。然后按終OD600為0.4的接種量轉接新鮮液體SC-U中,30℃,培養48h,使菌體生物量積累。室溫6000r/min離心10min,獲得的菌體用0.1mol/L磷酸鉀緩沖液(pH=7.2)懸浮洗滌后,離心收獲菌體,轉移至SCGal-U培養基中進行誘導,30℃,12h。誘導后室溫離心,所得菌體即可用于破碎后測酶活。
1.2.5 粗酶液的制備 菌液于6000r/min,4℃離心10min,將離心收集的重組釀酒酵母細胞沉淀,用磷酸鉀緩沖液(0.1mol/L,pH=7.2)洗滌兩次,加入YeastBusterTM蛋白抽提試劑進行處理,破碎細胞。然后4℃12000r/min離心5min取上清液即為粗酶液。
1.2.6 酶活測定方法 在1.5mL的反應體系中(1.2mmol/L St甙、4mmol/L UDPG、3mmol/L MgCl2、10μg·mL BSA、pH=7.2),加入粗酶液反應,30℃反應12h后,高溫加熱5min終止反應。以0h反應液做空白對照。12000r/min離心1min后上清液用高效液相色譜(HPLC)進行分析。酶活力單位定義為:在上述反應條件下,30℃,1min催化形成1μmol RA甙所需要的酶量為1個活力單位(U)。
1.2.7 色譜分析條件 色譜柱:Lichrospher NH2柱(250mm×4.6mm,5μm);流動相為乙睛∶水(80∶20,V∶V),用磷酸調節pH至3.0;流速:1mL·min-1;柱溫:40℃;檢測波長:210nm。
1.2.8 不同條件對重組菌粗酶液酶活的影響
1.2.8.1 pH緩沖對酶活的影響 在pH6.0~9.0(0.1mol·L-1磷酸鉀緩沖液)范圍內測定pH對粗酶液活性的影響。反應溫度30℃,反應時間12h,Mg2+濃度3mmol/L。
1.2.8.2 溫度對酶活的影響 在溫度25~48℃范圍內測定溫度對粗酶液活性的影響,反應pH為7.2,反應時間12h,Mg2+濃度3mmol/L。
1.2.8.3 時間對酶活的影響 反應時間在12~96h范圍內測定粗酶液活性的變化,反應pH為7.2,溫度30℃,Mg2+濃度3mmol/L。
1.2.8.4 Mg2+濃度對酶活的影響 Mg2+濃度在1.5~4.5mmol/L范圍內測定粗酶液活性的變化,反應pH為7.2,溫度30℃,反應時間12h。
2 結果與討論
2.1 表達重組子的構建、篩選與鑒定
構建好的重組載體pYES2-UGT如圖2所示。EcoR I和Xho I雙酶切pMDTM18-T-UGT和表達質粒pYES2后純化連接,將連接產物轉化大腸桿菌DH5α感受態細胞,提取質粒篩選陽性克隆,經BamH I進行酶切鑒定,電泳結果見圖3,對應片斷大小與預期相符合(預期的兩個片段大小分別為:6668、536bp),表明外源片段已經正確連接到表達質粒上。
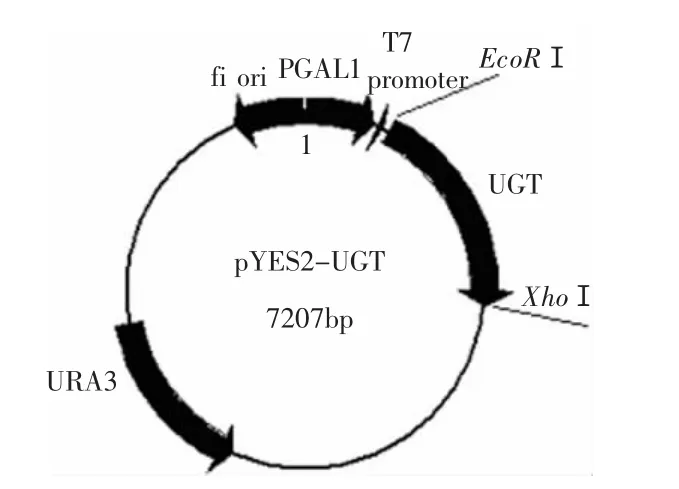
圖2 重組質粒pYES2-UGT構建示意圖Fig.2 Construction of recombinant plasmid pYES2-UGT

圖3 酶切pYES2-UGT鑒定Fig.3 Enzyme digestion pYES2-UGT
2.2 重組酶誘導條件分析
2.2.1 誘導時機 種子液按終OD600為0.4的接種量轉接于50mL SC-U中,30℃200r/min,開始培養后12~60h期間,每隔12h作為一次誘導時機,對平行準備的各樣品中先后將菌體集菌洗菌后轉入半乳糖終濃度為2%的SCGal-U誘導培養基中,誘導24h,破碎后離心,取上清液測定酶活。以酶活最高為100%計算相對酶活,并記錄誘導后菌體終OD600的值。
由圖4可知,不同的的誘導起始時間對酶活有很大影響。在培養時間為48h左右進行誘導,可以獲得較高酶活。當培養時間超過48h時進行誘導,相對酶活性開始下降,這說明在菌體生長出于對數期后期即48h時開始誘導能取得較好的結果。
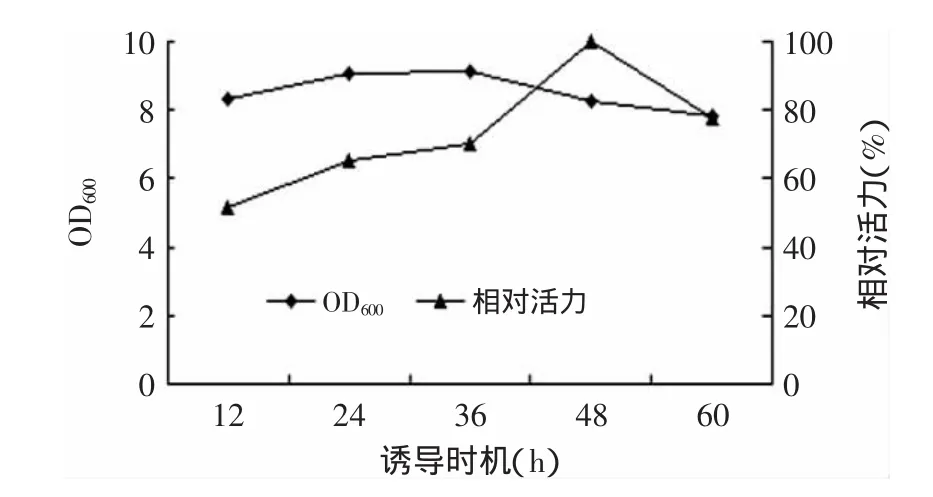
圖4 重組酶誘導時機分析Fig.4 Induction start time analysis of UGT76G1
2.2.2 誘導時間 種子液按終OD為0.4的接種量轉接于50mL SC-U中,30℃、200r/min,36h后集菌洗菌后轉入SCGal-U分別誘導12~60h,破碎后離心,取上清測定酶活。以酶活最高為100%計算相對酶活,并記錄終OD600值。
由圖5中可以看出,隨著誘導時間的延長,重組菌株發酵液的酶活力呈緩慢升高的趨勢,在誘導48h后酶活力達到最高,比較誘導60h后數據,可知過長時間的誘導并沒有有效增加相對酶活,可能是誘導時間過長表達的重組蛋白發生降解。該圖同時也說明了基因持續誘導表達對細胞生長存在一定的負作用。
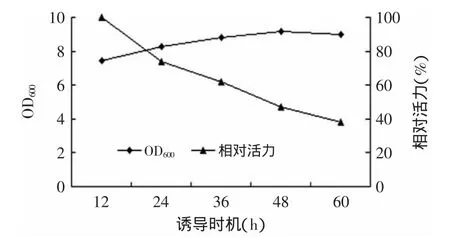
圖5 重組酶誘導時間分析Fig.5 Induction time analysis of UGT76G1
2.3 不同條件對酶活的影響
初步考察了重組菌粗酶液在不同反應pH、不同反應溫度、不同反應時間以及Mg2+濃度下的活性,獲得粗酶液催化轉化的最佳反應條件,為實現重組菌全細胞催化反應的條件選擇提供參考。
2.3.1 pH緩沖體系對酶活的影響 根據不同pH緩沖體系測得的酶活,并以酶活最高為100%計算相對酶活。由圖6可見,此重組酶在pH為8.0時酶活最高,反應轉化的效率最高。在酸性環境下,酶活力較低,在堿性環境下,當pH大于7.4或小于8.4時,相對酶活都在60%以上,當pH為9.0時,酶活迅速下降。
2.3.2 溫度對酶活的影響 分別考察了溫度25~48℃條件下的相對酶活,由圖7可見,重組酶的溫度適應性并不是很寬泛,溫度低于37℃或高于45℃時,酶活都低于80%,最適溫度在40℃附近。
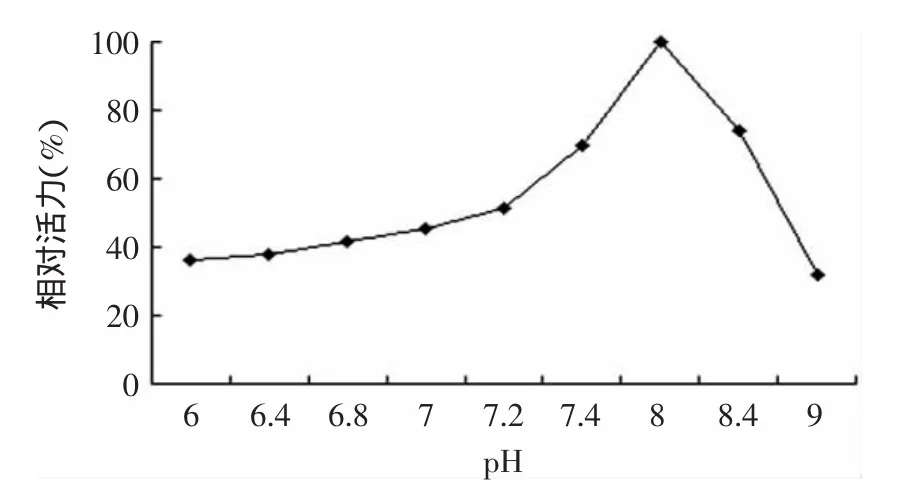
圖6 重組酶粗酶液催化反應的最適pHFig.6 The optimum pH of UGT76G1
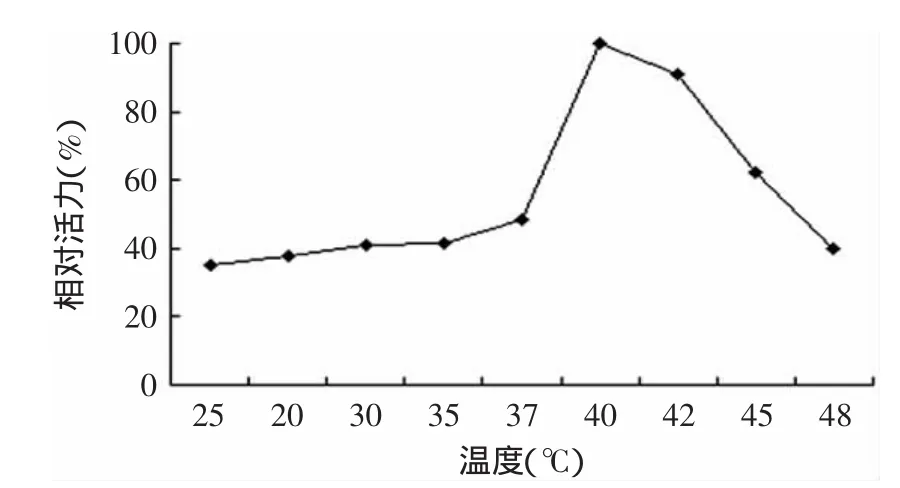
圖7 重組酶的最適溫度Fig.7 The optimum temperature of UGT76G1
2.3.3 時間對酶活的影響 在不同反應時間點12~96h相對酶活,結果如圖8所示,此重組酶在反應0~12h后,酶活急速增加;在36~60h時,該酶酶活最高且較穩定;當反應時間超過72h,該酶的反應轉化的效率呈略微下降趨勢,但相對酶活仍在80%以上。
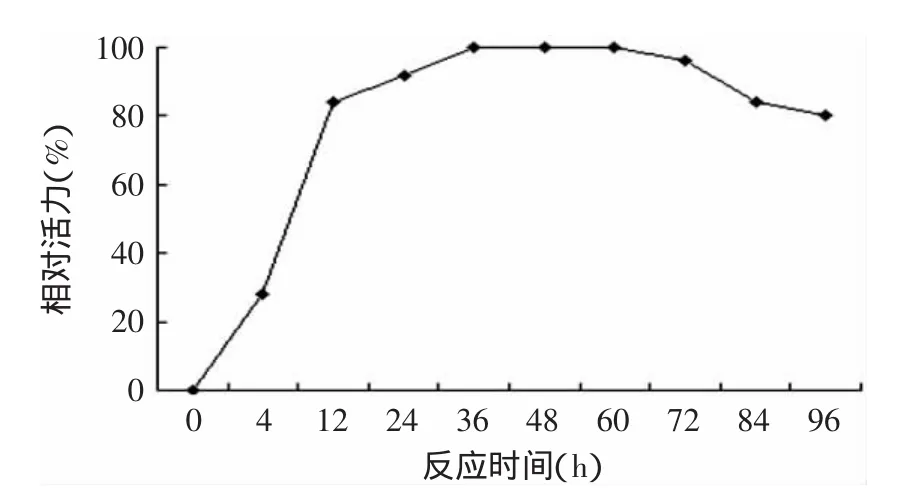
圖8 重組酶的最適反應時間Fig.8 The optimum reaction time of UGT76G1
2.3.4 Mg2+濃度對酶活的影響 由圖9可見,當加入的Mg2+濃度低于0.75mmol/L時,酶活性就開始被抑制但抑制作用較小,而在Mg2+濃度為1.5~4.5mmol/L時,Mg2+對酶活抑制作用急劇加大,當Mg2+濃度達到7.5mmol/L時,相對酶活性已降低至20%左右繼續增加Mg2+濃度,相對酶活變化不大。以上可以說明,該酶并不以Mg2+為酶活性結構中心必需離子,且較高濃度的Mg2+濃度對此酶的催化能力有明顯抑制作用。
3 結論

圖9 Mg2+濃度對酶活的影響Fig.9 The effect of Mg2+concentration on enzyme activity
甜葉菊中UDP-糖基轉移酶UGT76G1能夠選擇性催化St甙生成RA甙,對于提高甜菊糖品質具有潛在的應用價值。由于UGT76G1是植物蛋白,且在甜葉菊葉片中存在多種糖基轉移酶,難以純化獲得大量的目的酶蛋白開展研究工作。而通過合成UGT76G1的已知編碼基因,采用基因工程手段則可以方便的將其在基因工程菌中實現重組表達,獲取目的酶蛋白。本研究在實現了糖基轉移酶UGT76G1于釀酒酵母體系中成功表達的基礎上,確立了其誘導表達條件:誘導劑半乳糖濃度2%,誘導時機為菌體培養48h后,誘導表達時間為12h。并對重組酶粗酶液性質進行了初步研究,確立了其最適反應pH為8.0,最適反應溫度為40℃,最佳反應時間為36h。此工作為建立經濟高效的全細胞催化甜菊糖改質工藝奠定了基礎,而提高UGT76G1活性的相關研究也被確立為后繼主要的工作。
[1]Chatsudthipong V,Muanprasat C.Stevioside and related compounds:therapeutic benefits beyond sweetness[J].Pharmacol Ther,2009,121(1):41-54.
[2]婁力行.甜菊糖及其衍生物的研究進展[J].中國糖料,2008(2):70-72.
[3]Brandle J E,Telmer P G.Steviol glycoside biosynthesis[J].Phytochemistry,2007,68(14):1855-1863.
[4]Carakostas M C,Curry L L,Boileau A C,et al.Overview:the history,technical function and safety of rebaudioside A,a naturally occurring steviol glycoside,for use in food and beverages[J].Food Chem Toxicol,2008,46(7):S1-S10.
[5]Richman A,Swanson A,Humphrey T,et al.Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides of Stevia rebaudiana[J].Plant J,2005,41(1):56-67.
[6]Humphrey T V,Richman A S,Menassa R,et al.Spatial organisation of four enzymes from Stevia rebaudiana that are involved in steviol glycoside synthesis[J].Plant Mol Biol,2006,61(1-2):47-62.
[7]薩姆布魯克J,拉塞爾D W.分子克隆實驗指南[M].黃培堂譯.第3版.北京:科學出版社,2002:1601-1604.
Cloning,expression and characteristic of glycosyl-transferase UGT76G1 from Stevia rebaudiana
LIU Huan,LI Yan*,YAN Ming,CHEN Sheng,HAO Ning,XU Lin
(College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 210009,China)
TS201.2
A
1002-0306(2012)20-0187-04
2012-04-09 *通訊聯系人
劉歡(1988-),女,碩士研究生,研究方向:生物催化。
國家自然科學基金項目(21106068);江蘇省自然科學基金項目(BK2011801);高等學校博士學科點專項科研基金(20113221120002);江蘇省普通高校自然科學研究計劃項目(10KJB530004)。

