光驅動多孔無定形TiO2的形成機制與光催化性能的研究
陳 偉魏 霄*,王建強王開學陳接勝
(1上海交通大學化學化工學院,上海 200240)
(2中國科學院上海應用物理研究所,上海 116023)
光驅動多孔無定形TiO2的形成機制與光催化性能的研究
陳 偉1魏 霄*,1王建強2王開學1陳接勝1
(1上海交通大學化學化工學院,上海 200240)
(2中國科學院上海應用物理研究所,上海 116023)
以鈦酸正丁醇和乙二醇為原料,采用溶劑熱法合成了鈦乙二醇鹽(TG)前軀體,在高壓汞燈照射下制備出無定形TiO2。利用X射線衍射(XRD)、掃描電鏡(SEM)和透射電鏡(TEM)、紫外-可見吸收光譜(UV-Vis)、表面光電壓譜(SPS)、N2吸附-脫附對所得材料進行了結構和性能的表征。借助X射線吸收精細結構(XAFS)對無定形TiO2的形成機制進行了分析,并通過硝基苯的還原反應考察了材料的光催化性能。結果表明:在紫外光驅動無定形TiO2的形成過程中,中心元素Ti4+的配位環境發生變化,由八面體結構轉變為四面體結構;由于特殊的孔道結構使得多孔無定形TiO2顯示出較好的光催化活性。
無定形TiO2;固相轉化;X射線吸收精細結構;光催化;硝基苯還原;表面光電壓譜
近年來,利用半導體作為光催化劑進行有機污染物的降解、分解水制取氫氣和氧氣已成為能源和環境保護等領域最有應用前景的一個研究方向[1,2]。自1972年Fujishima報道了在TiO2半導體電極表面發生水的光催化裂解反應后[3],有關TiO2半導體光催化材料的研究得到迅速發展。但是,大部分的研究都集中于晶態TiO2(以銳鈦礦型為主)[4-10],對無定形TiO2的關注較少。這主要是由于無定型結構沒有形成完整的能帶結構,理論上不利于光生電荷的分離形成有效的可移動的電子或空穴,導致光催化活性較低[11,12]。與晶態TiO2相比,無定型TiO2存在許多優點:制備條件簡易、具有較高的比表面積、可摻雜更多的化學物質等。正因如此,對無定形TiO2的制備及如何提高其光催化活性等方面的研究也獲得了一定的進展[13-15]。最近,利用一種光驅動的固相轉化方法制備多孔材料的工作引起人們的廣泛關注[16-17]。該方法能夠很好地延續前驅體的形貌和結構,并且只需要較低的能耗,因此是制備多孔無定型TiO2的理想方法。雖然通過固相轉化方法能夠制備出具有固定形貌的無定型TiO2,但到目前為止,對由前驅物到無定形TiO2轉變過程的機理研究仍然較少;對所制備的無定型TiO2的光催化活性機理的研究也相對比較缺乏。
因此,本文在不添加強酸的條件下,采用高壓汞燈光照前驅物鈦乙二醇鹽(TG),在室溫條件下制備出多孔無定形TiO2。通過一系列手段研究了無定形TiO2在光驅動的固相轉化過程中的形成機制,并利用表面光電壓技術對制備出的多孔無定型TiO2在硝基苯的還原反應中展現出較高光催化活性的原因進行解析。
1 實驗部分
1.1 樣品制備
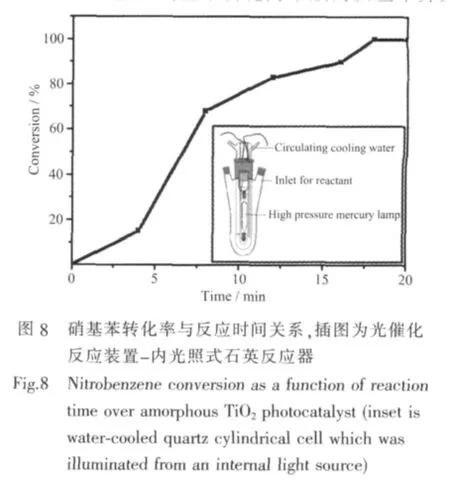
實驗中所用的化學試劑均為分析純,購自國藥集團化學試劑公司。按照文獻[16]所示方法制備多孔無定型TiO2。將20 mL鈦酸正丁酯加入到100 mL乙二醇中,混合均勻。于160℃下加熱2 h,得到白色膠狀沉淀,經干燥洗滌得到前驅物TG粉末。將TG(1.0 g)分散于150 mL去離子水中,轉移至有循環水冷卻的內光照式石英反應器(見圖8插圖)中。在高壓汞燈(400 W,主要輸出波長313 nm和365 nm)照射下攪拌30 min,得到深藍色混合物。反應過程中,光源至反應物的光程約為1 cm,體系溫度維持在40~50℃。經過濾、洗滌,干燥后得到白色的TiO2粉末。
1.2 樣品表征
使用JEM-2100型 (日本JEOL)透射電子顯微鏡(TEM)和S-2150(日本 Hitachi)掃描電子顯微鏡(SEM)對樣品的微觀形貌進行觀察。使用D/max-2200/PC型(日本Rigaku)轉靶X射線衍射儀對樣品的物相進行測定,Cu Kα射線,管電流為60 mA,管電壓為40 kV,掃描速度為6℃·min-1。材料的比表面積(BET)和孔徑分布在ASAP 2010 M+C型(美國Micromeritics)比表面積孔隙度及化學吸附分析儀上進行測試,N2為吸附質,脫附溫度為100℃。紫外-可見吸收光譜測試在UV-2450型(日本Shimadzu)紫外可見分光光度計上進行。表面光電壓譜(SPS)測試在自組裝的表面光電壓譜儀上進行。X射線吸收精細結構(XAFS)測試在上海光源BL14W線站完成,采用透射模式采集數據信息。
1.3 光催化性能測試
TiO2的光催化活性通過硝基苯的還原反應進行評估。將一定量的硝基苯溶于甲醇中配置成濃度為0.38 g·L-1的溶液。取20 mL上述溶液置于內光照式反應器內,加入催化劑 0.5 g,避光攪拌5 min,測定反應物初始濃度。在高壓汞燈的照射下(反應條件同樣品制備),每4 min取樣一次,靜置,離心,取上層清夜進行測試。氣相色譜選用毛細管色譜柱FID氫火焰檢測器進行分析。光催化活性以硝基苯還原至苯胺的轉化率進行衡量。
2 結果與討論
2.1 形貌與結構
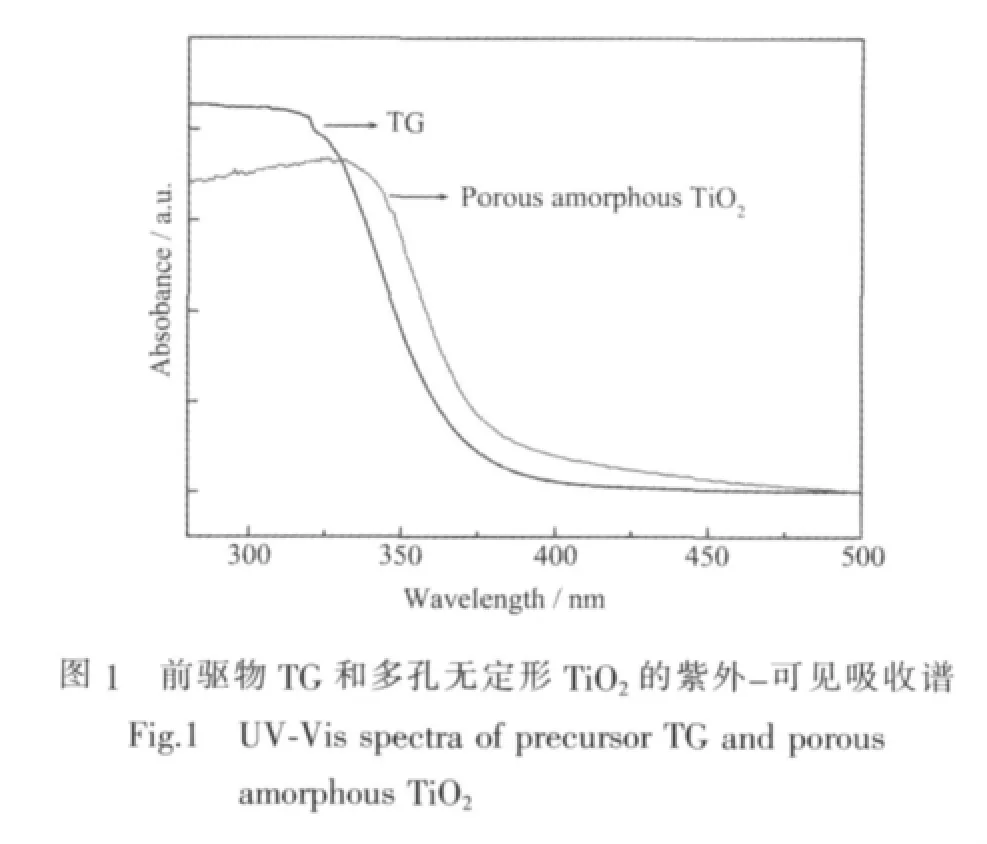
前驅物TG和光照處理后的TiO2均為白色粉末狀固體,紫外-可見吸收光譜如圖1所示。結果顯示二者對光的吸收主要集中在紫外區,TG的吸收帶邊約為370 nm。與TG相比,光照處理后的TiO2的吸收范圍延伸至可見光區。圖2A和2B分別為TG和經過紫外燈照射后得到TiO2的SEM照片。結果顯示出光照前后材料的形貌并未發生明顯改變,只是光照后的TiO2結構更加松散。由于我們采用的光驅動固相轉化反應能夠很好地延續前軀體的結構、組分等特點,因此我們制得的TiO2基本上保持了TG的形貌。圖3為光處理后樣品的TEM照片。圖中并未觀察到明顯的衍射條紋,顯示此材料為無定形構型,且具有一定的孔道結構。XRD結果(圖4)也驗證了經光照處理后的樣品為無定形的TiO2。


圖5為樣品的N2吸附-脫附等溫線及孔徑分布圖。從圖中可知,光照后的TiO2粉末為介孔材料,平均孔徑及比表面積數據見表1。由此可見,前驅物TG經紫外燈照射30 min后可以制得具有多孔無定形結構的TiO2樣品。
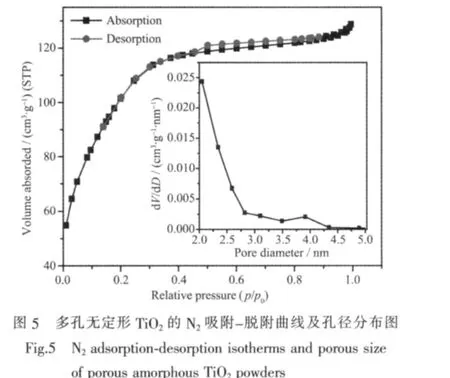

表1 多孔無定形TiO2的比表面積和孔徑大小Table 1 BET surface area and pore size of porous amorphous TiO2powders
2.2 形成機理
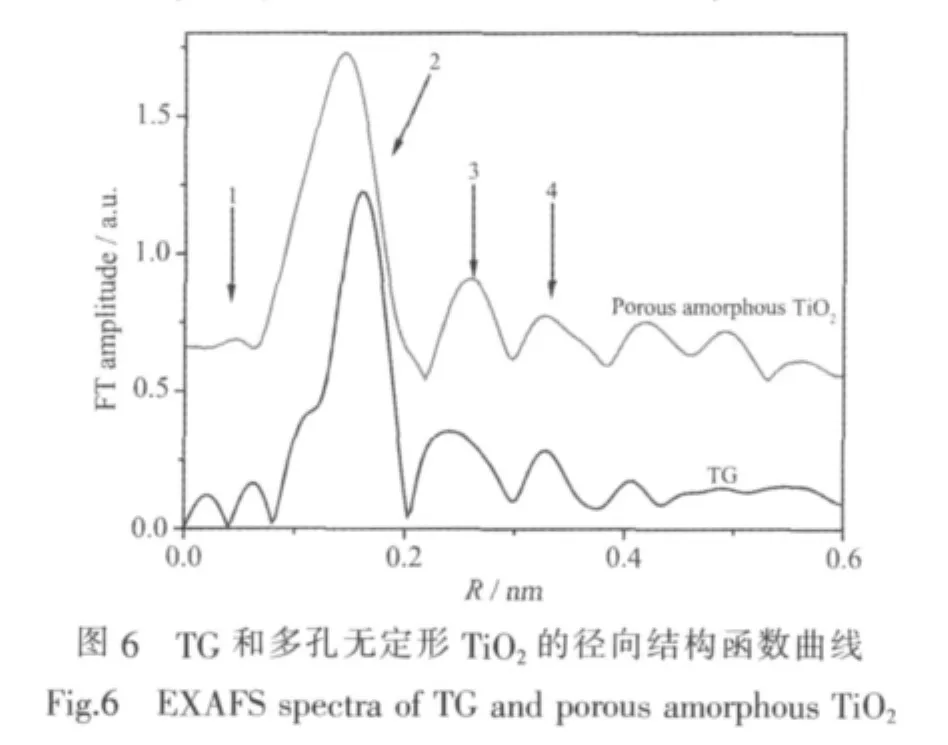
前驅物TG是TiO6的結構,呈一維的鋸齒鏈狀分布,結構較為緊密。TG具有較好的熱穩定性,熱處理溫度達到300℃才開始發生物相的轉變。因此在高壓汞燈照射下,TG到TiO2的轉化應為非熱驅動過程。為了研究在紫外光照射下從前驅物TG到多孔無定形TiO2的轉變機理,我們對二者進行了XAFS分析。圖6為TG和多孔無定形TiO2的徑向結構函數曲線(EXFAS)。從圖中可知,在 0~0.4 nm 范圍內,TG 和無定形TiO2中Ti原子的徑向分布函數均有3個較強的振幅峰 (峰 1 一般是由多重散射引起的):0.1~0.2 nm 范圍內是Ti-O 配位峰 (峰 2);0.2~0.4 nm 范圍內是Ti-Ti配位峰(峰3、4)。從徑向分布函數來看,兩種樣品的第一配位層都是Ti-O配位結構,R=1.8(R為配位距離)。但是TG與銳鈦礦相標準氧化鈦 (CN=4.6,CN是配位數)相比有明顯的配位缺失,初步計算配位數為1.8。光照反應之后配位峰強度進一步降低和寬化,局域結構發生扭曲。引起這一現象的原因主要有Ti-O鍵的斷裂以及羥基化的Ti-O配位結構(Ti-OH)的出現(需要注意的是,它們的峰位并不完全等同于該配位層與吸收原子的間距(鍵長),而是相差一個相移因子)。
為了進一步獲得構型變化的信息,我們對樣品的X射線吸收近邊結構(XANES)進行分析。圖7給出了兩種樣品歸一化后的Ti元素K-邊吸收譜。由圖可知,兩種樣品具有相似的K-邊形狀,且均具有類似銳鈦礦型TiO2相的A、B、C 3個邊前特征峰[18-22],但是邊后 (4 900~5 000 eV)的振蕩峰存在明顯差別,B明顯增強,說明樣品結構存在一定差異。由于四面體場中Ti原子的K-邊邊前結構呈現單峰特點,因此這一結果說明光照后中心元素Ti的配位情況發生明顯變化,Ti-OH比例增加,由類似銳鈦礦型TiO2的八面體型向四面體型開始轉變。結合TG和多孔無定形TiO2的徑向分布曲線可以發現,TG中大量存在的Ti-O鍵配位峰明顯消失,表明Ti-O鍵大量斷裂,羥基化的Ti-O鍵生成,同時脫去有機基團。上述XAFS的結果揭示了在光驅動從TG到多孔無定形TiO2這一固相轉化過程中,中心元素Ti的配位情況發生了由八面體構型向四面體構型的轉變,Ti-O鍵大量斷裂,在脫去有機基團的同時形成了羥基化的Ti-O配位結構。也正是由于構型的轉變,才出現了圖1中多孔無定型TiO2的吸收帶邊與TG相比發生紅移的情況。
2.3 光催化性能
眾所周知,以P25為代表的一系列TiO2晶體材料均具有出色的光催化活性[23-25]。與晶體材料相比,利用光驅動固相轉化法制備的多孔無定形TiO2是否也具有較好的光催化活性是我們關注的焦點。根據圖1給出的紫外-可見吸收光譜可知,制得的多孔無定形TiO2在紫外光區(<400 nm)存在強響應帶。由于材料的無定形構型,這一區域的響應歸屬為電子從O原子的2p軌道到Ti原子的3d軌道的躍遷。與晶態TiO2材料不同的是,該多孔無定形TiO2在可見光區(400 nm<λ<475 nm)產生了明顯的吸收。這一現象說明其特殊的孔道結構對TiO2的光學吸收范圍產生了影響,從紫外光區到可見光區內較強的吸收為光催化活性的研究提供了前提。
我們以硝基苯還原至苯胺的反應來考察多孔無定形TiO2的光催化活性。圖8為高壓汞燈照射下(反應裝置見插圖)硝基苯的轉化率-時間關系曲線。由結果可知,隨反應時間的增加,硝基苯的轉化率逐漸增加。當反應時間達到10 min時,硝基苯的轉化率已達到78%左右。反應17 min后,硝基苯的轉化率幾乎為100%,選擇性為100%,并且無副反應發生。TOF(turn over frequency)值為 0.034 7 h-1。作為對比,我們在同樣的條件下以P25為光催化劑進行了轉化率檢測,結果表明P25在光催化硝基苯轉化為苯胺的反應中并無明顯的活性。另外我們以Xe燈作為激發光源,采用濾光片濾去380 nm以下波長的波段進行了可見光催化的對比實驗。結果表明多孔無定形TiO2僅在紫外光的激發下展現出較為出色的催化活性。
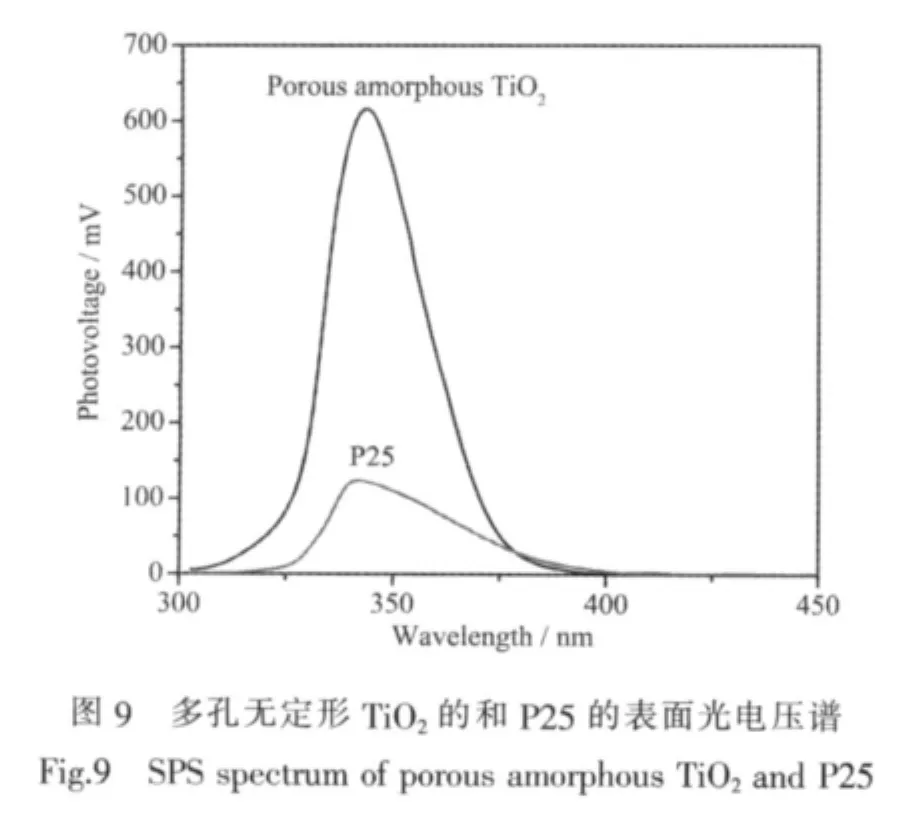
為了分析多孔無定形TiO2與P25在光催化性能上產生差異的原因,我們對二者進行了SPS表征。當材料被一定能量的光子激發會形成了大量的電子-空穴對,其中部分電子-空穴對發生了空間分離并經過輸運到達材料表面,引起表面勢壘的變化,就產生了光電壓[26]。如圖9所示P25和多孔無定形TiO2的光伏響應范圍都集中在紫外光區域,這與TiO2本身較寬的禁帶寬度(3.2 eV)有關。P25的響應帶主要對應的是價帶到導帶的電子躍遷,閾值約為390 nm,對應禁帶寬度約為3.19 eV。而多孔TiO2是無定形的,沒有形成完整的能帶結構,其300 nm~400 nm的強響應區間應歸屬為O的2p軌道到Ti的3d軌道的躍遷,閥值約為380 nm,這與UV-Vis譜中紫外光區的吸收結果基本一致。但是多孔無定形TiO2在可見光區并未產生明顯的光電壓響應。這說明多孔無定形TiO2吸收可見光產生的電子-空穴對無法進行有效地分離,產生能夠自由移動的電荷載流子,從而無法產生可見光的光電壓響應。這也是多孔無定形TiO2沒有可見光催化活性的原因。在催化反應中,催化材料的晶型、比表面積、孔徑大小、孔道數量、表面酸性以及反應溫度等因素能夠直接影響光生電子-空穴對的產生、分離與復合,達到催化劑表面的光生電荷的濃度和復合速率則決定催化劑的催化性能。由于光電壓的強度是凈過剩電荷載流子的直接體現,因此光電壓強度能夠反應出催化劑中光生電荷的狀態并從側面確定催化劑的活性[27-28]。對比多孔無定形TiO2和P25的表面光電壓譜可以發現,多孔無定形TiO2的紫外區光電壓響應強度約為P25的6倍。出現如此強的光伏響應主要是由于多孔無定形TiO2的特殊結構所致。前驅體TG是一種一維的鋸齒狀鈦醇鹽晶體,在高壓汞燈光照過程中,相對完好的鈦醇鹽晶體分解,Ti-O鍵大量斷裂,生成無定形的具有無序孔道結構的TiO2顆粒。構成無定形TiO2的小顆粒使連續的能帶被劈裂成離散的能級。在較大程度上降低了光生電子和空穴的復合速率。此外由于小顆粒的存在,使得材料表面積增大,表面態異常豐富,能夠產生更多的光生電荷。因此,多孔無定形TiO2表現出較強的紫外光電壓響應。這一結果證實了在紫外光照射下硝基苯還原為苯胺的反應中,多孔無定形TiO2的光催化活性要遠高于P25。
3 結 論
采用光驅動固相轉化方法從前驅物鈦乙二醇鹽制備的TiO2為多孔無定形結構,具有較大的比表面積和約2 nm的孔徑。XAFS結果揭示了從TG到多孔無定形TiO2這一固相轉化過程的機制:在紫外燈的照射下,中心元素Ti4+的配位環境發生變化,由八面體結構的TiO6向四面體結構轉變,局部Ti-O鍵發生扭曲、斷裂,形成新的Ti-OH鍵,并伴隨有機基團的脫落,前驅物TG的鏈狀結構崩塌,形成了多孔無定形的TiO2。在紫外光催化硝基苯的還原反應中,該多孔無定形TiO2展現了良好的光催化活性。表面光電壓測試結果解釋了多孔無定形結構的存在導致了光生電荷數量的增加并抑制了電子和空穴的復合,是多孔無定形TiO2具有高催化活性的最主要原因。
[1]Zhang Z J,Wang W Z,Lu W,et al.ACS Appl.Mater.Inter.,2012,4(2):593-597
[2]Zhang S,Sakai R,Toshiyuki A,et al.ACS Appl.Mater.Inter.,2011,3(6):1902-1909
[3]Fujishima A,Honda K.Nature,1972,238:37-38
[4]Choi S K,Kim S H,Lim S K,et al.J.Phys.Chem.C,2010,114(39):16475-16480
[5]Linsebigler A L,Lu G Q,Yates J T.Chem.Rev.,1995,95(3):735-758
[6]Chen D M,Jiang Z Y,Geng J Q,et al.Ind.Eng.Chem.Res.,2007,46(9):2741-2746
[7]Cao Y Q,Tao H,Chen Y M,et al.J.Phys.Chem.C,2010,114(8):3627-3633
[8]Dai W X,Wang X X,Ping L,et al.J.Phys.Chem.B,2006,110(27):13470-13476
[9]Song K Y,Park M K,Kwon Y T,et al.Chem.Mater.,2001,13(7):2349-2355
[10]Liao G Z,Chen S,Xie Q,et al.Environ.Sci.Technol.,2010,44(9):3481-3485
[11]Hoang V V,Zung H,Trong N H B.Eur.Phys.J.D,2007,44(3):515-524
[12]K?nenkamp R.Phys.Rev.B,2000,61(16):11057-11064
[13]Chen W,Sun X D,Weng D.Electrochem.Commun.,2007,9(3):382-385
[14]Terabe K,Kato K,Miyazaki H,et al.J.Mater.Sci.,1994,29(6):1617-1622
[15]Hoang V V.Phys.Status Solidi B,2007,244(4):1280-1287
[16]Zou X X,Li G D,Wang K X,et al.Chem.Commun.,2010,46(12):2112-2114
[17]Zou X X,Li G D,Zhao J,et al.Inorg.Chem.,2011,50(18):9106-9113
[18]Linsebigler A L,Lu G,Yates Jr J T,Chem.Rev.,1995,95(3):735-758
[19]Chen L X,Rajh T,Wang Z Y,et al.J.Phys.Chem.B,1997,101(50):10688-10697
[20]Koike Y,Fujikawa K,Suzuki S,et al.J.Phys.Chem.C,2008,112(12):4667-4675
[21]Ohyama J,Teramura K,Okuoka S,et al.Langmuir,2010,26(17):13907-13912
[22]Nakahira A,Kubo T,Numako C,ACS Appl.Mater.Inter.,2010,2(9):2611-2616
[23]LI Li-Yuan(李麗媛),JIANG Fang(江芳),WAN Hai-Qin(萬海勤),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(6):1041-1046
[24]LI Dan-Dan(李丹丹),LIU Zhong-Qing(劉中清),LIU Xu(劉旭),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(7):1343-1347
[25]WU Da-Wang(吳大旺),LI Shuo(李碩),ZHANG Qiu-Lin(張秋林),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(7):1383-1388
[26]Kronik L,Shapira Y,Surf.Sci.Rep.,1999,37(1-5):1-206
[27]Wei X,Xie T F,Peng L L,et al.J.Phys.Chem.C,2011,115(17):8637-8642
[28]Su J,Zou X X,Li G D,et al.J.Phys.Chem.C,2011,115(16):8064-8071
Investigation on the Light-Driven Formation Mechanism and Photocatalytic Properties of a Porous Amorphous Titanium Dioxide
CHEN Wei1WEI Xiao*,1WANG Jian-Qiang2WANG Kai-Xue1CHEN Jie-Sheng1
(1School of Chemistry and Chemical Engineering,Shanghai Jiao Tong University,Shanghai 200240,China)
(2Shanghai Synchrotron Radiation Facility,Shanghai Institute of Applied Physics,Chinese Academy of Sciences,Shanghai 201204,China)
A porous amorphous TiO2has been prepared through a light-driven formation process.Titanium glycolate(TG)synthesized through the solvothermal reaction between titanium(IV)n-butoxide and ethylene glycol is used as a precursor.The irradiation of TG under UV light leads to the formation of the porous amorphous TiO2.The sample is characterized by powder X-ray diffraction (XRD),scanning electron microscopy(SEM),transmission electron microscopy (TEM)and N2adsorption/desorption.The results of these characterizations reveal the porous and amorphous nature of the sample.The transformation mechanism from TG to amorphous TiO2under UV light is investigated by X-ray absorption fine structure (XAFS)spectroscopy.Extended X-ray Absorption Fine Structure(EXAFS)and X-ray absorption near edge structure(XANES)spectra indicate that the transformation from TG to porous amorphous TiO2is accomplished through the configuration conversion of titanium species.The configuration of titanium species changes from octahedron to tetrahedron due to the breakage and reconstruction of Ti-O bonds under UV irradiation.The photocatalytic properties of the porous amorphous TiO2are evaluated based on the reduction of nitrobenzene.As indicated by the surface photovoltage spectroscopy (SPS),the separation of photogenerated charges can be facilitated by the porous structure of the amorphous TiO2,resulting in the high photocatalytic activity of the sample.
amorphous TiO2;solid transformation;XAFS;photocatalysis;nitrobenzene reduction;surface photovoltaic spectroscopy
2012-05-08。收修改稿日期:2012-06-19。
國家自然科學基金(No.91022019)資助項目。
*通訊聯系人。E-mail:weixiao@sjtu.edu.cn;會員登記號:S06N4785M1005。
O614.41+1
A
1001-4861(2012)10-2059-06

