普伐他汀對H2O2誘導的人骨髓間充質干細胞凋亡的影響
林海泓 羅心平 施海明 龔輝
(1.復旦大學附屬金山醫院心內科,上海 201508;2.復旦大學附屬華山醫院心內科,上海 200040)
骨髓間充質干細胞(mesenchymal stem cells,MSCs)移植為治療心肌梗死提供了新思路,但是MSCs移植后的存活率低,使得歸巢到損傷心肌的干細胞數量甚少,這極大地影響了MSCs移植的臨床應用效果[1]。
他汀類藥物除具有降脂作用外,還具有促血管生成、改善內皮功能障礙、抗氧化、抗炎等作用。近年來人們逐漸開始關注他汀類藥物與干細胞的關系。文獻[2-3]報告,他汀類藥物可增加外周血內皮祖細胞數量,延緩其衰老,從而加快受損血管內皮的修復,這可能是他汀類藥物心臟保護作用的機制之一,據此推測其對MSCs也可能有類似作用。本研究旨在探討普伐他汀在體外對H2O2誘導的人MSCs凋亡的影響及其相關機制。
1 資料與方法
1.1 主要試劑 低糖DMEM及胎牛血清購自美國 HyClone公司,0.25%胰酶和0.02%EDTA液購自美國Sigma公司,淋巴細胞分離液購自上海華精生物高科技有限公司,普伐他汀購自中美上海施貴寶制藥公司,細胞及組織總蛋白抽提試劑盒、BCA蛋白質定量試劑盒及二抗購自上海康成生物工程公司,PI3K/Akt通路特異抑制劑Ly294002、ERK1/2通路特異抑制劑U0126、一抗AKT抗體、ERK1/2抗體及p38MAPK抗體購自美國Cell Signaling公司,p38MAPK通路特異激動劑anisomycin購自美國Santa Cruz公司。
1.2 人MSCs的分離、培養及鑒定 嚴格無菌條件下采集志愿者骨髓液5 mL,肝素抗凝,用孔徑為0.02 mm的輸血器過濾3次,加等量磷酸鹽緩沖液(PBS)混勻后,用1 mL針頭沿管壁慢慢注入淋巴細胞分離液,2000 r/min離心20 min。輕輕吸出中間白色云霧狀細胞層,加入PBS洗滌細胞,1000 r/min離心5 min,共洗3次。加入完全培養基后混勻,置于37℃5%CO2飽和濕度培養箱內培養。胰酶消化,1∶2傳代。取第6代細胞用流式細胞儀進行細胞表型檢測。
1.3 實驗分組 將傳代后第4天的第6代MSCs用含0.5%血清的培養液培養12 h后,隨機分為5組。普伐他汀組換用含10μmol/L普伐他汀的完全培養基;對照組則始終用完全培養基;另3組分別用20μmol/L的Ly294002、20μmol/L的U0126以及10 mg/L的anisomycin預處理1 h后,換用含普伐他汀10μmol/L的完全培養基。1 h后所有組均用含1 mmol/L的H2O2的完全培養基培養。12 h后在顯微鏡下觀察細胞形態。
1.4 膜聯蛋白V/PI雙染流式細胞術檢測細胞凋亡 各組細胞經PBS洗滌后,消化并重懸為細胞懸液,收集于10 mL的離心管中,每樣本細胞數為(1~5)×106/mL,離心、洗滌細胞后用100μL的標記溶液重懸細胞,室溫下避光孵育10~15 min。再次離心、洗滌,加入熒光(SA-FLOUS)溶液4℃孵育20 min后,用流式細胞儀(Becton Dickinson公司)檢測。
1.5 細胞蛋白提取及 Western blotting檢測 按常規方法進行。
1.6 統計學處理 用Stata 7.0軟件包進行統計學分析。所有數據均以均數±標準差()表示,兩組間比較用t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 人MSCs細胞鑒定 用流式細胞儀對培養第6代的人MSCs進行細胞表型分析顯示,細胞CD34表達 (-),CD105(+)、CD106(+)。
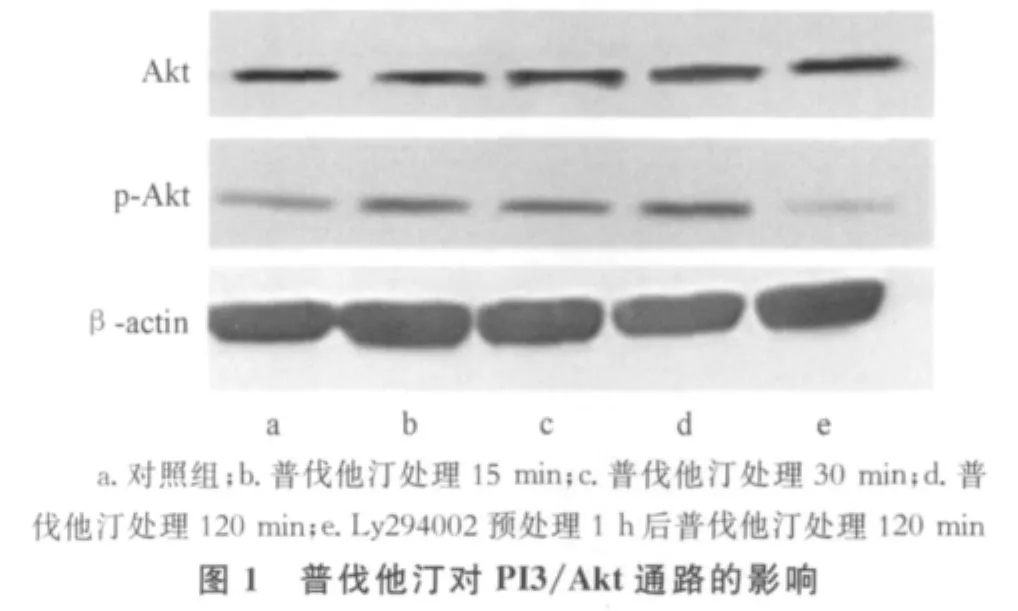
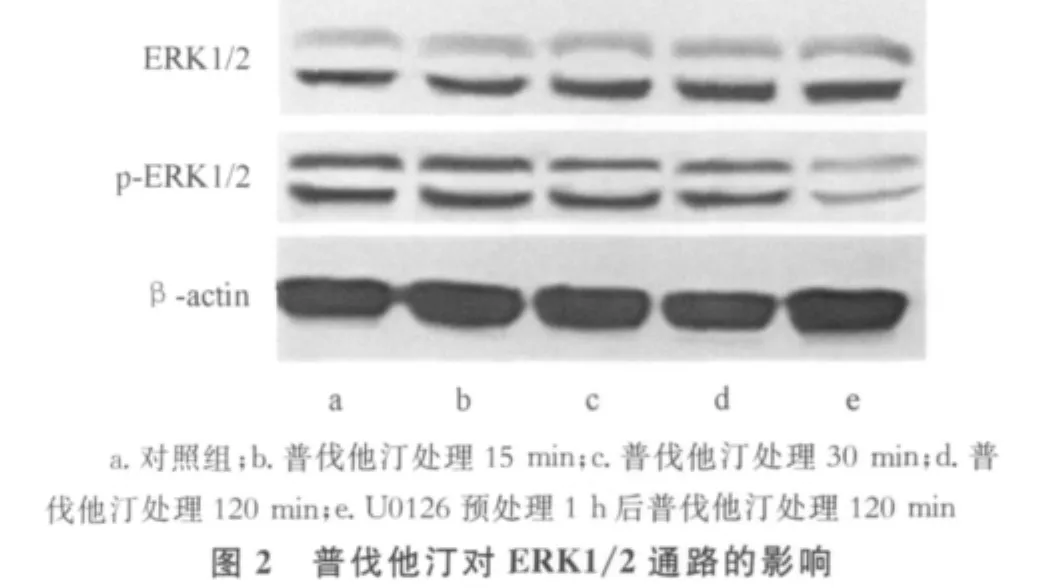
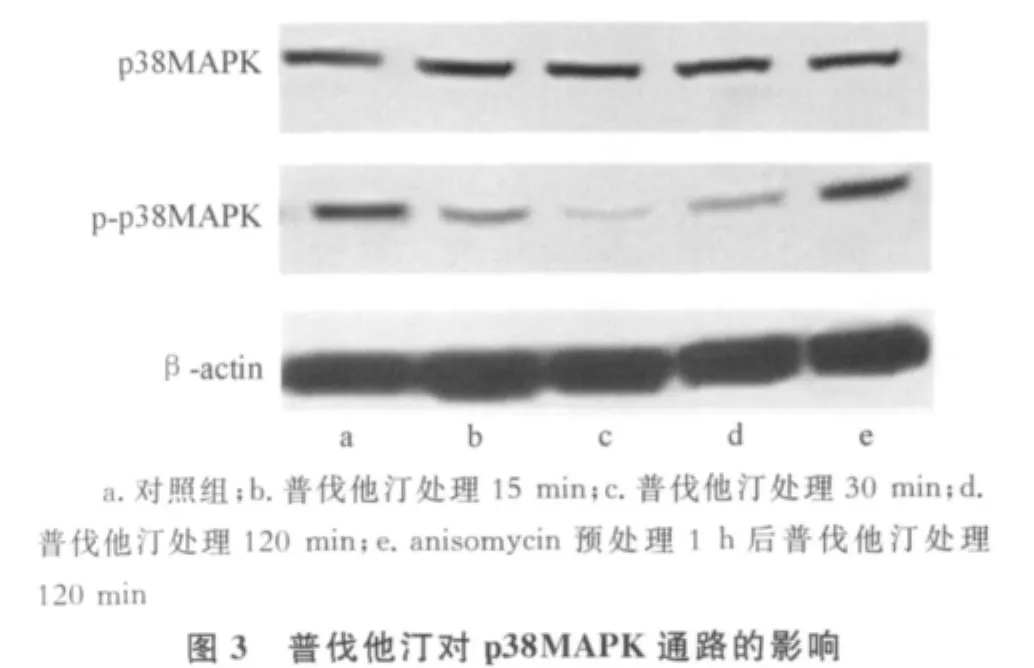
2.2 普伐他汀對 MSCs中PI3K/Akt、ERK1/2及p38MAPK通路的影響 普伐他汀可使人MSCs的PI3K/Akt通路磷酸化水平升高,2 h后作用仍持續;也可抑制p38MAPK通路磷酸化水平,抑制作用于30 min時達高峰。但是普伐他汀對人MSCs的ERK1/2通路和總Akt、總p38MAPK水平無顯著影響,見圖1~3。
2.3 人MSCs經H2O2誘導凋亡后的形態檢測 未經H2O2作用的MSCs貼壁生長良好,邊界清楚,排列緊密,成纖維樣生長,見圖4。細胞經1 mmol/L H2O2作用12 h后,細胞間隙增寬,細胞體積縮小,細胞內顆粒及空泡增多,出現較多懸浮死亡細胞,有的細胞崩解為碎片,見圖5。經普伐他汀預處理后再經1 mmol/L H2O2處理的細胞,形態變化顯著輕于對照組,細胞形態基本保持不變,但細胞內空泡較多,見圖6。普伐他汀+Ly294002組細胞形態與對照組無顯著差異,見圖7。
2.4 流式細胞儀檢測人MSCs經H2O2誘導后的凋亡情況 普伐他汀組和普伐他汀+anisomycin組均能對H2O2誘導的人MSCs凋亡起到顯著保護作用(P<0.05),但普伐他汀+Ly294002組無此保護作用,提示普伐他汀對人MSCs的凋亡保護作用可能與PI3K/Akt信號傳導通路有關。見表1。

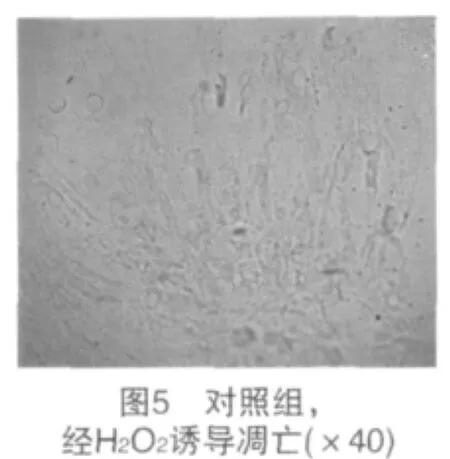


表1 藥物作用后對H2O2誘導的人MSCs凋亡的影響
3 討 論
研究[4]顯示,心肌梗死后行干細胞移植不論采取何種途徑,移植后的細胞僅有少量能最終到達心肌損傷部位并存活生長,而大部分移植細胞在肺、肝等器官中被發現。另有研究[5]顯示,如果在急性心肌梗死后過早進行干細胞移植,大部分移植細胞可能不能在缺血后的惡劣微環境中存活。因此,當前干細胞移植面臨的一個重大挑戰就是如何保護移植細胞、改善細胞的存活率并促進移植細胞在受損心肌組織內分化生長,以提高細胞移植效率。
本研究對體外培養的第6代人MSCs進行細胞表型分析,發現 CD34 (-),而 CD105(+),CD106(+),這符合MSCs表型特征。細胞對于外界刺激的反應是通過信號之間的相互作用和交流進行的,沒有任何一條通路在細胞的某種反應中獨立存在,每條通路都和許多其他途徑相整合,它們的相互作用、整合的強度決定了細胞的命運。
本研究發現,PI3K/Akt通路的磷酸化水平在普伐他汀刺激后15 min即可升高,至2 h時作用仍持續;p38MAPK通路磷酸化水平則在普伐他汀刺激后受到抑制,抑制作用于30 min時達高峰,隨后減弱。這說明普伐他汀可激活人MSCs的PI3K/Akt通路并抑制p38MAPK通路。由于本研究結果顯示普伐他汀對人MSCs的ERK1/2通路無顯著影響,故其后未進行與此通路相關的凋亡實驗。
移植到缺血的部位后大部分細胞可能因無法耐受缺血環境而發生凋亡,因此減少細胞凋亡可能會提高移植效率。文獻[6]報告,他汀類藥物具有抗細胞凋亡作用,能夠保護多種細胞免受各種刺激誘導的凋亡。那么它對人MSCs的凋亡是否同樣具有保護作用?本研究顯示,普伐他汀可顯著地減輕細胞凋亡程度。而且我們發現,激活p38MAPK途徑后并不能影響藥物對H2O2誘導人MSCs凋亡的拮抗效應。這一結果表明,p38MAPK途徑與普伐他汀介導的抗凋亡作用無關。當用特異的PI3K/Akt通路抑制劑Ly294002阻斷PI3K/AKT信號途徑時,普伐他汀對人MSCs的保護作用受到抑制,提示PI3K/Akt通路的激活在普伐他汀對H2O2誘導人MSCs凋亡的抑制作用中起重要的調控作用。
本研究結果表明,普伐他汀對H2O2誘導的人MSCs凋亡有抑制作用。PI3K/Akt通路的激活參與了這種抗凋亡作用的調控。所以,普伐他汀在保護移植干細胞、改善干細胞的存活率并促進移植干細胞在受損心肌組織內生長、提高干細胞移植效率等方面具有一定價值。
[1]Wen Z,Zheng S,Zhou C,et al.Repair mechanisms of bonemarrow mesenchymal stem cells in myocardial infarction[J].J Cell Mol Med,2011,15(5):1032-1043.
[2]Schmidt-Lucke C,Fichtlscherer S,R?ssig L,et al.Improvement of endothelial damage and regeneration indexes in patients with coronary artery disease after 4 weeks of statin therapy[J].Atherosclerosis,2010,211(1):249-254.
[3]Jaumdally RJ,Goon PK,Varma C,et al.Effects of atorvastatin on circulating CD34+/CD133+/CD45-progenitor cells and indices of angiogenesis(vascular endothelial growth factor and the angiopoietins 1 and 2)in atherosclerotic vascular disease and diabetes mellitus[J].J Intern Med,2010,267(4):385-393.
[4]Hou D,Youssef EA,Brinton TJ,et al.Radiolabeled cell distribution after intramyocardial,intracoronary,and interstitial retrograde coronary venous delivery:implications for current clinical trials[J].Circulation,2005,112(Suppl 9):1150-1156.
[5]Li RK,Mickle DA,Weisel RD,et al.Optimal time for cardiomyocyte transplantation to maximize myocardial function after left ventricular injury[J].Ann Thorac Surg,2001,72(6):1957-1963.
[6]Sato K,Nuki T,Gomita K,et al.Statins reduce endothelial cell apoptosis via inhibition of TRAIL expression on activated CD4 T cells in acute coronary syndrome[J].Atherosclerosis,2010,213(1):33-39.

