巨噬細胞表型偏移相關標志物在大鼠心肌梗死區的動態表達
張 玲 ,羅悅晨 ,周 欣 ,李玉明
(1.天津醫科大學研究生院,天津 300070;2.武警后勤學院附屬平津醫院心臟中心,武警部隊心血管病研究所,天津 300162)
近年來的研究顯示單核巨噬細胞在心肌梗死后的炎癥反應和組織修復中發揮著重要的作用[1-3]。巨噬細胞有M1(經典激活型,classical activation macrophages)和 M2(替代激活型,alternative activationmacrophages)[4-11]兩種表型。這兩種表型細胞在急性心肌梗死(acutemyocardial infarction,AMI)后的心肌修復過程中發揮著相輔相成的作用,包括清除細胞碎片、促進血管生成、成纖維細胞激活和增殖以及促進膠原代謝等病理生理學變化。本文旨在探討AMI后不同時間點梗死區內巨噬細胞表型偏移相關標志物[趨化因子配體-2(Ccl2)、趨化因子配體-5(Ccl5)、精氨酸酶-1(Arg-1)以及白介素-10(IL-10)]的變化規律,為以巨噬細胞表型變化為靶點的干預策略提供理論依據。
1 材料與方法
1.1 實驗動物及分組 成年雄性清潔級Wistar大鼠,周齡 6~8周,體重 170~200 g,由中國人民解放軍軍事醫學科學院實驗動物中心提供,許可證號:SCXK-(軍)2007-004。
1.2 主要試劑和儀器 TRIZOLReagent(美國Invitrogen M-MLV Promega SYBR green(瑞士Roche),小動物呼吸機(美國HARVARD),心電監測儀(美國 BioPAC Systems),紫外分光光度計(美國Thermo-Fisher),ABI7300熒光定量PCR儀(美國Applied Biosystems)。
1.3 AMI模型建立 按照本實驗室建立AMI模型的方法[12],主要步驟如下:腹腔注射0.4%戊巴比妥鈉(40mg/kg)麻醉動物,連接心電監測儀,沿胸骨左緣剪斷左側第4肋骨,鈍性分離心包膜,快速將心臟擠出胸腔,結扎冠狀動脈前降支根部,結扎成功后可見心電圖示ST段進行性弓背樣抬高,然后迅速將心臟放回胸腔;假手術組只開胸擠出心臟后穿縫合線,但不結扎。術后分別于6 h、24 h及6 d取材,梗死組和假手術組每個時間點3~4只,并將標本放于液氮凍存備用。
1.4 Ccl2、Ccl5、Arg-1、IL-10mRNA 表達水平的測定 按照TRIZOLReagent說明書提取梗死區心肌組織總RNA,提取后的RNA用紫外分光光度計測定濃度和純度(OD260/280及260/230比值),瓊脂凝膠變性電泳鑒定RNA,然后反轉錄合成cDNA,分裝,-70℃保存。按照FastStart Universal SYBR Green Master(ROX)試劑說明書進行real-time PCR,主要如下:反應體系為20μL,包括SYBR Green Master(ROX)10μL、5μmol/mL 的上、下游引物(序列詳見表1)各1μL、cDNA模板1μL、高壓超純水7μL;反應條件:50℃ 2min,95℃10min,95℃15 s,60℃1min,共40個循環。設雙復孔,β-actin作為內參。溶解曲線由PCR儀自動生成。獲得心梗組和假手術組樣本中的目的基因及內參基因的相對表達量,使用2-ΔΔCt方法比較兩組目的基因的表達情況,ΔΔCt=(Ct目的基因-Ct內參基因)心梗組-(Ct目的基因-Ct內參基因)假手術組。各組計算 2-ΔΔCt均數及標準差。

表 1 Ccl2、Ccl5、Arg-1、IL-10 和 β-actin 基因引物序列Tab 1 Nucleotide sequenceof specific primers for real-time PCR of Ccl2,Ccl5,Arg-1,IL-10 andβ-actin
2 結果
2.1 M1偏移標志物Ccl2和Ccl5mRNA的表達水平 與假手術組相比,心肌梗死組Ccl2mRNA表達量在6 h開始增高,24 h達到高峰(分別是假手術組的2.3倍和4.29倍,P<0.05),6 d時表達水平下降(P>0.05)(圖1A)。而 Ccl5mRNA在6 h時與假手術組相比無明顯變化(P>0.05),24 h表達水平明顯升高,達到假手術組的2倍(P<0.05),6 d時下降(圖1B)。
2.2 M2偏移的標志物Arg-1和IL-10mRNA的表達水平 與假手術組相比,Arg-1和IL-10的表達水平在24 h和6 d明顯升高。Arg-1在24 h較假手術組升高了14.5倍,并持續升高至6 d(P<0.05);IL-10在24 h和6 d分別較假手術組升高了10.3倍和 2.9倍(P<0.05)(圖 2A-B)。
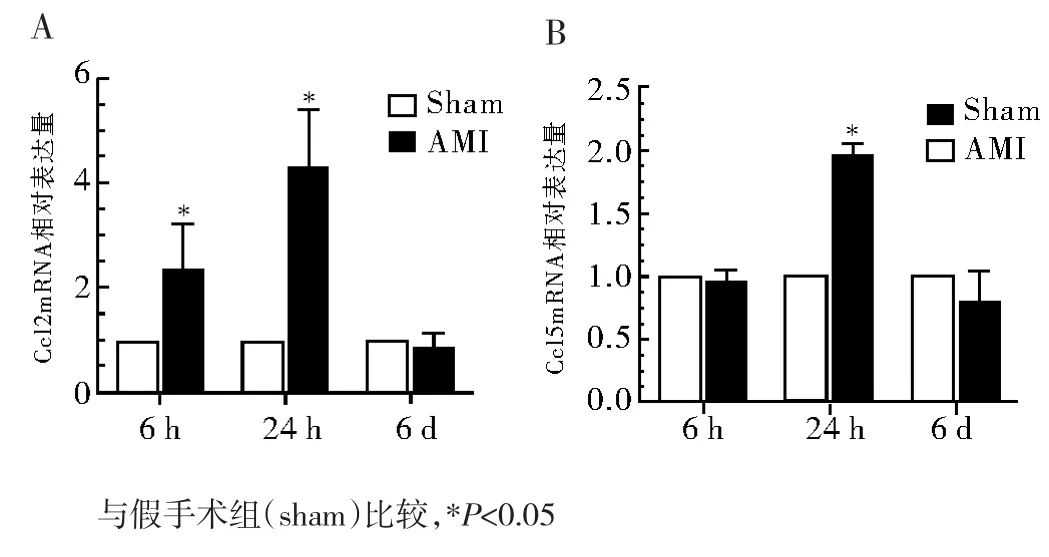
圖1 巨噬細胞M 1偏移相關標志物Ccl2和Ccl5的動態表達情況Fig 1 The dynam icmRNA expression of Ccl2 and Ccl5 for M 1 macrophage

圖2 巨噬細胞M 2偏移相關標志物Arg-1和IL-10的動態表達情況Fig 2 Thedynam icm RNA expression of Arg-1 and IL-10 for M 2 m acrophage
3 討論
本實驗結果顯示:在AMI6 h時,代表M1型巨噬細胞的炎癥因子Ccl2和Ccl5表達水平升高,24 h時達到峰值,6 d左右回落。而代表M2型巨噬細胞的細胞因子Arg-1和IL-10在心肌梗死后24 h至6 d左右的時間窗內表達量升高。由此可以看出心肌梗死后不同表型的巨噬細胞浸潤心肌組織的時間序貫性:前期主要是M1型巨噬細胞浸潤,后期則是M2型發揮作用。
巨噬細胞在AMI后的病理學變化階段中發揮著不可或缺的作用[13]。在心肌細胞壞死數小時內,巨噬細胞滲入梗死心肌區,行使復雜的修復功能[14-15]。研究者在小鼠心梗模型[1-2]中發現:小鼠心梗1~3 d內梗死區有Ly-6Chi型單核細胞(對應人類的M1型巨噬細胞)浸潤,4~6 d時心梗區浸潤的單核細胞為Ly-6Clow表型(對應人類的M2型巨噬細胞)。同時還證實Ly-6Chi型單核細胞是促炎癥細胞,幫助清除細胞碎片,加劇細胞破壞胞外基質。而Ly-6Clow型單核細胞能夠抑制炎癥反應,促進心肌細胞外基質再生和血管新生。因此我們可以推斷參與心肌修復的單核巨噬細胞隨時間變化會發生表型偏移,同時發揮著相輔相成的心肌修復功能。通過對M1、M2型巨噬細胞生物標志物動態表達水平的檢測,本文第一次在基因水平上佐證了兩型細胞在心肌梗死后能夠有序地浸潤梗死區組織。
認識心梗后巨噬細胞表型的偏移規律對心肌梗死的臨床治療學具有潛在指導意義。AMI后大多伴隨心室重塑。即使及時開通冠狀動脈罪犯血管,某些AMI患者也會發生心力衰竭。這與過度的炎癥反應之間存在一定聯系。過度炎癥反應會加重組織損傷,延緩組織修復,促使左心室擴張變形以致發生心力衰竭。因此,如能在心肌梗死初期適度控制M1型巨噬細胞活性,或者促使巨噬細胞由M1表型向M2型轉化將有助于改善心梗預后。
[1]NahrendorfM,SwirskiFK,Aikawa E,etal.Thehealingmyocardium sequentiallymobilizes twomonocyte subsetswith divergentand complementary functions[J].JExp Med,2007,204(12):3037
[2]Tsujioka H,ImanishiT,Ikejima H,etal.Impactofheterogeneity of human peripheral bloodmonocyte subsetsonmyocardial salvage in patientswith primaryacutemyocardial infarction[J].JAm CollCardiol,2009,54(2):130
[3]Martinez FO,Sica A,MantovaniA,etal.Macrophageactivation and polarization[J].FrontBiosci,2008,13:453
[4]Murray PJ,Wynn TA.Obstaclesand opportunities for understandingmacrophage polarization[J].JLeukoc Biol,2011,89(4):557
[5]Auffray C,Sieweke M H,Geissmann F.Bloodmonocytes:development,heterogeneity,and relationship with dendritic cells[J].Annu Rev Immunol,2009,27:669
[6]MantovaniA,Sica A,SozzaniS,etal.The chemokine system in diverse formsofmacrophageactivation and polarization[J].Trends Immunol,2004,25(12):677
[7]Mantovani A.From phagocyte diversity and activation to probiotics:back toMetchnikoff[J].Eur JImmunol,2008,38(12):3269
[8]GoerdtS,OrfanosCE.Other functions,other genes:alternative activation ofantigen-presenting cells[J].Immunity,1999,10(2):137
[9]Mosser DM.Themany faces ofmacrophage activation[J].JLeukoc Biol,2003,73(2):209
[10]MillsCD,Kincaid K,Alt JM,etal.M-1/M-2macrophagesand the Th1/Th2 paradigm[J].JImmunol,2000,164(12):6166
[11]BiswasSK,MantovaniA.Macrophageplasticityand interactionwith lymphocyte subsets:cancer as a paradigm[J].Nat Immunol,2010,11(10):889
[12]Zhou X,Li YM,JiW J,etal.Phenytoin can accelerate the healing processafterexperimentalmyocardialinfarction[J].IntJCardiol,2006,107(1):21
[13]Lainchbury JG,Richards AM,NichollsM G,etal.Brain natriuretic peptide and neutral endopeptidase inhibition in left ventricular impairment[J].JClin EndocrinolMetab,1999,84(2):723
[14]JenkinsSJ,RuckerlD,Cook PC,etal.Localmacrophage proliferation,rather than recruitment from the blood,is a signature of TH2 inflammation[J].Science,2011,332(6035):1284
[15]Usher M G,Duan SZ,Ivaschenko CY,etal.Myeloidmineralocorticoid receptor controlsmacrophage polarization and cardiovascular hypertrophy and remodeling inmice[J].JClin Invest,2010,120(9):3350

