醫療器械生產過程確認方式及監管關注點
北京市藥品監督管理局密云分局(101500)裴杰 焦彥超 王欣
2011年1月1日施行的《醫療器械生產質量管理規范》共有十七處涉及“確認”內容。本文著重闡述了醫療器械生產過程確認的方式及監管關注點。
1 確認的定義
確認(validation):通過提供客觀證據對特定的預期用途或應用要求已得到滿足的認定[1]。(注解:Validation—不同的標準,同一英文單詞可能有不同的譯文;有學者譯作“驗證”,在GB/T 19000-2008《質量管理體系 基礎和術語》3.8.5中譯作“確認”。本文遵循《醫療器械生產質量管理規范》中的定義,使其更加符合該詞的英文本意,譯作“確認”。)
2 確認分類
按照產品加工和工藝的要求以及設備的變更,工藝修訂等均需通過確認的特點,可以把確認分成四種類型:前確認(prospective validation)、同步確認(concurrent validation)、回顧性確認(retrospective validation)、再確認(revalidation)。
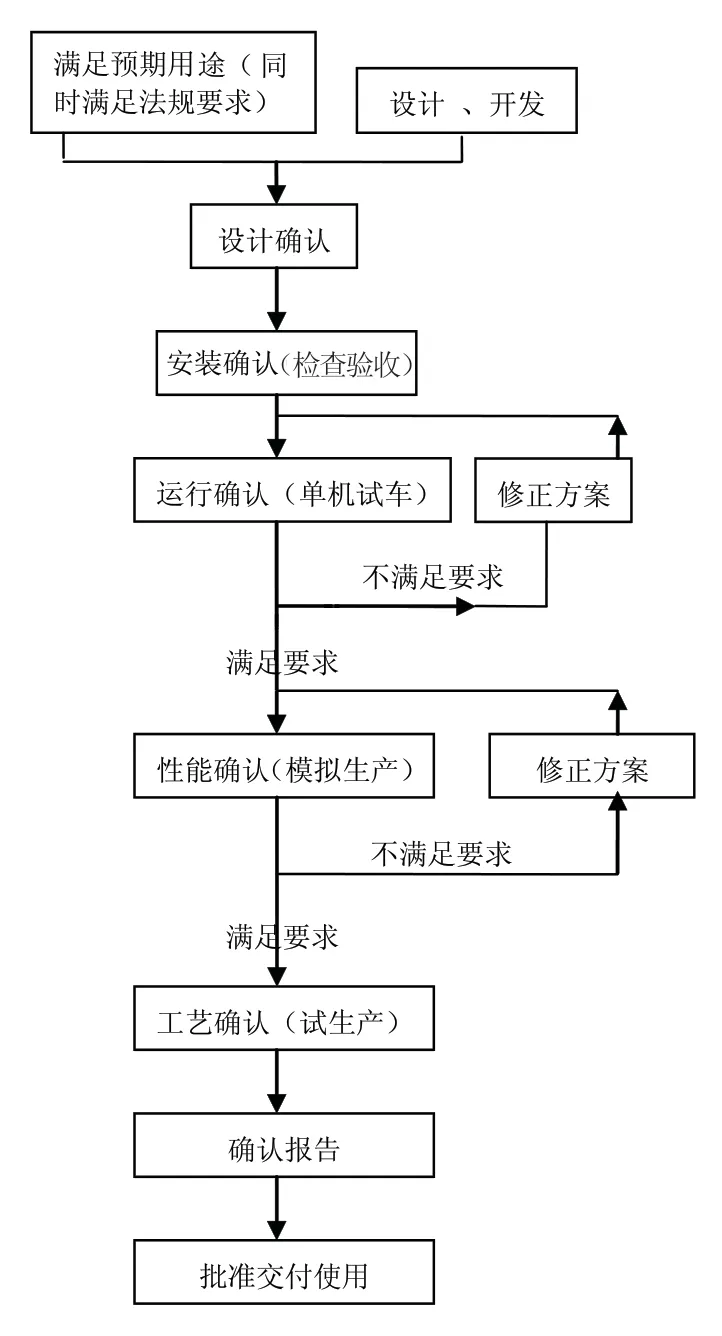
2.1 前確認 系指一項工藝、一個過程、一個系統、一個設備或一種材料在正式投入使用前進行的,按照設定的確認方案進行的試驗。
前確認是正式投放前的質量活動,系指在該工藝正式投入使用前必須完成并達到設定要求的確認。前確認的成功是實現新產品、新工藝從設計和開發向實際生產轉化的必要條件,其步驟如左圖所示。
前確認舉例及監管關注點:
以無菌加工過程為例,在以往檢查的過程中,發現某企業建立了純化水系統,但卻將50多米的輸水管埋入地下,致使間歇停產時無法將管路中的積水排空,導致滋生細菌、無法清洗、難以檢查維修。該企業在施工時忽視了前確認,沒有進行嚴格試驗和對真實的生產過程進行模擬,也沒有發現工程和設計中的失誤,沒能及時采取糾正措施,導致后期的工程返工,最終蒙受了很大的經濟和信譽損失。
國內部分生產機電類醫療器械的生產企業,由于市場價格的變化往往較為頻繁地更換電氣元件(指的是不同廠家的同種規格的元件),忽視前確認,往往蘊含潛在風險。
2.2 同步確認 生產中在某項工藝運行的同時進行的確認,即從工藝實際運行過程中獲得的數據來確立文件的依據,以證明某項工藝達到預定要求的活動。采用這種確認方式的先決條件是:①有完善的取樣計劃,即生產及工藝的監控比較充分;②有經過確認的過程方法,靈敏度及選擇性比較好;③對所確認的設備、產品或工藝已有相當的經驗和把握。
同步確認舉例和監管關注點:
例如生產體外診斷試劑和可吸收縫合線對空氣有干燥要求的潔凈間,其空調系統所能調節的濕度受外界大環境的影響,因此,確認空調凈化系統是否符合極端天氣(有時降雨持續數天或數周)的設定要求,需要雨季的考驗,但是這種驗證的條件是很難遇到的,采用同步確認的方法更為實際。(《醫療器械生產質量管理規范無菌醫療器械檢查評定標準》第1003條(植入標準為1003條)規定:如果輸出不能被驗證,企業是否對環境控制系統進行確認,是否進行定期檢查以驗證該環境系統正確的運行。)
在監管的過程中,企業往往忽視的3個前提條件而對某些過程采用同步確認,如環氧乙烷滅菌的碼放方式和碼放數量,企業有時根據產量多少進行改變,采取同步確認,這種方式存在很大質量風險,還應按照前確認的方法嚴格執行。
在這種情況下,實際模式為滿足監控條件下的試生產,可以同時得到:①合格的產品;②確認的結果即“特定的預期用途或應用要求已得到滿足”的證據。但這種方式可能帶來的產品質量上的風險,應嚴格限定采用。
2.3 回顧性確認 指以歷史數據的統計分析為基礎的、旨在證實正式生產的工藝條件適用性的確認。
當有充分的歷史數據可以利用時,從對大量歷史數據的回顧分析更可以看出工藝控制狀況的全貌,因此,其可靠性更好。回顧性確認應具備必要的條件是:①有至少充足的數據量作為樣本,生產應當是連續的;②檢驗結果可以用數值表示,可以進行統計分析;③記錄中有明確的工藝條件(如輸液器拉管工藝,如果沒有設定的溫度和注塑時間的記錄,那么相應批的檢驗結果就不能用于統計分析,結果也不能用作回顧性確認);④工藝量是標準化的,并一直處于控制狀態。
回顧性確認舉例及監管關注點:
在實際監管過程中,企業往往發現,隨著時間的推移,某些過程需要通過回顧性確認加以認定。例如,企業通常在設備運行前進行了前確認,規定了一些設備耗材的更新周期,但是在實際運行中發現,某些周期參數可以更加優化,企業常常問道,究竟多長時間應當更換空調的高效過濾器,多長時間應當清洗初效過濾器,在滿足要求的前提下最大的節約成本,其實這個問題根據不同空調廠家濾材的不同,企業空調使用頻次不同,當地空氣質量環境的不同而不同,通過長期的運行,進行圖表分析,回顧性確認往往可以解決這個問題;還有,某些產品的滅菌參數選擇(例如環氧乙烷滅菌的時間和加藥量等參數)和產品的初始污染菌有很大關系,系統的回顧及趨勢分析常常可以揭示工藝運行的某些預想不到的“最差條件”,甚至可能導致“再確認”的制定或者實施。
2.4 再確認 指一項工藝、一個過程、一個系統、一臺設備或一種原材料經過確認并在使用一個階段以后進行的,或為法律強制性(如標準規定周期確認,質量管理規范規定產品、設備,包括軟件,工藝參數發生改變而進行確認);或為旨在證實已確認狀態沒有發生飄移而進行確認。再確認分為以下三種類型:
2.4.1 強制性再確認 一些列入國家標準、行業標準、企業注冊標準的確認工作,標準中規定的型式和周期檢驗。
2.4.2 改變性再確認 在醫療器械生產過程中,由于各種原因,需要對設備、系統、材料以及管理、操作規程做某種變更,有些情況下,這種變更可能對產品質量造成重要影響,所以需要進行確認,稱為改變性再確認。例如:醫用高分子材料制品理療質量標準的改變,注塑、擠塑工藝參數或工藝路線的變更,系統內重要設備的改變,組成的修改或批量的改變,日常檢測表明存在影響產品質量的變遷跡象等。企業應根據運行和變更情況以及對產品質量影響的大小確定再確認對象,并對原來的確認方案進行回顧和修訂,以確定再確認的范圍、項目及合格標準等。
2.4.3 定期再確認 有些關鍵設備和關鍵工藝對產品的質量和安全起著決定性作用,如一次性使用無菌醫療器械生產過程中的滅菌過程、監視和測量的計算機軟件、空氣凈化系統、純化水、注射用水系統等,即使這類設備及規程沒有變更,也應定期防止漂移而進行再確認。
再確認監管關注點:①部分項目未進行再確認,對于強制性再確認項目,企業一般都能認真對待,能及時完成,但對于改變性和定期再確認項目,一些企業便有所疏忽或者根本沒有進行再確認。如企業未在制度中進行規定,或是即便規定了也未能執行生產質量管理規范規定的“在產品、滅菌器、工藝參數等發生變化時是否對滅菌過程進行再確認”,部分企業在產品種類、規格增加或變動時,不同產品混裝滅菌時未進行再確認。②部分企業對再確認的意義沒有真正理解,只是在原確認方案上加一個“再”字便成了再確認方案,部分項目不符合實際,確認方案也缺乏可操作性,成了刻舟求劍。③內容不完善,《醫療器械生產質量管理規范無菌醫療器械檢查評定標準(試行)》第5402條(植入標準為6302條)規定“過程的確認是否至少包括:評價計劃的制定、評價的實施、評價的記錄和評價的結論(或報告)”主要問題是確認過程中的部分數據和分析內容歸檔不完整,確認文件中評價不準確、無建議等。④應付性再確認現象時有發生,現場檢查也發現,有些企業對再確認存在敷衍了事或弄虛作假的行為,《醫療器械生產質量管理規范無菌醫療器械檢查評定標準(試行)》在檢查項目中有3條關于再確認方面的條款,分別為5502、5601、6306(植入標準為6401、6802、7806)。這些都表明,企業再確認的范圍、項目、方法、合格標準、再確認數據、記錄、數據分析、措施等有待進一步完善。
3 存在問題的解決方法
3.1 確認與再確認是質量管理規范檢查內容,部分條款涉及重點檢查項目(*項),確認與再確認文件則是企業有效實施規范要求的重要證據,工作的好壞直接反映該企業生產質量管理是否規范。因此,企業必須結合實際認定確認、再確認項目、制定方案。
3.2 認真開展調查工作,這是開展好確認與再確認工作的必要條件。企業應高度重視再確認工作,成立再確認機構和各項目確認小組,制定再確認計劃。在此基礎上,企業要按照相關要求做好調查,根據實際情況認真編制再確認方案,合理確定再確認項目,并根據再確認項目的不同選擇不同的再確認方法。
3.3 做好確認與再確認數據分析、評估和總結工作。參與者要根據再確認方案的要求。嚴格按照標準開展工作,如實記錄數據,確保數據的原始性、真實性、可靠性。組織者應按照標準對確認與再確認數據進行合理分析、評估,對偏差及時糾正,對主要遺留問題及后果進行評估,并提出建設性意見和建議,最后做出確認與再確認結論,寫出總結報告。

