糖基化反應對蛋清蛋白質凝膠性的影響
孫 強,遲玉杰*,胥 偉
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
糖基化反應對蛋清蛋白質凝膠性的影響
孫 強,遲玉杰*,胥 偉
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
為研究糖基化反應提高蛋清蛋白質凝膠性的機理,利用氨基酸分析儀、苯酚硫酸法、奧氏黏度計、靜態激光散射儀對糖基化蛋清蛋白質氨基酸組成、總糖含量、特性黏度、粒徑分布進行測定與分析。結果顯示:糖基化反應可使蛋清蛋白質的凝膠強度和持水性分別提高91.7%和35.2%,且二者均在反應4d后達到最高值;糖基化處理5d后,蛋清蛋白質的賴氨酸含量相對降低28.42%,總糖含量增至2.18%;特性黏度隨反應時間的延長增幅較小;糖基化蛋白粒徑分布在0.1~50.0μm之間,糖基化2d內,粒徑分布由小粒徑峰向大粒徑峰轉變;糖基化2d后,粒徑分布變化不明顯。
糖基化;蛋清蛋白質;凝膠強度;粒徑分布
蛋清蛋白質(egg white protein,EWP)良好的營養性和多種功能特性使其成為食品工業中重要的成分配料,被廣泛用于火腿、臘腸、魚糜制品及面類制品的生產中。隨著食品工業的發展,對具有更高功能特性的蛋清蛋白質的需求極為迫切[1-3]。因此通過各種方法對蛋清蛋白質的功能特性進行改善具有重要的理論意義和實用價值。
利用糖基化反應對蛋清蛋白質進行糖基化修飾是一種安全廉價的改性方法,可以顯著改善蛋清蛋白質的多種功能性質。Kato[4]研究表明經糖基化的卵白蛋白乳化性、熱穩定性和抗微生物活性都好于未經糖基化處理的卵白蛋白;Jafar等[5]利用高甲氧基果膠與蛋清蛋白質進行接枝反應,結果表明產物的乳化性及乳化穩定性都高于未改性的蛋清蛋白質;Naotoshi等[6]利用半乳甘露聚糖與蛋清蛋白質反應,研究顯示改性后的蛋清蛋白質的凝膠強度和持水性均好于未經處理的蛋清蛋白質;于濱等[7]利用葡聚糖對蛋清蛋白質進行糖基化改性研究,實驗證明糖基化處理后,蛋清粉的凝膠性、熱穩定性、乳化性和起泡性都有顯著提高。
雖然前人[4-7]對糖基化改善蛋清蛋白質的功能性質進行了較為深入的研究,但是很少涉及糖基化提高蛋清蛋白質功能性的機理。蛋清蛋白質的凝膠性是一種重要的特性指標。研究糖基化反應對蛋清蛋白質凝膠性的影響,并對改性過程中各組分的變化情況及不同粒徑蛋白分子的分布情況進行分析,不僅對進一步研究改性機理具有重要意義,而且對改性蛋清蛋白質的生產加工具有重要的指導價值。
1 材料與方法
1.1 材料、試劑與儀器
蛋清粉 市售。
殼聚糖 河北大地生物科技有限公司;其他化學試劑均為分析純。
ALC-310電子分析天平 北京賽多利斯儀器系統有限公司;722-2000型分光光度計 山東高密彩虹分析儀器有限公司;FDU-1100冷凍干燥機 日本Eyela公司;L-8800型氨基酸自動分析儀 日本日立公司;BI-200SM靜態激光散射儀 美國布魯克海文公司;TA-XTplus2質構儀 英國Stable Mic System公司;奧氏黏度計 上海隆拓儀器廠。
1.2 方法
1.2.1 糖基化蛋清蛋白質的制備
參考于濱等[7]糖基化蛋清蛋白質(glycosylation egg white protein,GEWP)的制備方法,并作部分改動。將殼聚糖與蛋清蛋白質以1:9(m/V)的比例充分混合,配制成10g/100mL的混合樣品溶液,冷凍干燥,將制得的混合粉置于裝有飽和KI溶液(相對濕度65%)的密閉容器中,60℃保溫1~5d,即制得不同反應時間的糖基化蛋清蛋白質。
1.2.2 糖基化蛋清蛋白質凝膠強度和凝膠持水性的測定
凝膠制備:將蛋清粉配制成質量濃度為10g/100mL的溶液,用0.1mol/L NaOH 或0.1mol/L HCl調pH值至7.0,然后取20mL該溶液移入直徑32mm體積25mL的燒杯中,用保鮮膜封口,90℃水浴20min,取出后在流水中快速冷卻,4℃靜置24h待測。
凝膠強度測定:根據Ju等[8]的方法并作部分改動,采用質構儀進行測定,樣品測定在25℃進行,儀器條件:采用P0.5探頭,測試前速率5.0mm/s;測試速率2.0mm/s;測試后速率2.0mm/s;下壓距離10mm;引發力5g。凝膠強度凝膠強度用硬度即探頭下壓過程中的最大感應力表示。
凝膠持水性測定:根據Choi等[9]的方法,取一定質量(m1)的凝膠體,切成大小均一的小粒,4000r/min離心20min,取出凝膠體用濾紙將表面水分吸干后稱質量(m2),凝膠體持水性按下式計算。
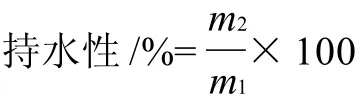
式中:m1為離心前凝膠體質量/g;m2為離心后凝膠體質量/g。
1.2.3 糖基化蛋清蛋白質氨基酸含量測定
根據GB/T 5009.124—2003《食品中氨基酸的測定》方法進行測定[10]。
1.2.4 糖基化蛋清蛋白質總糖含量測定
采用苯酚-硫酸法測定。將糖基化蛋清粉配制成1g/100mL的水溶液,然后使用透析袋(截留分子質量10000u)透析24h,吸取1mL透析液至試管中,加入6g/100mL苯酚1.0mL混勻,再加5mL濃硫酸,迅速混勻。室溫放置5min,然后在沸水浴中保溫15min,用水冷卻5min,再搖勻,以普通蛋白粉為空白,于490nm波長處測定吸光度,依據標準曲線計算總糖含量。
1.2.5 糖基化蛋清蛋白質特性黏度測定
高分子溶液黏度與分子質量及結構符合Mark-Houwink方程[11],即[η]=kMα(其中k和α是常數,其值取決于高分子及溶劑的性質和溫度等因素)。利用奧氏黏度計測量黏度,25℃恒溫水浴,液體流過黏度計毛細管的時間通過精度為0.01s的電子數字秒表計時。每個數據點進行3次重復,每2次實驗的差值不大于0.05s,取3次測量的平均值作為最終實驗結果。
1.2.6 糖基化蛋清蛋白質溶液粒徑分析
參照Schwenke等[12]和Easa等[13-14]的方法,并有所改動。稱取0.2g樣品,溶于20mL 0.1mol/L pH7.6的磷酸緩沖液中,磁力攪拌使其充分溶解,用靜態激光散射儀測定其粒徑分布。操作條件:介質水溶液;掃描角度90°;溫度25℃;波長632.8nm。
1.2.7 數據分析
糖基化蛋清蛋白質凝膠強度、持水性、特性黏度及總糖含量的測定實驗每組重復3次,單因子方差分析通過SPSS V18.0的One-way ANOVA程序進行分析,定義P<0.05為差異顯著,實驗結果用Origin8.0繪制成圖,圖中誤差線為樣品標準差。
2 結果與分析
2.1 糖基化對蛋清蛋白質凝膠強度和持水性的影響
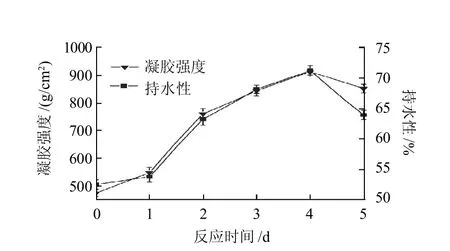
圖1 糖基化蛋清蛋白質凝膠性的變化Fig.1 Change in gel properties of GEWP with reaction time
由圖1可知,殼聚糖-蛋清蛋白質糖基化接枝產物的凝膠強度的變化趨勢和持水性的變化趨勢相一致。糖基化處理1d后,凝膠強度和持水性稍有增強,在處理2~4d后,凝膠強度和持水性顯著提高,處理4d后達到最大值,分別由475.374g/cm2和52.6%提高到911.231g/cm2和71.1%,提高幅度分別達到91.7%和35.2%,但處理5d后的樣品凝膠強度和持水性開始下降。這可能是由于反應開始時,殼聚糖與蛋白質受熱逐步結合使蛋白質結構部分展開,有利于某些基團的暴露,從而使凝膠強度和持水性得到提高。隨著反應時間的延長,蛋白質與殼聚糖過度結合,反而使凝膠強度和持水性下降。
2.2 糖基化對蛋清蛋白質氨基酸組成的影響
糖基化作用就是碳水化合物以共價鍵與蛋白質分子上的α-或ε-氨基相連接而形成糖基化蛋白的化學反應[15]。糖基化蛋清蛋白質氨基酸組成變化對研究糖基化蛋清蛋白質凝膠性和持水性的變化十分重要。糖基化前后蛋清蛋白質氨基酸組成的變化見表1。糖基化后蛋清蛋白質的各種氨基酸均有不同程度的損失,總氨基酸含量由80.02%下降至66.66%,這說明,糖基化作用對蛋清蛋白質氨基酸造成了一定損失。尤其是賴氨酸,其含量相對降低了28.42%,顯著高于其他氨基酸損失的平均水平,這與Jafar等[5]的研究一致。造成賴氨酸大量損失的原因可能是賴氨酸的ε-氨基參與了與多糖的糖基化反應。賴氨酸的大量損失會降低蛋清蛋白質的生物有效性,同時也對其營養價值造成損害。然而,通過賴氨酸與殼聚糖的接枝反應,蛋清蛋白質獲得了大量的羥基,強化了蛋白質之間的氫鍵作用,同時吸附了更多的水分子,從而增強了蛋清蛋白質的凝膠強度和持水性。
2.3 糖基化對蛋清蛋白質總糖含量及特性黏度的影響

圖2 糖基化對蛋清蛋白質總糖含量和特性黏度的影響Fig.2 Effect of glycosylation on the content of total sugar and intrinsic viscosity of EWP
由圖2 可知,糖基化蛋清蛋白質的總糖含量隨著處理時間的延長而不斷增加。反應1d后,蛋清蛋白質的總糖含量顯著(P<0.05)增加,而在隨后的處理中增加不明顯,處理3、4、5d樣品總糖含量的增加已不顯著(P>0.05),最終總糖含量增至2.18%。這可能是由于處理1d內糖基化反應進行的較快,生成了大量的糖基化蛋白,而隨著反應的進行,反應底物減少,反應的速率降低,糖基化蛋白在體系內積累的速度也隨之降低。與未作處理的蛋清蛋白質相比,糖基化蛋清蛋白質的特性黏度都有所上升,并且呈現出隨處理時間延長而逐漸增加的趨勢。根據Mark-Houwink方程,可以認為在一定溫度條件下,糖基化蛋清蛋白質的平均分子質量隨糖基化反應的進行不斷增大。這可能是不斷有多糖分子接枝到蛋清蛋白質分子上,使糖基化產物的平均分子質量不斷增加。此外,糖基化反應過程中蛋白質分子形態的改變也可能對增大特性黏度有影響。
2.4 糖基化對蛋清蛋白質分子粒徑分布的影響

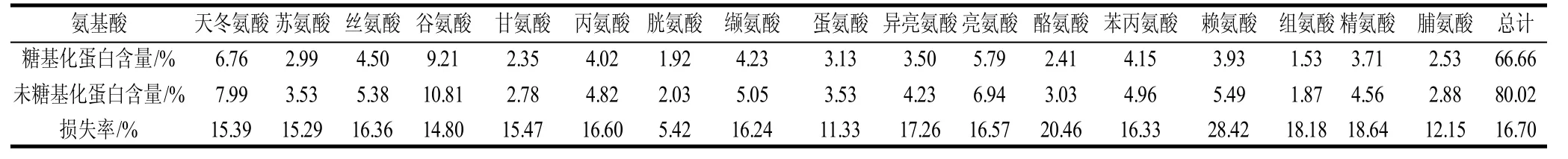
表1 糖基化對蛋清蛋白質氨基酸組成的影響Table 1 Effect of glycosylation on amino acid compositions of EWP
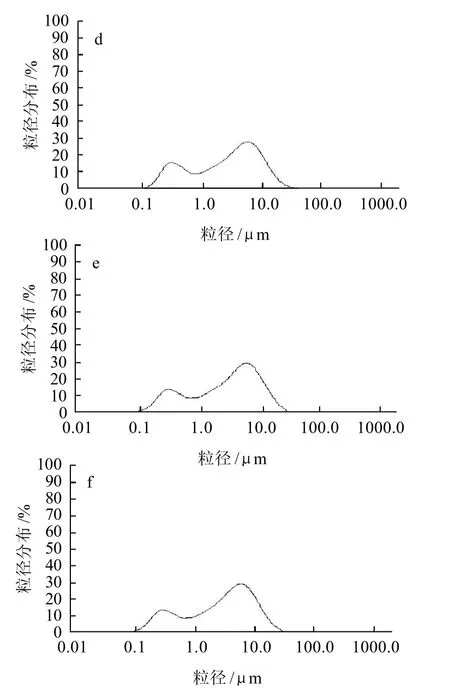
圖3 糖基化蛋清蛋白質粒徑分布隨時間的變化Fig.3 Change in particle size distribution of GEWP with reaction time
由圖3可知,相對于未糖基化的蛋清蛋白質,糖基化蛋清蛋白質的分子粒徑發生了明顯的變化。糖基化蛋清蛋白質的分子粒徑主要分布在0.1~50.0μm范圍內。而在此范圍內,粒徑的分布有明顯分為小粒徑峰(0.1~1.0μm)和大粒徑峰(1.0~20.0μm)。經過1d的糖基化處理,樣品的分子粒徑向較高的范圍內轉變,大粒徑峰的面積明顯增大。反應2d以后這種變化已不明顯。2~5d處理的樣品粒徑分布的峰形已沒有明顯區別。這說明多糖主要在2d內接枝到蛋清蛋白質上,這與凝膠強度和持水性以及總糖含量的增加相符。

表2 糖基化蛋清蛋白質平均粒徑(D[4,3]和D[3,2])Table 2 Mean particle size of GEWP (D[4,3] and D[3,2])
表2列出了不同處理時間糖基化蛋清蛋白質的平均分子直徑。其中D[4,3]表征的是體積的直徑,D[3,2]表征的面積的直徑。可以看出,隨著糖基化的進行D[4,3]不斷增加,而D[3,2]在處理2d后已沒有變化。這可能是因為多糖的鏈接增加了蛋清蛋白質的體積,但對蛋清蛋白質面積的影響較小。這說明糖基化反應引起了蛋清蛋白質分子形態的變化,驗證了上述研究中糖基化蛋清蛋白質特性黏度的變化。
3 結 論
利用殼聚糖對蛋清蛋白質進行糖基化改性,反應4d的改性蛋清蛋白質的凝膠強度和持水性分別提高了91.7%和35.2%;糖基化蛋清蛋白質總氨基酸含量降低了13.36%,其中賴氨酸損失最多,達到28.42%;總糖含量和特性黏度隨著反應時間的延長不斷增加,但反應2d以后總糖含量的增加不顯著(P>0.05);糖基化蛋清蛋白質的分子粒徑主要分布在0.1~50.0μm的范圍內,并分為大粒徑峰和小粒徑峰,糖基化蛋清蛋白質的粒徑分布逐漸由小粒徑峰向大粒徑峰轉變,反應2d后粒徑分布變化不再顯著。這不但對進一步研究糖基化改性提高蛋清蛋白質凝膠性的機理具有重要意義,同時對改性蛋清粉的加工具有一定的指導價值。
[1] 遲玉杰. 雞蛋深加工系列產品綜合開發技術概況[J]. 中國家禽, 2004, 26(23): 6-9.
[2] EVANS T. 世界禽蛋產業全景展望[J]. 中國家禽, 2009, 31(15): 5-7.
[3] 遲玉杰 .蛋清蛋白質的糖基化產物結構與凝膠強度關系的探究[J]. 食品科學, 2009, 30(21): 485-488.
[4] KATO A. Review: industrial applications of maillard-type protein-polysaccharide conjugates[J]. Food Science Technology Research, 2002, 8(3): 193-199.
[5] JAFAR A H, FADIA A H. Functional egg white-pectin conjugates prepared by controlled Maillard reaction[J]. Journal of Food Engineering, 2010, 100(1): 152-159.
[6] NAOTOSHI M, KATORI N, AKIKO S, et al. Improvement of gel properties of dried egg white by modification with galactomannan through the maillard reaction[J]. Journal of Agricltural and Food Chemistry, 2002, 50(14): 4113-4118.
[7] 于濱, 遲玉杰. 糖基化改善蛋清蛋白功能性的研究[J]. 中國家禽, 2009, 30(7): 15-18.
[8] JU Z Y, KILARA A. Textural properties of cold-set gels induced from heat-denatured whey protein isolates[J]. Journal of Food Science, 1998, 63(2): 288-292.
[9] CHOI J, CHO M S, PARK J W. Effect of hydration time and salt addition on gelation properties of major protein additives[J]. Journal of Food Science, 2000, 65(8): 1338-1342.
[10] GB/T 5009.124—2003 食品中氨基酸的測定[S].
[11] PICOUT D R, ROSS-MURPHY S B. On the Mark-Houwink parameters for galactomannans[J]. Carbohydrate Polymers, 2007, 70(2): 145-148.
[12] SCHWENKE K D, HENNMG T, DUDEK S, et al. Linited trptic hydrolysis of pea legumin molecular mass and conformational stability of legumm-T[J]. Journal of Biological Macromolecules, 2001, 28(1): 175-182.
[13] EASA A M, ARMSTRONG H J, MITCHELL J R, et al. Maillard induced complexes of bovine serum albumin: a dilute solution study[J]. International Journal of Biological Macromolecules, 1996, 18(4): 297-301.
[14] EASA A M, HILL S E, MITCHELL J R, et al. Bovine serum albumin gelation as a result of the Maillard reaction[J]. Food Hydrocolloids, 1996, 10(2): 199-202.
[15] 羅永康, 張愛榮. 糖基化反應改善蛋白質功能性質的研究進展[J]. 食品科技, 2004, 30(7): 4-10.
Effect of Glycosylation on Gel Properties of Egg White Protein
SUN Qiang,CHI Yu-jie*,XU Wei
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The effect of glycosylation on gel strength and water-holding capacity of egg white protein (EWP) was investigated. The change of amino acid compositions, total sugar content, and intrinsic viscosity as well as particle size distribution were detected by amino acid analyzer, phenol sulfuric acid method, and ostwald viscosimeter as well as static laser light scattering instrument. The results showed that gel strength and water-holding capacity of egg white protein were improved after glycosylation. Both of them reached to the highest value after glycosylation for four days, which revealed the improvement by 91.7% and 35.2%, respectively. The content of lysine in egg white protein exhibited a decrease by 28.42% and the content of total sugar revealed an increase by 2.18% at the fifth day during the glycosylation process. Intrinsic viscosity revealed a slight increase as the extension of treatment time. The particle size of the protein was in the range of 0.1-50.0μm and the conversion from small size protein to large size protein was observed at the first two days, and no significant change was observed during the last four days.
glycosylation;egg white protein;gel strength;particle size distribution
TS253.1
A
1002-6630(2012)05-0049-04
2011-04-06
國家自然科學基金項目(30871954)
孫強(1985—),男,碩士,研究方向為食品化學。E-mail:swsunqiang@163.com
*通信作者:遲玉杰(1963—),女,教授,博士,研究方向為食品化學及農產品深加工。E-mail:yjchi@126.com

