3種乳源酪蛋白粒徑及膠束結(jié)構(gòu)的差異性
李子超,王麗娜,李昀鍇,徐明芳*
(暨南大學(xué)生命科學(xué)技術(shù)學(xué)院,廣東 廣州 510632)
3種乳源酪蛋白粒徑及膠束結(jié)構(gòu)的差異性
李子超,王麗娜,李昀鍇,徐明芳*
(暨南大學(xué)生命科學(xué)技術(shù)學(xué)院,廣東 廣州 510632)
通過納米粒度分析儀和掃描電子顯微鏡,分別對水牛乳、牛乳及羊乳中的酪蛋白顆粒直徑大小分布情況及酪蛋白膠束結(jié)構(gòu)進(jìn)行研究。結(jié)果表明:水牛乳、牛乳及羊乳中酪蛋白的粒徑分布及膠束結(jié)構(gòu)方面存在明顯的差異。水牛乳酪蛋白平均顆粒直徑為182.3nm,酪蛋白顆粒互相連接成較細(xì)長的膠束,膠束之間交聯(lián)成網(wǎng)絡(luò)狀;牛乳酪蛋白平均顆粒直徑為207.4nm,酪蛋白顆粒聚集成直徑較大的膠束;羊乳酪蛋白平均顆粒直徑為173.8nm,酪蛋白顆粒僅能夠形成較短的膠束,也不能交聯(lián)成網(wǎng)絡(luò)狀。
納米粒度分析儀;掃描電子顯微鏡;酪蛋白;粒徑;膠束結(jié)構(gòu)
乳品中的蛋白主要包括酪蛋白和乳清蛋白兩大類,酪蛋白是乳品中特有的一組含有大量磷和鈣的蛋白,不溶于水,通常以聚集體的形式存在,約占乳品總蛋白含量的80%,是乳品中重要的蛋白組分,主要由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白4種蛋白組成[1-2]。乳清蛋白易溶于水,含量約占乳品總蛋白含量的20%,主要包括α-乳清蛋白、β-乳球蛋白、牛血清蛋白、免疫球蛋白。
乳源酪蛋白具有表面活性,但不同于其他小分子表面活性劑具有極性頭部和非極性尾部,它由不同的疏水性氨基酸為主的不帶電區(qū)域及親水性氨基酸主導(dǎo)的帶電區(qū)域組成。與其他表面活性分子一樣,在濃度高于其臨界濃度條件時,酪蛋白自發(fā)聚集成以疏水區(qū)域?yàn)楹诵模H水部分及其他親水性乳清蛋白包裹在表面的顆粒[2]。
乳品中的酪蛋白自發(fā)聚集成更大的膠體凝聚狀態(tài),稱為酪蛋白聚集體。在高爾基體中,單體的酪蛋白通過與磷和鈣的結(jié)合,屏蔽酪蛋白本身所具有的電荷并使之聚集成為更大顆粒狀態(tài)[3-5]。有研究表明,牛乳中的酪蛋白顆粒大小不一,其直徑的分布范圍約為80~500nm,平均大小約為200nm[6]。酪蛋白中磷酸化的絲氨酸殘基能夠結(jié)合磷酸鈣,在酪蛋白聚集體內(nèi)部形成不同大小的聚集區(qū)[7-8]。X射線和中子散射證明,酪蛋白聚集體內(nèi)部的磷酸鈣聚集導(dǎo)致酪蛋白聚集體散射不均一[9-10]。酪蛋白顆粒之間可以互相連接,成為膠束。國外最新研究報道,用透射電子顯微鏡發(fā)現(xiàn)了牛乳中的酪蛋白膠束[11-12]。酪蛋白膠束穩(wěn)定性很高,即使在煮沸的條件下仍能夠保持膠束狀態(tài)。
乳品業(yè)作為朝陽產(chǎn)業(yè),是國家重點(diǎn)扶持產(chǎn)業(yè),國家在政策、資金等方面給予有力支持。農(nóng)業(yè)部明確提出“要突出發(fā)展乳品生產(chǎn)”。國家農(nóng)業(yè)部制定的《全國奶業(yè)“十一五”戰(zhàn)略發(fā)展規(guī)劃和2020年遠(yuǎn)景目標(biāo)規(guī)劃》等一系列重大政策的出臺都為乳品的開發(fā)創(chuàng)造了有利的宏觀環(huán)境[13]。
2007年,我國人均乳品消費(fèi)量為28kg,與發(fā)達(dá)國家和世界平均水平相比,消費(fèi)水平依然很低[14]。隨著人們收入水平的提高及健康意識的增強(qiáng),我國乳品消費(fèi)量出現(xiàn)大幅度的增長。但長期以來,我國對乳品的基礎(chǔ)研究不足,尤其對水牛乳、羊乳等新興乳品研究更加匱乏。酪蛋白作為乳品中的主要蛋白成分,也是食品加工中最主要的原料成分。對酪蛋白的研究,不僅是指定乳品加工工藝參數(shù)的基礎(chǔ),而且也是畜牧業(yè)中和評定乳品營養(yǎng)價值的必要指標(biāo),因此對酪蛋白的研究具有很高的研究和應(yīng)用價值。
在生物樣品的超微結(jié)構(gòu)的觀測方面,掃描電子顯微鏡等電子顯微鏡技術(shù),具有其他物理、化學(xué)方法不可比擬的結(jié)果直觀性好的巨大優(yōu)勢,甚至可以用來觀測蛋白質(zhì)等生物大分子的二維排列,解釋納米尺度的結(jié)構(gòu)細(xì)節(jié)[15]。本研究的主要目的就是分別通過納米粒度分析儀和掃描電子顯微鏡成像技術(shù)分別對水牛乳、牛乳及羊乳中酪蛋白的顆粒直徑分布情況及膠束結(jié)構(gòu)形態(tài)進(jìn)行研究,解釋種屬差異對乳源蛋白的聚集及酪蛋白膠束結(jié)構(gòu)的影響,為乳制品的研制開發(fā)提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 材料與儀器
水牛乳 廣州百富露公司;牛乳 廣州燕塘公司;羊乳 香港味羊公司;醋酸異戊酯 暨南大學(xué)分析測試中心。
CP224C電子天平 奧豪斯儀器有限公司;TDL-5-A臺式離心機(jī) 上海安亭科學(xué)儀器廠;PHS-3C pH計 上海雷磁儀器廠;Zetasizer Nano ZS納米粒度分析儀 英國Malvern公司;XL-30掃描電子顯微鏡 荷蘭Philips公司。
1.2 方法
1.2.1 酪蛋白溶液的制備
取100mL乳品在4℃、4000r/min條件下離心30min,脫脂處理。棄上層脂肪,取下層蛋白溶液,稀釋至質(zhì)量濃度為80μg/mL的稀釋液。作為粒徑分析樣品或進(jìn)一步進(jìn)行掃描電子顯微鏡樣品處理,進(jìn)行掃描電子顯微鏡觀察。
1.2.2 納米粒度儀分析的方法
將樣品用0.02mol/L 磷酸鈉鹽緩沖溶液(pH6.8)溶解。溶液配制完成后,離心取上清液,用納米粒度儀測定溶液的粒徑分布。測定前先將樣品搖勻。樣品重復(fù)測量3次,最后取平均值。
1.2.3 掃描電子顯微鏡樣品處理方法
取5μL酪蛋白樣品,滴在潔凈的蓋玻片上,于自然條件下干燥;自然干燥后,在蓋玻片樣品上滴加50μL戊二醛,在4℃條件下固定3h;用濃度為0.1mol/L的磷酸緩沖液清洗3次,每次5min,分別用體積分?jǐn)?shù)50%、70%、90%和100%的乙醇進(jìn)行脫水,每次5min;用醋酸異戊酯對乙醇進(jìn)行置換,每次5min,共3次;CO2臨界點(diǎn)干燥后進(jìn)行電鏡觀察。
2 結(jié)果與分析
2.1 水牛乳酪蛋白的納米粒徑分布及膠束結(jié)構(gòu)
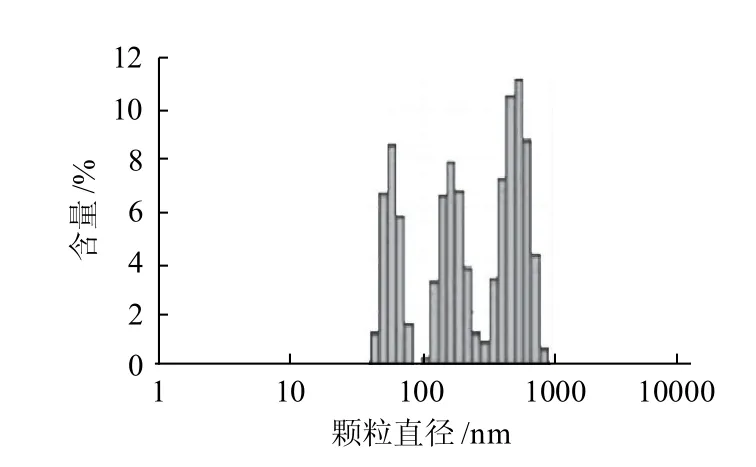
圖1 水牛乳酪蛋白納米粒徑分布圖Fig.1 Size distribution of casein from buffalo milk
由圖1可知,水牛乳酪蛋白直徑大小分布于43.8~825.0nm之間,主要包括43.8~78.8nm、105.7~255.0nm、342.0~825.0nm 3種不同顆粒直徑的組分,平均顆粒直徑為182.3nm。其中,以458.7~531.2nm之間的酪蛋白顆粒含量最多,占水牛乳酪蛋白總量的21.7%,而最大的酪蛋白顆粒直徑為825.0nm,含量占水牛乳酪蛋白的0.6%。

圖2 水牛乳酪蛋白膠束結(jié)構(gòu)掃描電子顯微鏡圖像(×40000)Fig.2 SEM image of the structure of casein micelle from buffalo milk (×40000)
由圖2可知,水牛乳中的酪蛋白顆粒互相連接成直徑較小的膠束狀,這些膠束多由單個的酪蛋白顆粒連接而成,直徑與單個酪蛋白的顆粒相差不大,約為180nm左右,而且這些膠束之間互相連接,形成較為致密的網(wǎng)絡(luò)狀結(jié)構(gòu)。
2.2 牛乳酪蛋白的納米粒徑分布及膠束結(jié)構(gòu)
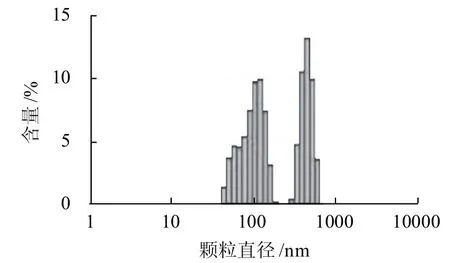
圖3 牛乳酪蛋白納米粒徑分布圖Fig.3 Size distribution of casein from milk
由圖3可知,牛乳酪蛋白直徑大小分布于43.8~615.1nm之間,主要包括43.8~190.1nm、295.3~615.1nm兩種不同顆粒直徑的組分,平均顆粒直徑達(dá)到207.4nm,大于水牛乳酪蛋白的平均顆粒直徑。其中,以396.1~531.2nm之間的酪蛋白顆粒最多,占牛乳酪蛋白總量的33.8%。最小的酪蛋白顆粒,直徑與牛乳的相同,均為43.8nm;而最大的酪蛋白顆粒直徑為615.1nm,明顯小于水牛乳酪蛋白的最大顆粒直徑,含量占牛乳酪蛋白的3.6%。

圖4 牛乳酪蛋白膠束結(jié)構(gòu)掃描電子顯微鏡圖像(×40000)Fig.4 SEM image of the structure of casein micelle from milk (×40000)
由圖4可知,牛乳中的酪蛋白顆粒聚集程度較高,大量的酪蛋白顆粒聚集成的酪蛋白膠束結(jié)構(gòu)比水牛乳中的酪蛋白膠束結(jié)構(gòu)更粗大,其直徑大小不均勻,約在300~600nm之間。而且這些酪蛋白之間交聯(lián)程度很低,無法形成較為致密的網(wǎng)絡(luò)狀結(jié)構(gòu)。
2.3 羊乳酪蛋白的納米粒徑分布及膠束結(jié)構(gòu)
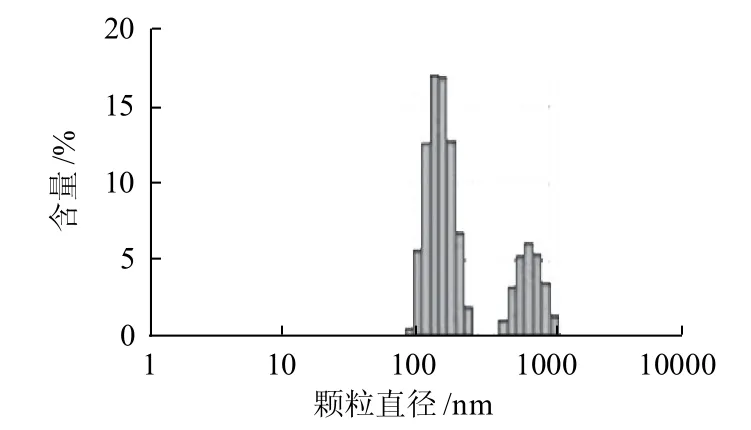
圖5 羊乳酪蛋白納米粒徑分布圖Fig.5 Size distribution of casein from goat milk
由圖5可知,羊乳酪蛋白直徑大小分布于91.3~1381.0nm之間,主要包括91.3~255.0nm、458.7~1381.0nm兩種不同顆粒直徑的組分,平均顆粒直徑為173.8nm,要小于水牛乳和牛乳的酪蛋白平均顆粒直徑。其中,以122.4~190.1nm之間的酪蛋白顆粒最多,占羊乳酪蛋白總量的59.0%。最小的酪蛋白顆粒直徑為91.3nm,明顯大于水牛乳和牛乳中的最小酪蛋白顆粒,其含量占羊乳酪蛋白的0.5%;最大的酪蛋白顆粒直徑為1381.0nm,也要明顯大于水牛乳和牛乳中的最大酪蛋白顆粒,其含量占羊乳酪蛋白的0.1%。

圖6 羊乳酪蛋白膠束結(jié)構(gòu)掃描電子顯微鏡圖像(×40000)Fig.6 SEM image of the structure of casein micelle from goat milk (×40000)
由圖6可知,大量表面光滑的酪蛋白顆粒,這些酪蛋白顆粒聚集程度遠(yuǎn)低于水牛乳和牛乳,僅能由數(shù)個酪蛋白顆粒連接形成較短的酪蛋白膠束結(jié)構(gòu),其直徑也約為一個酪蛋白顆粒的直徑。由于這些酪蛋白膠束非常短,所以無法交聯(lián)成網(wǎng)絡(luò)狀結(jié)構(gòu)。
3 結(jié) 論
通過納米粒度分析儀和掃描電子顯微鏡,對水牛乳、牛乳及羊乳中的酪蛋白顆粒直徑分布情況及其所形成的膠束結(jié)構(gòu)狀態(tài)進(jìn)行了比較全面、直觀的研究。首先對水牛乳、羊乳中酪蛋白顆粒直徑分布情況及其所形成的膠束結(jié)構(gòu)進(jìn)行研究,并發(fā)現(xiàn)了其與普通牛乳之間的差異性。研究表明,水牛乳、牛乳及羊乳中酪蛋白的粒徑分布及膠束結(jié)構(gòu)方面存在明顯的差異:在酪蛋白顆粒直徑方面,羊乳(173.8nm)<水牛乳(182.3nm) <牛乳(207.4nm);在膠束結(jié)構(gòu)方面,水牛乳酪蛋白顆粒互相連接成較細(xì)長的膠束,膠束之間能交聯(lián)成網(wǎng)絡(luò)狀結(jié)構(gòu),牛乳酪蛋白顆粒聚集程度最高,能行成直徑較大的膠束,但是無法交聯(lián)成網(wǎng)絡(luò)狀結(jié)構(gòu);羊乳酪蛋白顆粒聚集程度最低,僅能夠形成較短的膠束,也不能交聯(lián)成網(wǎng)絡(luò)。
水牛乳、牛乳及羊乳的酪蛋白在粒徑大小及膠束致密程度方面的差異,反映了他們聚集程度的差異性,聚集程度的差異在宏觀上就表現(xiàn)為乳凝塊的大小,而乳凝塊大小直接影響到它們在人體的消化吸收。有研究表明,相對于市場中較多的牛乳,羊乳在胃中所形成的乳凝塊較細(xì),更容易消化吸收[16],這與本研究的結(jié)果一致。本研究得到的關(guān)于水牛乳、牛乳及羊乳的粒徑大小及膠束致密程度的差異,反映了它們聚集程度的高低,可以直觀性地解釋不同乳品之間形成的乳凝塊大小及其對消化吸收的差異。
[1] FARRELL H M, JIMENEZ F. Nomenclature of the proteins of cow,s milk: sixth revision[J]. Journal of Dairy Science, 2004, 87: 1641-1674.
[2] MOITZI C, PORTNAYA I, GLATTER O, et al. Effect of temperature on self-assembly of bovineβ-casein above and below isoelectric pH. Structural analysis by cryogenic-transmission electron microscopy and small-angle X-ray scattering[J]. Langmuir, 2008, 24: 3020-3029.
[3] HUPPERTZ T, FOX P F, DEKRUIF K G, et al. High pressure-induced changes in bovine milk proteins: a review[J]. Biochimica Biophysica Acta, Proteins Proteomics, 2006, 3: 593-598.
[4] FARRELL H M J, MALIN E L. Casein micelle structure: what can be learned from milk synthesis and structural biology?[J]. Current Opinion in Colloid and Interface Science, 2006, 11(2/3): 135-147.
[5] HORNE D S. Casein micelle structure: models and muddles[J]. Current Opinion in Colloid and Interface Science, 2006, 11(2/3): 148-153.
[6] de KRUIF C G. Supra-aggregates of casein micelles as a prelude to coagulation[J]. Journal of Dairy Science, 1998, 81: 3019-3028.
[7] HOLT C. An equilibrium thermodynamic model of the sequestration of calcium phosphate by casein micelles and its application to the calculation of the partition of salts in milk[J]. European Biophysics Journal, 2004, 33: 421-434.
[8] HOLT C, TIMMINS P A, ERRINGTON N, et al. A core-shell model of calcium phosphate nanoclusters stabilized byβ-casein phosphopeptides, derived from sedimentation equilibrium and small-angle X-ray and neutronscattering measurements[J]. European Journal of Biochemistry, 1998, 252: 73-78.
[9] HOLT C, de KRUIF C G, TUINIER R, et al. Substructure of bovine casein micelles by small-angle X-ray and neutron scattering[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2003, 213: 275-284.
[10] MARCHIN S, PUTAUX J L, PIGNON F, et al. Effects of the environmental factors on the casein micelle structure studied by cryo-transmission electron microscopy and small-angle X-ray scattering/ultrasmallangle X-ray scattering[J]. Journal of Chemical Physics, 2007, 126, 045101: 10pages.
[11] MARCHIN G J O, WILIAMS R P W. Comparison of casein micelles in raw and reconstituted skim milk[J]. Journal of Dairy Science, 2007, 90: 4543-4551.
[12] MCMAHON D J, OOMMEN B S. Supra molecular structure of the casein micelle[J]. Journal of Dairy Science, 2008, 91: 1709-1721.
[13] 徐定人. 大力發(fā)展水牛奶加速我國奶業(yè)發(fā)展[J]. 中國乳業(yè), 2002(1): 6-8.
[14] 王雷, 丁春華, 欒爽艷. 我國水牛奶的發(fā)展現(xiàn)狀與開發(fā)前景[J]. 發(fā)展論壇, 2008(4): 8-11.
[15] BINNING G, QUATE C F, GERBER C. Atomic force microscope[J]. Phys Rev Lett, 1986, 56(4): 930-933.
[16] 邵國鋒, 蘭毅楠, 曲晟, 等. 羊奶與牛奶比較有何優(yōu)缺點(diǎn)[J]. 農(nóng)家之友, 2009(6): 75.
Differences in Particle Size and Structure of Casein Micelle from Different Milk Sources
LI Zi-chao,WANG Li-na,LI Yun-kai,XU Ming-fang*
(College of Life Science and Technology, Jinan University, Guangzhou 510632, China)
The particle distribution of casein and the structure of casein micelle from milk, buffalo milk and goat milk were studied by nanoparticle size analyzer and scanning electron microscopy, respectively. The results suggested that the size distribution of casein and the structure of casein micelle from milk, buffalo milk and goat milk were significantly different. The average casein particle diameter from buffalo milk was 182.3 nm. The connected casein particles formed slender micelles, and the micelles crosslinked into a network structure. The average casein particle diameter from milk was 207.4 nm, and the connected casein particles formed thick micelles. The average casein particle diameter from goat milk was 173.8 nm, and the connected casein particles formed short casein micelles but the micelles can not be cross-linked into a network structure.
nanoparticle size analyzer;scanning electron microscopy;casein;size;micelle structure
TS252.1
A
1002-6630(2012)05-0058-04
2011-02-23
廣東省科技計劃項(xiàng)目(2009B011300003)
李子超(1985—),男,碩士研究生,主要從事應(yīng)用微生物及微生物工程研究。E-mail:juvne@163.com
*通信作者:徐明芳(1962—),女,教授,博士,主要從事南方水牛乳的開發(fā)及應(yīng)用研究。E-mail:txmfxmf2006@126.com

