MMP-9及VEGF蛋白在膠質瘤中的表達及其臨床意義
王全懂 張蕾 楊聰穎
膠質細胞瘤約占顱內原發惡性腫瘤的40% ~50%,其不可控制的生長、較強的侵襲轉移能力等生物學特性致使腫瘤易復發,預后差。細胞外基質完整與否以及腫瘤組織的血管發生是腫瘤細胞侵襲、轉移的關鍵因素。基質金屬蛋白酶9(matrix metalloproteinase-9 MMP-9)在細胞外基質降解中發揮重要作用,血管內皮生長因子(vascular endothelial growth factor VEGF)在誘導血管發生中起關鍵作用。多項證據顯示二者在多種腫瘤細胞表達并與腫瘤細胞的侵襲、轉移密切相關。本研究采用免疫組織化學的法觀察MMP-9及VEGF在膠質瘤中的表達,并探討其臨床病理意義。
1 材料與方法
1.1 一般資料 標本選自我院病理科63例膠質瘤存檔蠟塊。術前未接受放療、化療。其中,星形細胞瘤46例,膠質母細胞瘤13例,少突膠質細胞瘤3例,混合細胞瘤1例,男性33例,女性30例;年齡5~70歲,平均年齡43.3歲。術后病理分級:Ⅰ級10例,Ⅰ~Ⅱ級7例,Ⅱ級13例,Ⅱ~Ⅲ級9例,Ⅲ級8例,Ⅲ~Ⅳ級2例,Ⅳ級14例。所有的病例術前均未進行放療和化療。為統計學方便,把Ⅰ級、Ⅰ~Ⅱ級、Ⅱ級歸類為高分化膠質瘤,Ⅱ~Ⅲ級、Ⅲ級、Ⅳ級歸類為低分化膠質瘤。
1.2 試劑與實驗方法 標本經福爾馬林固定、石蠟包埋后,組織作5 μm連續切片,行免疫組織化學ABC法染色。兔抗人MMP-9及VEGF蛋白多克隆抗體購自美國Santa Cruz生物技術公司,二抗、三抗購自北京中山生物技術有限公司,染色過程如下:將瘤組織石蠟切片脫蠟入水,0.3%的甲醇-雙氧水中10 min;分別將瘤組織切片浸入兔抗人MMP及VEGF抗體(1∶500 Santa Cruze)溶液中封閉;隨后依次進入生物素化IgG工作液(北京中山)和SABC三抗工作液(北京中山),室溫下各孵育2 h;辣根過氧化物酶標記的DAB將免疫產物顯為棕黃色;梯度乙醇脫水,二甲苯透明,中性樹膠封片。在孵育過程中用PBS溶液代替一抗做空白對照。
1.3 染色結果判斷 用光學顯微鏡觀察并確定MMP-9及VEGF免疫陽性產物分布部位。每份標本隨機取三張切片,每張切片隨機取三個高倍視野,計數每張切片MMP-9及VEGF陽性細胞數目并觀察染色強度,以腫瘤細胞胞漿、細胞間質及血管內皮細胞出現棕黃色顆粒為MMP-9、VEGF表達陽性。A:陽性細胞數<10%為記陰性(-),不論其染色深淺;陽性細胞數11% ~50%為2分;陽性細胞數為50% ~80%為3分;陽性細胞數80%以上為4分。B:染色強度呈弱染色(淺黃色)為1分,中等染色(棕黃色)為2分,強染色(黃褐色)為3分。A+B為總分,總分為3分者為弱陽性,4~5分者為中等陽性,6~7分者為強陽性。為統計學處理方便并將(-)、(+)歸為陰性處理,(++)、(+++)歸為陽性處理。
1.4 統計學方法 運用SPSS 11.5對數據進行χ2檢驗,相關性分析采用Spearman等級相關分析,P<0.05為差異有統計學意義。
2 結果
2.1 MMP-9在膠質瘤組織中的表達 MMP-9陽性表達48例,總的陽性率48/63=76.19%,胞漿及細胞外基質均可見MMP-9蛋白的陽性表達。其中高分化(惡性程度低)MMP-9表達呈弱陽性,陽性產物主要分布細胞間質內,陽性率為19/30例(占63.33%);低分化(惡性程度高)者33例,MMP-9表達呈強陽性,陽性產物在密集分布胞漿及細胞間質內。陽性率29/33例(占87.87%),兩者差別具有統計學意義(P=0.037)。(見圖1,表1)
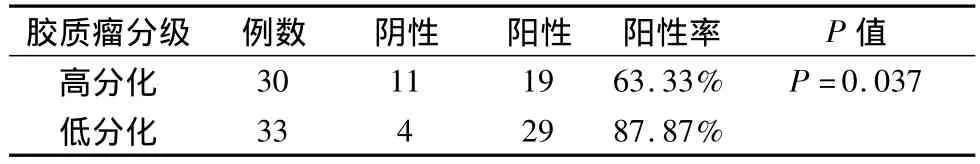
表1 MMP-9在低分化組與高分化組表達陽性率的比較(例,%)
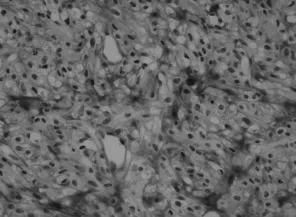
圖1 MMP-9在膠質瘤組織中的表達400
2.2 VEGF在膠質瘤組織中的表達 VEGF陽性表達47例,總的陽性率47/63=74.76%,VEGF蛋白的陽性主要分布與膠質瘤血管內皮細胞。其中高分化(惡性程度低)VEGF表達呈弱陽性,陽性率為17/30例(占56.67%),低分化(惡性程度高)者33例,VEGF表達呈強陽性,陽性率,30(占90.90%),兩者差別具有統計學意義(P=0.003)。(見圖2,表2)
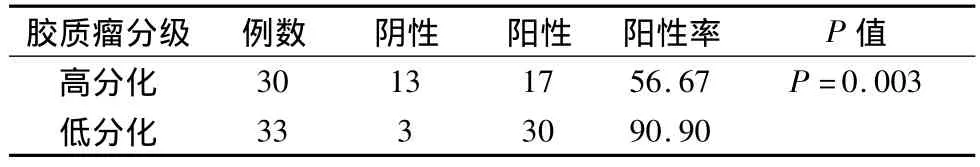
表2 VEGF在低分化組與高分化組表達陽性率的比較(例,%)
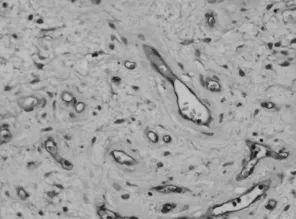
圖2 VEGF在膠質瘤組織中的表達400×
2.3 MMP-9與VEGF表達的相關性 63例中MMP-9與VEGF均陽性表達41例,MMP-9陽性的腫瘤組織VEGF也趨于陽性表達,相關性分析r's=0.3136 P<0.05,提示MMP-9與VEGF表達呈正相關。
3 討論
膠質細胞瘤是中樞神經系統最常見的原發性惡性腫瘤,研究顯示盡管手術結合放化療等相關治療手段的不斷提高,其中位生存期不超過12個月,侵襲性生長、易復發、預后差為其主要臨床特征。近年來的研究顯示細胞外基質降解及腫瘤血管發生是腫瘤侵襲轉移的關鍵環節。
基質金屬蛋白是一類Zn+依賴性內肽酶,具有降解各種細胞外基質的作用,其中MMP-9又稱凝膠酶B,是基質金屬蛋白酶MMPs家族成員之一,其在胚胎發育,細胞增殖及組織重塑等正常的生理過程中發揮重要作用。由于其高效降解Ⅳ、Ⅴ膠原纖維,故可通過破壞腫瘤組織周圍的物理屏障促進腫瘤細胞的侵潤及轉移[1,2]。多項研究顯示MMP-9在結腸癌、胃癌、胰腺癌、乳腺癌及口腔癌等多種惡性實體瘤內呈高表達,并證實與腫瘤的轉移相關[3-7]。本研究顯示在不同級別膠質瘤中MMP-9表達強度不同,在高分化膠質瘤(惡性程度低)MMP-9表達呈弱陽性,主要分布于胞漿內及細胞間質;低分化(惡性程度高)的瘤組織中MMP-9表達呈強陽性,陽性產物在瘤體內密集分布,染色濃重;且MMP-9在低分化瘤體中陽性表達率顯著高于高分化瘤體。同樣Rao JS和Rooprai HK的研究顯示MMP-9表達與神經膠質細胞瘤組織學分級密切相關[8,9],這與本研究結果具有一致性,提示MMP-9表達與腫瘤組織的惡性表型相關。另有研究顯示MMP-9 mRNA表達水平與膠質瘤進展呈正相關,且在腦膠質瘤的侵潤、轉移及血管再生方面發揮重要作用,干擾MMP-9表達可降低膠質瘤細胞的侵襲、腫瘤生長、和血管生成[10,11]。細胞試驗顯示抑制MMP-9表達可抑制腫瘤細胞的連接與生長[12,13],其機制可能通過(ERK):PKCα/NF-κB 信號通路完成[14,15]。上述多項研究結果提示MMP-9可能成為預測膠質瘤惡性程及侵襲轉移的生物學探針。
腫瘤的浸潤生長及轉移有賴于腫瘤組織血管的形成,腫瘤組織血管生成受多因素調控,有多種細胞因子及信號通路的參與,如堿性成纖維細胞生長因子,血小板源性生長因子,轉化生長因子等,其中VEGF在血管發生過程中起關鍵作用,其機制可能通過分子變構及酶加工形成多種亞型,與細胞外基質中的乙酰肝素及細胞表面蛋白結合,釋放血管源性因子,精確調控內皮細胞生長及血管生成,并且可增加血管的通透性,從而為血管內皮細胞和腫瘤細胞的轉移提供結構基礎。目前抗VEGF及其受體已成為腫瘤治療的新的靶點和新策略。本研究顯示VEGF在膠質瘤中的陽性表達主要位于血管內皮細胞,少量位于細胞間質,在不同級別膠質瘤中有不同程度的表達,隨著膠質瘤的級別愈高其表達強度愈高,差異具有顯著性,同時在低級別膠質瘤中陽性表達率與高級別陽性表達率相比差異具有統計學意義,提示其表達陽性率及表達強度與膠質瘤惡性程度密切相關。
在本研究中MMP-9陽性表達主要彌散存在于膠質瘤細胞的胞漿、細胞間質內;VEGF蛋白表達于血管的內皮細胞,未見到明顯的邊緣效應,MMP-9及VEGF蛋白在腦膠質瘤中表達上調,并且腦膠質瘤分級越高,分化越差,MMP-9及VEGF蛋白表達越強,提示MMP-9及VEGF蛋白表達與腦膠質瘤的惡性程度相關。提示聯合檢測MMP-9及VEGF蛋白可作為判斷膠質細胞瘤侵襲轉移能力的客觀指標,對膠質瘤的預后判斷具有一定意義。
[1]Fridman R,Toth M,Pena D,et al.Activation of progelatinase B(MMP-9)by gelatinase A(MMP-2)Cancer Res.1995;55(12):2548-2555.
[2]陳國華.基質金屬蛋白酶及其抑制物與腫瘤侵襲和轉移的關系.國外醫學:腫瘤學分冊,2001,28(1):23-25.
[3]Lin LF,Chuang CH,Li CF,et al.ZBRKl acts as a metastatic suppressor by directly regulating MMP-9 in cervical cancer.Cancer Res,2010,70(1):192-201.
[4]Bendardaf R,Buhmeida A,Hilska M,et al.MMP-9(gelatinase B)expression is associated with disease-free survival and diseasespecific survival in colorectal cancer patients.Cancer Invest,2010,28(1):38-43.
[5]Zhao ZS,Wang YY,Ye ZY,et al.Prognostic value of tumor-related molecular expression in gastric carcinoma.Pathol Oncol Res,2009,15(4):589-596.
[6]Tian M,Cui YZ,Song GH,et al.Proteomic analysis identifies MMP-9,DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients.BMC Cancer,2008,8:241.
[7]Provatopoulou X,Gounaris A,Kalogera E,et al.Circulating levels of matrix metalloproteinase-9(MMP-9),World J Gastroenterol,2010,16(12):1500-1505.
[8]Gessi S,Sacchetto V,Fogli E,et al.Modulation of metalloproteinase-9 in U87MG glioblastoma cells by A3 adenosine receptors.Biochem Pharmacol,2010,79:1483-1495.
[9]Rao JS,Steck PA,Mohanam S,et al.Elevated levels of M(r)92,000 type IV collagenase in human brain tumors.Cancer Res,1993,53:2208-2211.
[10]Komatsu,Y.Nakanishi,N.Nemoto,et al.Expression and quantitative analysis of matrix metalloproteinase-2 and-9 in human gliomas.Brain Tumor Pathology,2004,21(3):105-112.
[11]Lakka SS,Gondi CS,Yanamandra N,et al.Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion,tumor growth and angiogenesis.Oncogene,2004,23:4681-4689.
[12]Lakka SS,Gondi CS,Dinh DH,et al.Specific interference of urokinase-type plasminogen activator receptor and matrix metalloproteinase-9 gene expression induced by double-stranded RNA results in decreased invasion,tumor growth,and angiogenesis in gliomas.J Biol Chem,2005,280:21882-21892.
[13]Gabelloni P,Da Pozzo E,Bendinelli S,et al.Martini C.Inhibition of metalloproteinases derived from tumours:new insights in the treatment of human glioblastoma.Neuroscience,2010,168:514-522.
[14]Lakka SS,Jasti SL,Kyritsis AP,et al.Regulation of MMP-9(type IV collagenase)production and invasiveness in gliomas by the extracellular signal-regulated kinase and jun amino-terminal kinase signaling cascades. Clin Exp Metastasis,2000,18:245-252.
[15]Lin CW,Shen SC,Chien CC,et al.12-O-tetradecanoylphorbol-13-acetate-induced invasion/migration of glioblastoma cells through activating PKCalpha/ERK/NF-kappaB dependent MMP-9 expression.J Cell Physiol,2010,225:472-481.

