胰腺癌細胞株PANC1異常甲基化miRNA的分析
彭泉 張立潔 蔡輝華 高文濤 趙成功 錢祝銀 苗毅
·論著·
胰腺癌細胞株PANC1異常甲基化miRNA的分析
彭泉 張立潔 蔡輝華 高文濤 趙成功 錢祝銀 苗毅
目的分析胰腺癌細胞株PANC1與正常胰腺組織表達有差異的啟動子區甲基化miRNA,尋找與胰腺癌相關的高甲基化miRNA。方法抽提PANC1與正常胰腺組織基因組DNA,超聲斷裂。應用抗5-甲基化嘧啶核苷抗體和免疫磁珠法獲取甲基化DNA片段。通過DNA甲基化芯片篩選出PANC1與正常胰腺組織表達差異的高甲基化miRNA,采用重亞硫酸鹽修飾的PCR(BSP)和TA克隆測序的方法進行驗證。提取胰腺癌細胞株BxPC3、CFPAC1、PANC1、SW1990基因組DNA,采用結合重亞硫酸鹽的限制性內切酶法(combined bisulfite restriction analysis,COBRA)驗證芯片篩選出的差異表達的甲基化miRNA。結果PANC1細胞與正常胰腺組織存在8個差異表達的甲基化miRNA,從中挑選出5個進行BSP+TA克隆測序驗證,其中miR-615、miR-663、miR-663b在PANC1細胞的甲基化率明顯高于正常組織(60.6%比7.6%,88.8%比22.2%,94.4%比13.0%);miR-675的甲基化率與正常胰腺組織無明顯差異(76.0%比100%);miR1826因測序結果誤差較大而舍去。經COBRA驗證,PANC1的上述4種miRNA均高甲基化;BxPC除miR-675外,其他3種均高甲基化;CFPAC1的miR-663、miR-663b高甲基化;SW1990的miR-615、miR-663高甲基化。結論胰腺癌細胞株與正常胰腺組織間存在差異表達的高甲基化miRNA,其中miR-663高甲基化與胰腺癌可能相關。
胰腺腫瘤; DNA甲基化; 微RNAs; TA克隆
DNA甲基化(DNA methylation)是最早被發現的表觀遺傳學改變途徑之一。位于啟動子區的CpG島甲基化通常會導致基因表達沉默,是許多腫瘤發生中一個頻發的早期事件。微小RNA(miRNAs)是重要的轉錄后調節機制[1],在腫瘤中表達異常,并且調節信號轉導、細胞增殖、凋亡等重要生物學過程。自Saito等[2]在2006年首次報道miRNA-127受到DNA甲基化調控起抑癌基因作用以來,miRNA的啟動子高甲基化導致其表達下調的報道增多[3-7]。本研究旨在尋找胰腺癌相關的異常甲基化的miRNA,以期對胰腺癌的診斷和治療發揮推動作用。
材料與方法
一、材料
胰腺癌細胞株PANC1、BxPC3、CFPAC1、SW1990均購自上海細胞庫,常規培養、傳代,取對數生長期細胞。3例正常胰腺組織取自意外死亡者,均獲得家屬同意,并簽署知情書。
二、DNA甲基化芯片分析
應用DNA提取試劑盒(Omega公司)抽提胰腺癌細胞株PANC1與正常胰腺組織基因組DNA,超聲打斷成400~500 bp的DNA片段,加熱變性為單鏈DNA。部分單鏈DNA樣品中加入抗5-甲基化胞嘧啶核苷抗體,使用免疫磁珠法分離甲基化的DNA片段。將甲基化DNA樣本及未處理的DNA片段樣本分別進行擴增,熒光標記,標記后將兩樣本混合、變性、與上海康成生物公司提供的甲基化DNA微陣列芯片雜交,用高解析度芯片掃描儀檢測雜交信號,對結果進行數據分析。
三、重亞硫酸鹽修飾的PCR(BSP)和TA克隆測序
對PANC1和正常胰腺組織的基因組DNA進行重亞硫酸鹽處理,使未甲基化的胞嘧啶轉化成胸腺嘧啶,而甲基化的胞嘧啶不變。亞硫酸氫鹽修飾過程見文獻[8]。以重亞硫酸鹽處理后的DNA作為模板,采用Touchdown-PCR方法擴增。引物由Invitrogen公司設計并合成。引物盡量設計位于miRNA發夾序列的上游500 bp之內[9],miRNA引物序列及與相鄰CpG位置、擴增范圍見表1和圖1。擴增產物經電泳分離,回收、純化。純化的擴增產物行TA克隆。挑選6個陽性單克隆菌落的菌液行PCR,并送Invitrogen公司測序。

表1 miRNA引物序列及擴增位置
注:+:表示在發夾序列上游,-:表示在下游
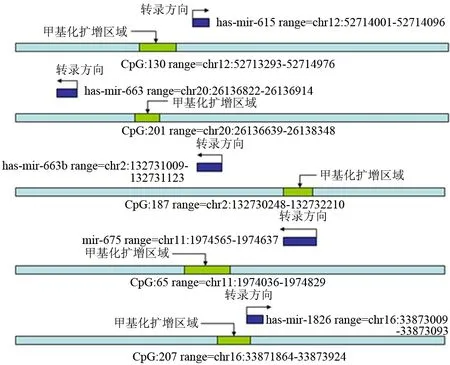
圖1UCSC數據庫上miRNA與相鄰CpG島位置及BSP擴增范圍
四、結合重亞硫酸鹽的限制性內切酶法(combined bisulfite restriction analysis,COBRA)
提取胰腺癌細胞株BXPC3、CFPAC1、PANC1、SW1990基因組DNA,行BSP,應用內切酶對PCR產物進行酶切。酶切8 h后以2%瓊脂糖凝膠電泳分離PCR產物,伊文思蘭(EB)染色,成像。
結 果
一、DNA甲基化芯片分析結果
芯片分析公司提供序列上游2000 bp范圍內覆蓋10個以上探針的miRNA共52個,其中PANC1細胞株與正常胰腺組織甲基化程度差異明顯的miRNA共8個,分別為miR-483、miR-574、miR-615、miR-663、miR-663b、miR-675、miR-1247、miR-1258、miR-1826(圖2)。

圖2在PANC1和正常胰腺組織差異表達的甲基化miRNA(綠色部分)
二、BSP+TA克隆測序結果
隨機挑選5個miRNA(miR-615、miR-663、miR-663b、miR-675、miR-1826)進行BSP。PCR反應:95℃ 5 min,94℃ 30 s、68℃ 30 s、72℃ 30 s,2個循環;95℃ 5 min,94℃ 30 s、66℃ 30 s、72℃ 30 s,3個循環;95℃ 5 min,94℃ 30 s、64℃ 30 s、72℃ 30 s,4個循環;95℃ 5 min,94℃ 30 s、62℃ 30 s、72℃ 30 s,35個循環,均獲得目的條帶(圖3)。TA克隆陽性菌液測序結果見圖4。miR-615、miR-663、miR-663b在PANC1中的甲基化率明顯高于正常組織(60.6%比7.6%,88.8%比22.2%,94.4%比13.0%);miR-675在PANC1和正常胰腺組織中的甲基化率無明顯差異(76.0%比100%);miR-1826因測序結果誤差大而舍去。
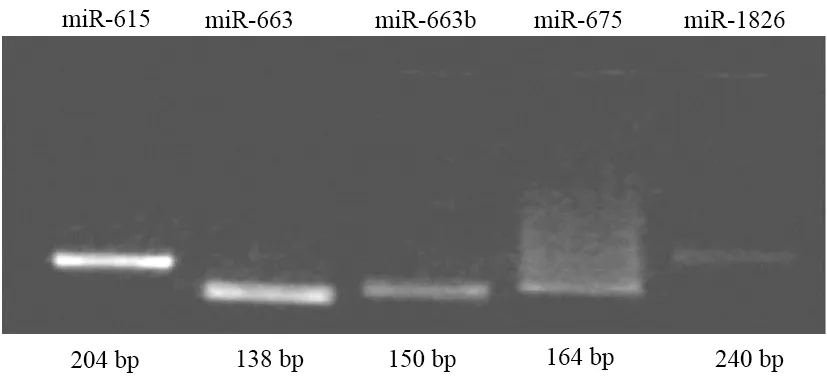
圖3 5個miRNA的 BSP產物電泳圖
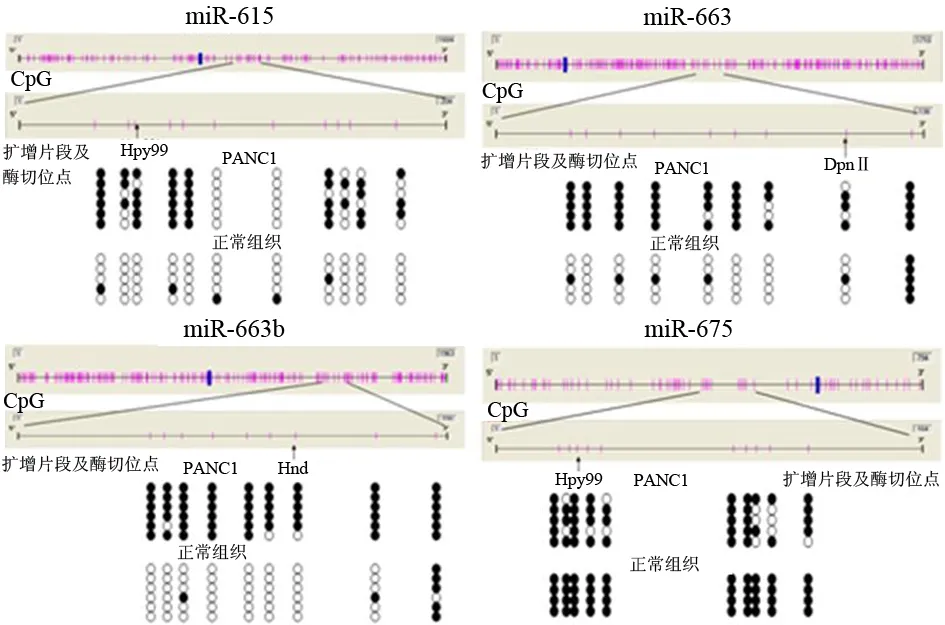
圖4miR-615、miR-663、miR-663b、miR-675經TA克隆后測序結果 實心圓:甲基化的CpG島;空心圓:未發生甲基化的CpG島
三、COBRA驗證結果
PANC1的上述4種miRNA均高甲基化;BxPC3除miR-675外,其他3種均高甲基化;CFPAC1的miR-665、miR-663b高甲基化;SW1990的miR-615、miR-663高甲基化(圖5)。
討 論
miRNA是21~25 nt長的單鏈小分子RNA,廣泛存在于真核生物中。miRNA參與生命過程中一系列的重要進程,包括早期胚胎發育、細胞分化、增殖和凋亡等,其中的一些miRNA可以調控正常細胞周期和終末分化,如發生突變可導致細胞增殖和凋亡異常。近年來專家們對與腫瘤相關的miRNA的研究取得不少新進展。Chen等[10]發現,miR-17-192與miR-155在鼻咽癌中表達上調;miR-34、miR-143和miR-145的表達則顯著下調。這些表達下調的miRNA與多種生物學途徑相關,如TGF-Wnt途徑、VEGF信號轉導通路和IP3信號轉導通路等。此外,在包括胰腺癌在內的多種腫瘤組織中亦發現多種miRNA的表達和功能異常[11-14]。Lu等[15]還證明miRNA的表達特征能用于劃分人類癌癥以及區別正常細胞和癌細胞,表明miRNA的活動模式還能夠被用于診斷癌癥。2009年Rabinowits等[16]的研究已指出,miRNA可以用來對肺癌進行篩選。
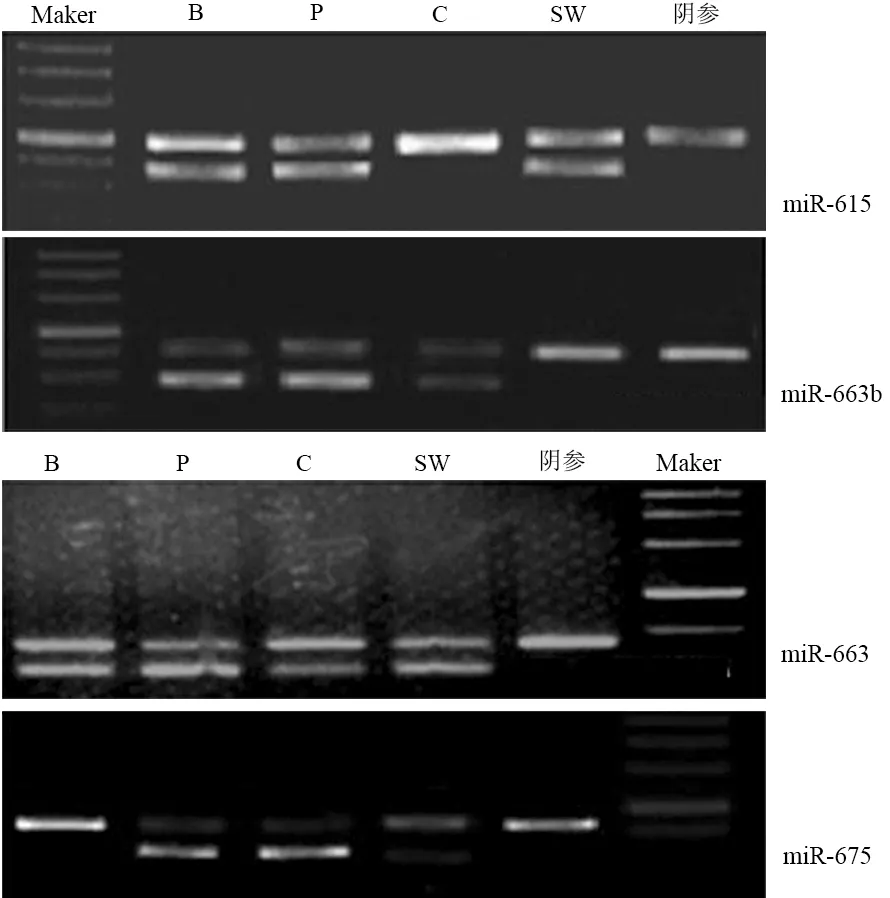
B:BxPC1;P:PANC1;C:CFPAC1;SW:SW1990
圖54個miRNA在胰腺癌細胞株中的甲基化狀況
目前,對miRNA發生異常表達的調控機制研究尚處于初級階段,但已有研究證實miRNA受多種因素調控,例如染色質結構異常、miRNA加工受損等。近幾年有多篇報道指出,啟動子區的甲基化程度會影響miRNA的表達水平,表明DNA甲基化異常也是miRNA表達異常的重要機制之一[3-7]。
本實驗通過甲基化芯片篩選出52個miRNA,選取其中5個進行TA 克隆驗證,發現miR-615、miR-663、miR-663b在胰腺癌細胞株PANC1中存在高甲基化,并通過BxPC3、CFPAC1、SW1990胰腺癌細胞驗證,只有miR-663在4株胰腺癌細胞中均為高甲基化,它可能是胰腺癌相關的特異性的高甲基化miRNA。當然,這還有待于在大樣本的胰腺癌組織標本中進行驗證。
[1] Croce CM, Calin GA. miRNAs, cancer, and stem cell division. Cell,2005,122:6-7.
[2] Saito Y, Liang G, Egger G, et al. Specific activation of microRNA-127 with downregulation of the proto-oncogene BCL6 by chromatin-modifying drugs in human cancer cells. Cancer Cell, 2006,9:435-443.
[3] Datta J, Kutay H, Nasser MW, et al.Methylation mediated silencing of MicroRNA-1 gene and its role in hepatocellular carcinogenesis. Cancer Res,2008,68:5049-5058.
[4] Toyota M, Suzuki H, Sasaki Y, et al.Epigenetic silencing of microRNA-34b/c and B-cell translocation gene 4 is associated with CpG island methylation in colorectal cancer. Cancer Res,2008,68:4123-4132.
[5] Grady WM, Parkin RK, Mitchell PS, et al.Epigenetic silencing of the intronic microRNA hsa-miR-342 and its host gene EVL in colorectal cancer. Oncogene, 2008,27:3880-3888.
[6] Lehmann U, Hasemeier B, Christgen M, et al.Epigenetic inactivation of microRNA gene hsa-mir-9-1 in human breast cancer. J Pathol,2008,214:17-24.
[7] Meng F, Wehbe-Janek H, Henson R, et al.Epigenetic regulation of microRNA-370 by interleukin-6 in malignant human cholangiocytes. Oncogene,2008,27:378-386.
[8] Herman JG, Graff JR, My?h?nen S, et al. Methylation specific PCR: A novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci USA,1996,93:9821-9826.
[9] Tost J, Gut IG. DNA methylation analysis by pyrosequencing.Nat Protoc, 2007,2:2265-2275.
[10] Chen HC, Chen GH, Chen YH, et al. MicroRNA deregulation and pathway alterations in nasopharyngeal carcinoma. Br J Cancer,2009,100:1002-1011.
[11] Tam W, Dzhlberg JE.miR-155/BIC as an oncogenic microRNA.Genes Chromosomes Cancer,2006,45:211-212.
[12] Hiyoshi Y, Kamohara H, Karashima R, et al. MicroRNA-21 regulates the proliferation and invasion in esophageal squamous cell carcinoma.Clin Cancer Res,2009,15:1915-1922.
[13] Liu X, Sempere LF, Galimberti F, et al. Uncovering growth-suppressive MicroRNAs in lung cancer. Clin Cancer Res,2009,15:1177-1183.
[14] Yamakuchi M, Lowenstein CJ. MiR-34, SIRT1 and p53: the feedback loop. Cell Cycle,2009,8:712-715.
[15] Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers. Nature,2005,435:834-838.
[16] Rabinowits G, Ger?el-Taylor C, Day JM, et al. Exosomal microRNA: a diagnostic marker for lung cancer.Clin Lung Cancer,2009,10:42-46.
AbnormalmethylationofmiRNAinpancreaticcancercelllinePANC1
PENGQuan,ZHANGLi-jie,CAIHui-hua,GAOWen-tao,ZHAOCheng-gong,QIANZhu-yin,MIAOYi.
DepartmentofGeneralSurgery,The105thCentralHospitalofPeople′sLiberationArmy,Hefei230032,China
QIANZhu-yin,Email:qianzhusilver@163.com
ObjectiveTo investigate the methylation of the promoter region in miRNA in pancreatic cancer cell line PANC1 and normal pancreatic tissue, to discover the miRNA with hypermethylation associated with pancreatic cancer.MethodsThe genomic DNA of PANC1 and normal pancreatic tissue was extracted, and fractured by ultrasound. Methylation DNA fragments were obtained by 5-methyl of pyrimidine nucleoside antibodies and immunomagnetic beads. The hypermethylation miRNA differentially expressed between PANC1 and normal pancreatic tissue was selected by using methylation DNA chip. BSP (bisulfite genomic sequencing PCR) and TA clone sequencing was performed for further validation. The genomic DNA of pancreatic cancer cell lines BXPC3, CFPAC1, PANC1 and SW1990 was extracted. The COBRA (combined bisulfite restriction analysis) was used to validate differentially expressed hypermethylation miRNA.ResultsEight differentially expressed hypermethylation miRNAs were screened from the DNA methylation chips, then five of them were selected for sequencing. The methylation status of miRNA-615,-663,-663b was significantly higher in the PANC1 than in normal tissues (60.6%vs7.6%, 88.8%vs22.2%, 94.4%vs13.0%); the methylation status of miRNA-675 was not significantly different between PANC1 and normal pancreatic tissue (76.0%vs100%). Due to large error in sequencing, miRNA1826 was excluded. The results of COBRA confirmed all the 4 miRNAs were highly methylated in PANC1; except for miRNA-675, other 3 miRNAs were highly methylated in BxPC,miRNA-663, miRNA-663b were highly methylated in CFPAC1, while miRNA-615, miRNA-663 were highly methylated in SW1990.ConclusionsHypermethylation miRNAs were differentially expressed between pancreatic cancer cell lines and normal pancreatic tissue, among them, highly methylated miRNA-663 was possibly associated with pancreatic cancer.
Pancreatic neoplasms; DNA methylation; miRNA; TA cloning
10.3760/cma.j.issn.1674-1935.2012.01.004
江蘇省自然科學基金(BK2006241);人事部留學回國人員基因(303070460IA10)
230032 安徽合肥,解放軍第105醫院普外科(彭泉、趙成功),腫瘤科(張立潔);南京醫科大學第一附屬醫院普外科(蔡輝華、高文濤、錢祝銀、苗毅)
錢祝銀,Email:qianzhusilver@163.com
2011-04-06)
(本文編輯:屠振興)

