Smad7反義寡核苷酸對人胰腺癌SW1990細胞MMP-2和TIMP-2表達及細胞增殖的影響
于鴻 黃俊星 王朝夫 施達仁
·論著·
Smad7反義寡核苷酸對人胰腺癌SW1990細胞MMP-2和TIMP-2表達及細胞增殖的影響
于鴻 黃俊星 王朝夫 施達仁
目的研究Smad7反義寡核苷酸(ASODN)轉染后人胰腺癌SW1990細胞基質金屬蛋白酶-2(MMP-2)和基質金屬蛋白酶組織抑制因子-2(TIMP-2)表達及細胞增殖的變化,探討Smad7在胰腺癌發生、發展中的作用機制。方法經脂質體介導將Smad7 ASODN轉染人胰腺癌細胞株SW1990。以無義寡核苷酸(NSODN)轉染、單加ASODN、單加脂質體作為對照。熒光顯微鏡及流式細胞儀檢測轉染效率; RT-PCR、蛋白質印跡法檢測轉染細胞Smad7、MMP-2和TIMP-2表達;噻唑藍(MTT)比色法檢測轉染細胞的增殖。結果Smad7 ASODN轉染SW1990細胞的轉染效率為81.2%,轉染24 h后,轉染組、ASODN組和脂質體組細胞Smad7 mRNA表達量分別為0.34±0.06、0.95±0.07、1.03±0.11;MMP-2 mRNA表達量為0.54±0.08、1.15±0.13、1.27±0.16; TIMP-2 mRNA表達量為0.26±0.07、0.72±0.13、0.78±0.17;Smad7蛋白表達量為0.14±0.03、0.29±0.05、0.28±0.07; MMP-2蛋白表達量為0.17±0.02、0.29±0.05、0.31±0.04;TIMP-2蛋白表達量為0.20±0.03、0.41±0.11、0.43±0.09。轉染組均較其他各組的表達顯著減少(P值均<0.01)。轉染組、ASODN組、脂質體組細胞的增殖活性分別為0.83±0.03、1.02±0.02、0.99±0.02,轉染組細胞的增殖活性較其他各組顯著被抑制(P值均<0.01)。結論Smad7 ASODN轉染可有效抑制SW1990細胞Smad7基因的表達,并抑制MMP-2、TIMP-2表達及細胞增殖活性。
胰腺腫瘤; Smad7; 反義寡核苷酸; 基質金屬蛋白酶-2; 基質金屬蛋白酶組織抑制因子-2; 細胞增殖
研究表明,TGF-β/Samds信號轉導通路的異常在胰腺癌的發生、發展過程中具有重要作用。半數以上的胰腺癌有TGF-β/Samds信號通路異常,其發生機制主要包括Samds基因家族突變和表達異常,也涉及TGF-β超家族及其受體的改變[1]。然而,作為TGF-β/Samds信號通路的負調控因子Smad7基因在胰腺癌發生、發展中的作用研究甚少。本實驗將Smad7反義寡核苷酸(ASODN)轉染胰腺癌細胞株SW1990,觀察轉染后細胞基質金屬蛋白酶-2(MMP-2)及基質金屬蛋白酶組織抑制因子-2(tissue inhibitor of metalloproteinase-2,TIMP-2)表達及細胞增殖的變化,進一步闡明Smad7在胰腺癌侵襲和轉移中的作用。
材料和方法
一、細胞培養及轉染
人胰腺癌細胞株SW1990由復旦大學附屬腫瘤醫院中西醫結合科劉魯明教授饋贈,常規培養、傳代。取對數生長期細胞,以5×105個/孔密度接種于6孔板。待細胞生長至60%~70%融合時,采用脂質體法將Smad7 ASODN、無義寡核苷酸(NSODN)轉染SW1990細胞。ASODN序列為5′-AAGATAATTCGTTCCCCCTGTCCTGTCTC-3′,NSODN序列為5′-CATTTCTTGCTCTCCACGTGGTGTAGACA-3′,首尾3個磷酸鍵硫化修飾,5′端標記異硫氰酸熒光素(FITC),均由上海生工有限公司合成,Lipofectamine 2000轉染試劑盒購自Invitrogen公司,按說明書操作。以單加ASODN、單加脂質體、單加培養液作為對照。轉染24 h后收集各組細胞,部分行細胞爬片后甲醛固定,熒光顯微鏡下觀察細胞內帶熒光的ASODN的分布。部分細胞重懸后用流式細胞儀檢測轉染效率。
二、Smad7、MMP-2、TIMP-2 mRNA及蛋白檢測
取轉染24、48 h細胞,用Trizol抽提總RNA,應用Advantage cDNA PCR試劑盒(Gibco公司)行RT-PCR。Smad7序列上游5′-CCCATCTTCATCAAGTCCG-3′,下游5′-GCTGTAGGCTTTCTCATAGTCA-3′,擴增片段335 bp;MMP-2上游5′-CTCAGCGGCTCATGGTCC-GGCC-3′,下游5′-CATGGTCCGGCCCCCGCCCCCA-3′,擴增片段278 bp;TIMP-2上游5′-CTGTCC-CCTCBCCTCTTCGC-3′,下游5′-TCCACCTCCTTC-TCGCTCACTG-3′,擴增片段303 bp;內參GAPDH上游5′-ACCACAGTCCATGCCATG-CCATCAC-3′,下游5′-CCACCACCCTGTTGCTGTAG-3′,擴增片段450 bp,均由上海英駿生物技術有限公司合成。PCR反應條件:94℃ 5或7 min,94℃ 30 s、60℃ 30 s、72℃ 1 min,共33個循環。擴增產物經瓊脂糖凝膠電泳分離,Kodak Digital Science 1D掃描,以目的條帶與內參條帶的灰度比值表示mRNA表達量。
取各組標本,按本實驗室方法提取蛋白[2],常規行蛋白質印跡法。以β-actin為內參。兔抗人Smad7、鼠抗人MMP-2及TIMP-2多抗均購于DAKO公司。以目的條帶與內參條帶的灰度比值表示蛋白表達量。
三、細胞增殖活性檢測
取各組指數生長期細胞,以1×104個細胞數接種于96孔板中,每組6個復孔。培養24、48、72 h后分別每孔加入噻唑藍(MTT,5 mg/ml)20 μl再培養4 h,加入150 μl二甲基亞砜(DMSO)震蕩10 min,測各孔490 nm處吸光值(A),取均值。
四、統計學分析

結 果
一、轉染效率
轉染24 h后,轉染組細胞內可見大量綠色熒光,呈離散型、點狀分布,轉染效率為81.2%;ASODN組僅少量細胞見微弱熒光,轉染效率為3.1%;NSODN組及脂質體組細胞內均未見熒光(圖1),故以下實驗數據省略NSODN組。

圖1轉染組(a)、ASODN組(b)、脂質體組(c)轉染效率 上圖:熒光顯微鏡檢(×200) 下圖:流式細胞儀檢測
二、細胞Smad7 mRNA及蛋白表達
轉染組細胞Smad7 mRNA及蛋白表達均顯著低于ASODN組,但轉染24 h和48 h組間差異無統計學意義;ASODN組和脂質體組間差異無統計學意義(圖2,表1)。
圖2各組細胞的Smad7 mRNA(上)及蛋白(下)表達
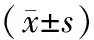
表1 各組細胞Smad7 mRNA及蛋白表達的變化
注:轉染24、48 h組與ASODN組比較,t值分別為:24.287、 16.572、13.141、15.833,aP<0.05
三、細胞MMP-2、TIMP mRNA及蛋白表達
轉染24 h組細胞MMP-2、TIMP mRNA及蛋白表達均顯著低于ASODN組,ASODN組和脂質體組間差異無統計學意義(表2,圖3、4)。
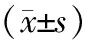

組 別MMP?2mRNAMMP?2蛋白轉染24h組0.54±0.08a0.17±0.02aASODN組1.15±0.130.29±0.05脂質體組1.27±0.160.31±0.04組 別TIMP?2mRNATIMP?2蛋白轉染24h組0.26±0.07a0.20±0.03aASODN組0.72±0.130.41±0.11脂質體組0.78±0.170.43±0.09
注:轉染24 h組與ASODN組比較,t值分別為11.308、7.262、 18.733、10.465,aP<0.05

圖3 各組細胞MMP2 mRNA(上)及蛋白(下)表達
四、細胞增殖活性
轉染24、48、72 h后,細胞的增殖活性均較ASODN組降低,以轉染后24 h最為明顯,ASODN組和脂質體組間差異無統計學意義(表3)。

表3 各組細胞的增殖活性(A490值
注:轉染組與ASODN組比較,t值分別為9.832、9.758、9.549,aP<0.05
討 論
TGF-β信號轉導通路是由TGF-β超家族、TGF-β受體、Smad蛋白家族及其核內轉錄調節因子組成的腫瘤抑制通路,該通路的異常可使細胞逃避TGF-β介導的生長抑制效應,導致多種腫瘤發生[3-4]。不同類型的細胞TGF-β誘導產生的生物學效應不同,可刺激或抑制細胞生長,可作為腫瘤抑制基因和癌基因的雙重角色存在[5]。作為Smad家族中的抑制性成員,Smad7不僅可阻斷Smad2和Smad3與Ⅰ型TGFβ-R的結合及其磷酸化,還可通過直接與活化的TGFβ-R及細胞內各轉錄因子組氨酸去乙酰基酶結合而抑制TGF-β的信號通路[6]。研究表明,胰腺癌組織Smad7表達增高;轉染Smad7基因的胰腺癌細胞在裸鼠中成瘤能力增強,表明Smad7表達的異常將有助于腫瘤的發生、發展[7]。Kleeff等[8]通過顯微注射技術獲得轉Smad7基因小鼠,發現轉基因小鼠胰腺的導管上皮發生了惡性轉變。
基質金屬蛋白酶系統,包括MMPs及相應的TIMPs。其中MMPs的表達增加與多種惡性腫瘤的侵襲和轉移關系極為密切,而TIMPs的表達增加往往與腫瘤侵襲能力下降及患者的預后較好相關[9]。
本研究成功地將Smad7基因轉染入SW1990細胞,轉染率高達81.2%,有效地抑制Smad7表達,并顯著地抑制了細胞的增殖。同時細胞MMP-2及TIMP-2表達均顯著降低,表明Smad7也參與細胞基質金屬蛋白酶系統的代謝過程。至于轉染后SW1990細胞MMP-2與TIMP-2表達共同降低,可能它們之間還存在一定反饋機制,有待今后進一步深入研究。
[1] Glasgow E,Mishra L.Transforming growth factor-beta signaling and ubiquitinators in cancer.Endocr Relat Cancer,2008,15:59-72.
[2] 于鴻,陳琦,劉曄,等.轉染Smad7基因的大鼠腎小球系膜細胞對Ⅰ、Ⅲ型膠原表達的改變.復旦學報·醫學版,2008,35:436-440.
[3] Elliott RL,Blobe GC.Role of transforming growth factor Beta in human cancer.J Clin Oncol,2005,23:2078-2093.
[4] Muraoka-Cook RS,Dumont N,Arteaga CL.Dual role of transforming growth factor beta in mammary tumorigenesis and metastatic progression.Clin Cancer Res,2005,11:937s-943s.
[5] 鐘良,陳堅,徐近,等.胰腺癌組織中轉化生長因子β1及其Ⅰ型受體的表達及意義.中華消化雜志,2008,28:94-96.
[6] Fleisch MC,Maxwell CA,Barcellos-Hoff MH. The pleiotropic roles of transforming growth factor beta in homeostasis and carcinogenesis of endocrine organs.Endoc Relat Cancer,2006,13: 379-400.
[7] Yan X,Liu Z,Chen Y.Regulation of TGF-beta signaling by Smad7.Acta Biochim Biophys Sin(Shanghai),2009,41:263-272.
[8] Kleeff J,Ishiwata T,Maruyama H,et al.The TGF-beta signaling inhibitor Smad7 enhances tumorigenicity in pancreatic cancer.Oncogene,1999,18:5363-5372.
[9] Kuang C,Xiao Y,Liu X,et al.In vivo disruption of TGF-beta signaling by Smad7 leads to premalignant ductal lesions in the pancreas.Proc Natl Acad Sci USA,2006,103:1858-1863.
EffectofSmad7antisenseoligodeoxynucleotideontheexpressionofMMP-2,TIMP-2andproliferationinhumanpancreaticcancercellsSW1990
YUHong,HUANGJun-xing,WANGChao-fu,SHIDa-ren.
DepartmentofPathology,TaizhouPeople′sHospital,Taizhou225300,China
HUANGJun-xing,Email:huangjunxing@yahoo.com.cn
ObjectiveTo investigate the effect of Smad7 antisense oligodeoxynucleotide (ASODN) on proliferation in human pancreatic cancer cell line SW1990, with a focus on the expression of matrix metalloproteinase-2(MMP-2) and tissue inhibitor of metalloproteinase-2(TIMP-2). To explore the underlying mechanism of the role of Smad7 in the pathogenesis and development of pancreatic cancer.MethodsSmad7 ASODN was transfected into SW1990 cells through lipofectamine. Nosense oligodeoxynucleotide (NSODN), ASODN and lipofectamine was used as control. The transfection efficiency was assessed by fluorescence microscopy and flow cytometry. The expressions of Smad7, MMP-2 and TIMP-2 in transfected cells were detected by RT-PCR and Western blot. Cell viability was assessed by dimethyl thiazoldiphenyltetrazoliumbromide (MTT) method.ResultsSmad7 was expressed in SW1990 cells. The transfection efficiency of SW1990 was 81.2%. The expressions of Smad7 mRNA were 0.34±0.06, 0.95±0.07, 1.03±0.11 in transfected group, ASODN and lipofectamine group; and the expressions of MMP-2 mRNA were 0.54±0.08, 1.15±0.13, 1.27±0.16; and the expressions of TIMP-2 mRNA were 0.26±0.07, 0.72±0.13, 0.78±0.17, the mRNA expressions were significantly reduced in Smad7 ASODN transfected group, compared with other two groups (P<0.01). The expressions of Smad7 protein were 0.14±0.03, 0.29±0.05, 0.28±0.07 in transfected group, ASODN and lipofectamine group; the expressions of MMP-2 protein were 0.17±0.02, 0.29±0.05, 0.31±0.04, and the expressions of TIMP-2 protein were 0.20±0.03, 0.41±0.11, 0.43±0.09, the protein expressions were significantly reduced in Smad7 ASODN transfected group, compared with other two groups (P<0.01). TheA490values of proliferation were 0.83±0.03, 1.02±0.02, 0.99±0.02 in transfected group, ASODN and lipofectamine group, the proliferation were significantly reduced in Smad7 ASODN transfected group, compared with other two groups (P<0.01).ConclusionsSmad7 ASODN could effectively inhibit the expressions of Smad7, therefore decrease the expressions of MMP-2, TIMP-2 and reduce the proliferation.
Pancreatic neoplasms; Smad7; Antisense oligodeoxynucleotide; Matrix metalloproteinase-2; Tissue inhibitor of metalloproteinase-2; Cell proliferation
10.3760/cma.j.issn.1674-1935.2012.01.008
江蘇省醫學重點人才基金(RC2007036)
225300 江蘇泰州,江蘇省泰州市人民醫院病理科(于鴻),腫瘤科(黃俊星);復旦大學附屬腫瘤醫院病理科(王朝夫、施達仁)
黃俊星,Email:huangjunxing@yahoo.com.cn
2011-06-16)
(本文編輯:呂芳萍)

