加巴噴丁對(duì)癲癇持續(xù)狀態(tài)大鼠海馬區(qū)神經(jīng)元凋亡的影響
王克玲 劉新艷 王靜 施榮富 孫素真
癲癇發(fā)作,尤其是癲癇持續(xù)狀態(tài)(status epilepticus,SE)不僅會(huì)增加癲癇患者的死亡率,還可造成神經(jīng)元壞死和凋亡,長期影響癲癇患者的生存質(zhì)量。因此在控制癲癇發(fā)作的同時(shí)防止神經(jīng)元壞死和凋亡的腦保護(hù)劑成為研究重點(diǎn)。已發(fā)現(xiàn)一些抗癲癇藥具有抗凋亡作用[1]。加巴噴丁(gabapentin,GBP)是新在我國臨床使用的抗癲癇藥,它在抗癲癇同時(shí)是否具有神經(jīng)元保護(hù)作用尚不清楚。本研究用戊四氮(pentylenetetrazol,PTZ)制造大鼠癲癇持續(xù)狀態(tài)癲癇模型,用GBP進(jìn)行干預(yù),用缺口末端標(biāo)記法(TUNEL)法檢測(cè)海馬CA1、CA3區(qū)凋亡情況,以探討GBP的抗凋亡作用。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物 健康雄性Sprague-Dawley(SD)大鼠48只,體重(180±20)g,由河北省試驗(yàn)動(dòng)物中心提供,許可證號(hào):SCXK(冀)2003-1-003。PTZ(美國 Sigma公司)。GBP(-),TUNEL試劑盒(德國寶麗曼);顯微鏡[日本,BHS(Olympus),脫水機(jī)(英國姍頓公司,Citadel 2000)],包埋機(jī)(英國姍頓公司,Histocentres),切片機(jī)(英國姍頓公司,AS-325),顯微鏡(日本,BHS,Olympus)。
1.2 方法
1.2.1 分組:SD大鼠48只。隨機(jī)分為加巴噴丁組(GBP組)、加巴噴丁干預(yù)組(干預(yù)組)、戊四氮致癇組(PTZ組)、對(duì)照組,每組12只。
1.2.2 癲癇造模:SE 模型采用 PTZ 60 mg·kg-1·d-1腹腔注射,每24小時(shí)1次,每次注射后觀察30 min,觀察并記錄發(fā)作潛伏期、發(fā)作時(shí)行為表現(xiàn)和持續(xù)時(shí)間。大鼠驚厥行為表現(xiàn)采用Racine六級(jí)評(píng)價(jià)標(biāo)準(zhǔn)[2]。0級(jí):無任何反應(yīng);Ⅰ級(jí):濕狗樣抖動(dòng)、面肌痙攣如眨眼、動(dòng)須、及節(jié)律性咀嚼;Ⅱ級(jí):頸部肌肉痙攣表現(xiàn)為點(diǎn)頭和(或)甩尾;Ⅲ級(jí):一側(cè)前肢陣攣;Ⅳ雙側(cè)前肢陣攣伴站立;Ⅴ級(jí):全身陣攣,失去平衡,跌倒。記錄發(fā)作時(shí)的行為表現(xiàn)。PTZ注射期間出現(xiàn)racineⅣ~Ⅴ級(jí)驚厥發(fā)作持續(xù)30 min,連續(xù)3 d未死亡者為SE成功,成功率75%。干預(yù)組于致癇成功后給予GBP灌胃,每天600 mg/kg;PTZ組照常喂養(yǎng);GBP組給予未致癇大鼠GBP 600 mg/kg;對(duì)照組給予等體積0.9%氯化鈉溶液灌胃,所有喂藥均每天分2次給予,共5 d。
1.2.3 腦電圖描記:每組大鼠取2只進(jìn)行腦電圖描記。用10%水合氯醛35 mg/kg給予大鼠腹腔注射麻醉,電極位置采用單極導(dǎo)聯(lián)法,記錄電極取兩根0.5寸針灸毫針分別刺入大鼠頂骨正中左右兩側(cè)頭皮下,再用導(dǎo)線連接于腦電圖機(jī)信號(hào)輸入盒,大鼠尾根部電極接地。先觀察行為學(xué)改變,然后描記腦電圖。
1.2.4 標(biāo)本制備:10%水合氯醛35 mg/kg腹腔注射麻醉。輸液架距大鼠心臟高度控制在1.5 m。打開胸腔暴露心臟。找到心尖部,右手將灌流針刺破心尖部進(jìn)針入主動(dòng)脈。先以0.9%氯化鈉溶液快速灌流,直到從右心耳流出無色液體,腸系膜顏色變蒼白,肝臟顏色變淡黃,隨后灌注4℃預(yù)冷的4%的多聚甲醛溶液250 ml(0.1 mol/L PB配液,pH值7.4)。開始全速灌流,注意觀察大鼠,直到看到大鼠四肢突然緊張,肌肉陣攣,尾部卷曲上翹轉(zhuǎn)至其四肢肌肉抽搐停止,此時(shí)改為緩慢滴灌,至大鼠軀干、四肢、尾部僵直,肝臟變硬,說明達(dá)到固定目的。灌注時(shí)間控制在1.5 h左右。在視交叉和乳頭體處垂直橫斷腦組織,將含有海馬的中段腦組織置于4%多聚甲醛溶液。常規(guī)脫水、透明、石蠟包埋。用石蠟切片機(jī),自視交叉向后冠狀位連續(xù)石蠟切片,切至出現(xiàn)海馬結(jié)構(gòu),每片厚度5 μm,每隔5張取1張,每個(gè)標(biāo)本區(qū)2張用于TUNEL檢測(cè)。常規(guī)脫蠟入水、PBS洗3次、顯色、復(fù)染、常規(guī)脫水透明封固、鏡下觀察海馬組織細(xì)胞凋亡。
1.2.5 TUNEL檢驗(yàn)凋亡陽性細(xì)胞:TUNEL染色嚴(yán)格按試劑盒說明書步驟進(jìn)行操作。細(xì)胞核染成棕褐色的為凋亡陽性細(xì)胞。每張切片海馬部位分別至少觀察CA1和 CA3區(qū)10個(gè)具有代表性的高倍視野(100×),計(jì)數(shù)每個(gè)視野中染色陽性的細(xì)胞數(shù),計(jì)算出凋亡指數(shù)。細(xì)胞凋亡指數(shù)(apoptotic index,AI)=凋亡細(xì)胞數(shù)/細(xì)胞總數(shù)×100%。
1.3統(tǒng)計(jì)學(xué)分析應(yīng)用SPSS 13.0統(tǒng)計(jì)軟件,計(jì)量資料以±s表示,組間兩兩比較F檢驗(yàn),,P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 3組SE大鼠海馬區(qū)CA1、CA3 TUNEL陽性細(xì)胞表達(dá) 細(xì)胞核內(nèi)TUNEL染色陽性細(xì)胞呈棕黃色小塊和顆粒,對(duì)照組大鼠皮質(zhì)可見散在的TUNEL陽性細(xì)胞,海馬區(qū)CA1和CA3區(qū)未見TUNEL陽性細(xì)胞。PTZ組與正常對(duì)照組比較,皮層細(xì)胞層排列紊亂,細(xì)胞層數(shù)減少,海馬區(qū)CA1和 CA3區(qū)可見TUNEL陽性細(xì)胞,細(xì)胞核呈現(xiàn)棕黃色,數(shù)量較多。干預(yù)組TUNEL陽性細(xì)胞明顯少于PTZ組。見圖1。
2.2 TNE陽性細(xì)胞數(shù)量分析 GBP組和對(duì)照組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05);PTZ組與對(duì)照組比較,PTZ組增多(P<0.01);PTZ組與干預(yù)組比較,干預(yù)組凋亡細(xì)胞少于PTZ組(P <0.05)。見表1。
表1GBP對(duì)SE大鼠海馬神經(jīng)AI的影響n=12,±s

表1GBP對(duì)SE大鼠海馬神經(jīng)AI的影響n=12,±s
75±9 12±5 GBP組 10±5 PTZ組 88±12干預(yù)組組別 凋亡指數(shù)對(duì)照組
3 討論
過去認(rèn)為癲癇發(fā)作造成的神經(jīng)元損害主要表現(xiàn)為壞死,但近來國內(nèi)外研究證實(shí),癲癇發(fā)作后神經(jīng)細(xì)胞的死亡方式除壞死外還存在凋亡[3]。還有人認(rèn)為癲癇的主要病理改變是細(xì)胞凋亡[1]。癲癇動(dòng)物模型的研究表明,癲癇發(fā)作可導(dǎo)致海馬、杏仁核、大腦皮質(zhì)、丘腦及小腦等部位神經(jīng)元喪失[4],顳葉癲癇的腦邊緣區(qū)特別是海馬呈現(xiàn)顯著的神經(jīng)元喪失。神經(jīng)元喪失包括壞死、凋亡和不易區(qū)分的混合形態(tài)3種類型。在人類顳葉癲癇患者及各種SE模型中用形態(tài)學(xué)生化的方法均證實(shí),神經(jīng)元的損傷具有典型的凋亡征[5]。SE是指1次發(fā)作30 min以上,或30 min內(nèi)發(fā)作多次,期間神智清醒者。SE對(duì)神經(jīng)元的損傷更為嚴(yán)重,有學(xué)者認(rèn)為癲癇持續(xù)時(shí)間長短決定海馬神經(jīng)元死亡的形式[6]。本實(shí)驗(yàn)用戊四氮致癲癇持續(xù)狀態(tài)后發(fā)現(xiàn)SE大鼠海馬區(qū)CA1C和A3的凋亡細(xì)胞顯著增加,提示SE確實(shí)能引起神經(jīng)元的凋亡與有關(guān)研究報(bào)告一致[7]。既然細(xì)胞凋亡是SE后神經(jīng)元丟失的重要形式。因此,阻斷凋亡就成為保護(hù)癲癇患者腦損傷的新途徑。
近十年新型抗癲癇藥已在我國廣泛應(yīng)用,對(duì)這些抗癲癇藥物是否也具有抗凋亡的神經(jīng)保護(hù)作用成為研究重點(diǎn)。已有研究認(rèn)為托吡酯和左乙拉西坦具有保護(hù)因癲癇發(fā)作造成的海馬神經(jīng)元損害[1,8]。GBP有無神經(jīng)元保護(hù)作用尚不清楚。本實(shí)驗(yàn)用發(fā)現(xiàn)PTZ制造的SE模型海馬CA1和CA3區(qū)凋亡細(xì)胞顯著多于對(duì)照組,提示SE確實(shí)可以引起神經(jīng)元凋亡的發(fā)生,而加用GBP后,凋亡減輕,提示GBP保護(hù)癲癇發(fā)作引起神經(jīng)元凋亡。雖然GBP結(jié)構(gòu)與神經(jīng)遞質(zhì)γ-氨基丁酸(GABA)相似,但它并不通過GABA機(jī)制直接發(fā)揮作用,并不作用于GABA的受體,不代謝成GABA或GABA激動(dòng)劑,也不抑制GABA的攝取和降解,它的抗癲癇機(jī)制尚不明確。目前研究認(rèn)為GBP通過Na+依賴性通道通過血腦屏障,結(jié)合于谷氨酸占優(yōu)勢(shì)的大腦皮質(zhì)、海馬及小腦的分子層,影響神經(jīng)細(xì)胞膜的氨基酸轉(zhuǎn)運(yùn)而起到抗癲癇作用[9]。它在本實(shí)驗(yàn)中顯示出抗凋亡作用是否和托吡酯一樣也是通過拮抗興奮性氨基酸的毒性作用還有待于進(jìn)一步研究。
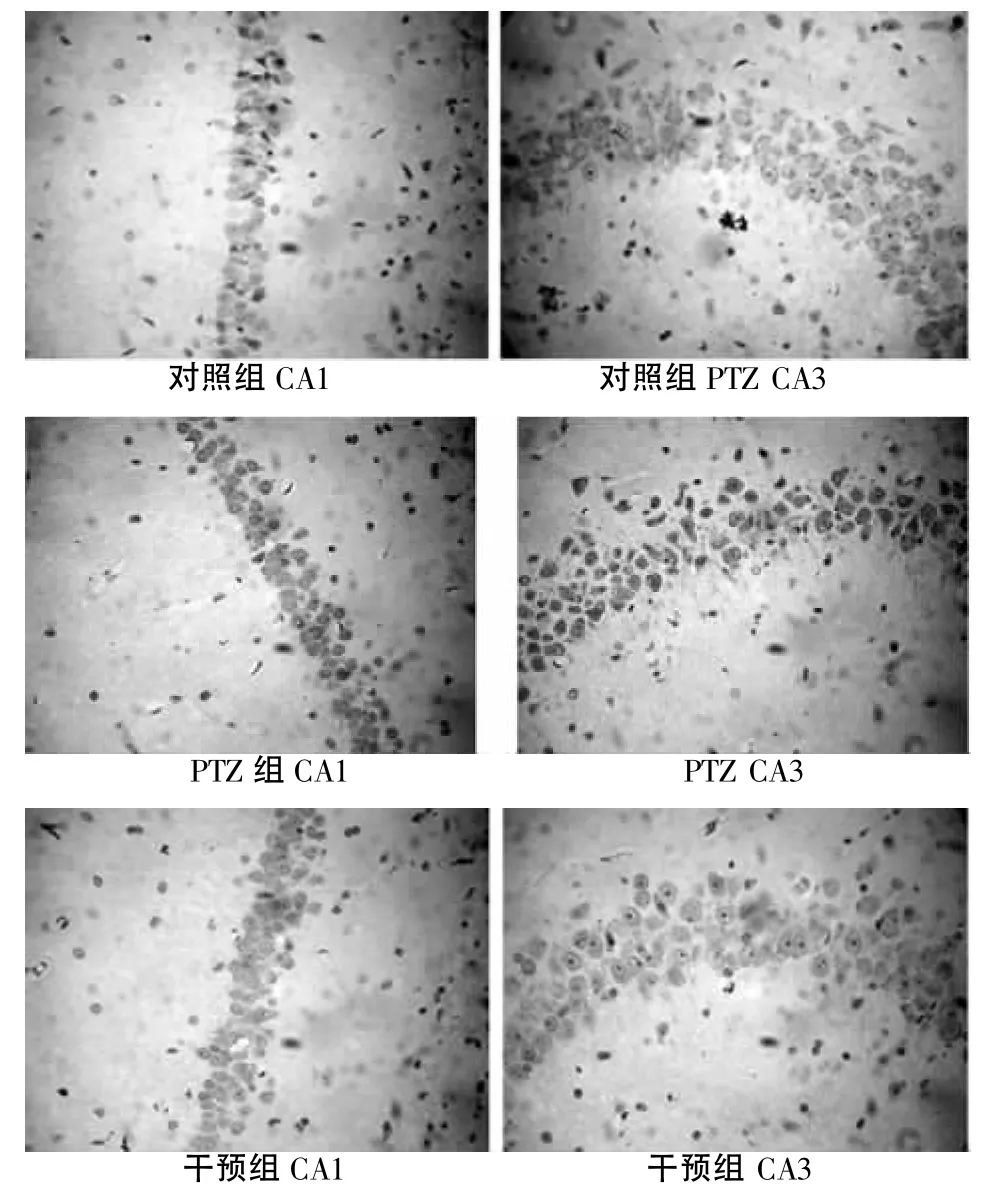
圖1 3組SE大鼠海馬區(qū)CA1、CA 3 TUNEL陽性細(xì)胞表達(dá)
隨著對(duì)癲癇患者生活質(zhì)量的重視,發(fā)現(xiàn)SE后腦損傷的發(fā)病率日益增高,有關(guān)SE中神經(jīng)元保護(hù)的研究也不斷取得進(jìn)展,但癲癇發(fā)作所致的腦損傷機(jī)制相當(dāng)復(fù)雜,各種因素相互影響。目前人們已將SE后神經(jīng)元損傷的研究重點(diǎn)轉(zhuǎn)移至線粒體和基因[10,11],認(rèn)為線粒體是調(diào)控SE后神經(jīng)元死亡的核心環(huán)節(jié),線粒體的損傷、細(xì)胞色素C的釋放和caspase-3的激活是神經(jīng)元損傷的最后共同通路。基因的不正常表達(dá)也是癲癇性腦損傷的重要途徑。這些發(fā)現(xiàn)為SE后腦保護(hù)治療開辟了新的前景。
1 紀(jì)建波,張慶柱,李倩,等.托吡酯對(duì)癲癇持續(xù)狀態(tài)大鼠海馬神經(jīng)元損傷的影響.山東醫(yī)藥,2006,46:23-24.
2 Racine RJ.Modification of seizure activity by electrical stimulation.II.Motor seizure.Electroencephalogr Clin Neurophysiol,1972,32:281-294.
3 丁瑛雪,高麗.癲癇的腦損傷研究進(jìn)展.國際兒科學(xué)雜志,2007,34:17-20.
4 Bertram EH,Scott C.The pathological substrate of limbic epilepsy:neuronal loss in the medial dorsal thalamic nucleus as the consisterrt change.Epilepsia,2000,41:53-58.
5 Sarkar R,Shin DH,Liu H,et al.Patterns of status epilepticus induced neuronal injury during development and long term cones quences.Neurosci,1998,18:8382-8393.
6 陳玉華.癲癇發(fā)作誘導(dǎo)神經(jīng)元死亡的機(jī)制.黃石理工學(xué)院學(xué)報(bào),2011,27:58-61.
7 謝煒,于禮建,鮑勇,等.柴胡總皂貳對(duì)戊四氮致痛大鼠海馬神經(jīng)細(xì)胞凋亡.新中醫(yī),2006,38:87-88.
8 王學(xué)峰,張喻,彭希,等.癲病持續(xù)狀態(tài)中海馬神經(jīng)元的保護(hù):現(xiàn)狀及展望.中國神經(jīng)免疫學(xué)和神經(jīng)病學(xué)雜志,2010,17:95-98.
9 李紅霞,王孝蓉,趙志剛.抗癲癇藥物加巴噴丁臨床藥物.治療雜志,2006,4:49-53.
10 何斌,于會(huì)青.癲癇持續(xù)狀態(tài)臨床分析.河北醫(yī)藥,2011,33:2830.
11 Tan Z,Sankar R,Tu W,et al.Immunohistochemical study of p53-associated proteins in rat brain following lithium-pilocarpine status epilepticus.Brain Res,2002,929:129-138.

