滲透性脫髓鞘綜合征的臨床分析和影像學(xué)特點(diǎn)(附1例報(bào)道)
徐金梅 劉美真 張兆輝
滲透性脫髓鞘綜合征(osmotic demyelination syndrome,ODS)是一種罕見的特殊脫髓鞘疾病,病變可累及中樞神經(jīng)系統(tǒng)多個(gè)部位,根據(jù)發(fā)病部位的不同,分為腦橋中央髓鞘溶解癥(central potine myelinolysis CPM)和腦橋外髓鞘溶解癥(extrapotine myelinolysis EPM),CPM 表現(xiàn)為對(duì)稱性累及腦橋中央,EPM 累及腦橋以外的區(qū)域,如基底節(jié)、丘腦、小腦、皮質(zhì)下白質(zhì)等部位,二者可單獨(dú)發(fā)生也可合并發(fā)生。ODS臨床上非常少見,極易被漏診和誤診。本科收治1例CPM 合并EPM 的患者,該患者有長(zhǎng)期飲酒史,但沒有血鈉改變,血鈉正常,在臨床上實(shí)屬罕見,現(xiàn)將其報(bào)道如下。
1 臨床資料
患者,男,56 歲,第1 次入院:因頭痛、智能下降、嗜睡20余天于2011年3月29日入院,患者于2011年3月10日無明顯誘因出現(xiàn)頭痛,次日出現(xiàn)騎摩托車摔倒,肢體無力,記憶力、計(jì)算力下降,精神差,懶言少語,于第4 d天行頭顱CT 示右基底節(jié)低密度影,未行治療。病情逐漸加重,于2011年3月22日在當(dāng)?shù)蒯t(yī)院就診,頭顱MRI示右側(cè)顳葉、基底節(jié)、側(cè)腦室枕腳旁及腦干多發(fā)異常信號(hào),T1WI加權(quán)低信號(hào)、T2WI加權(quán)高信號(hào),行相關(guān)輸液治療后,病情無明顯好轉(zhuǎn)來本院就診,門診以“酒精性中毒性腦病”收入院。患者既往有30年長(zhǎng)期飲酒史,主要飲白酒,平均每日飲酒500 g,已戒酒。入院時(shí)神經(jīng)系統(tǒng)查體:神志清,精神差,記憶力下降、計(jì)算力下降,雙瞳孔等大等圓,對(duì)光反射靈敏,左側(cè)鼻唇溝淺,伸舌偏左,左側(cè)肢體肌力4級(jí),右側(cè)肢體肌力5級(jí),四肢肌張力正常,腱反射引不出,Romberg sign(+),左側(cè)偏身淺感覺減退,病理征(-),頸軟,Kernig sign可疑陽(yáng)性。輔助檢查:三大常規(guī)、血粘度、凝血全套、風(fēng)濕全套未見明顯異常,肝腎功能及電解質(zhì)正常,血鈉141.7 mmol/L,血鉀3.6 mmol/L。心電圖示竇性心動(dòng)過緩。入院當(dāng)天行腰穿檢查,CSF 檢查示:白細(xì)胞26×106/L,淋巴細(xì)胞0.9,蛋白0.66 g/L,糖3.3 mmol/L,氯化物106 mmol/L,抗酸+墨汁染色陰性。EEG 輕度異常。2011年3月31日復(fù)查頭顱MRI示腦干、左側(cè)小腦半球及右丘腦、雙側(cè)基底節(jié)區(qū)多發(fā)異常信號(hào),T1WI加權(quán)低信號(hào)、T2WI加權(quán)高信號(hào),病變范圍比上次擴(kuò)大,入院后給予改善循環(huán)、營(yíng)養(yǎng)腦細(xì)胞、維生素B1、B12及對(duì)癥治療9 d后病情有所緩解,精神明顯好轉(zhuǎn),仍訴頭痛,查體:記憶力、計(jì)算力下降,無明顯改善,四肢肌力、肌張力正常,病理征陰性。患者家屬要求出院,囑患者出院后戒酒,繼續(xù)補(bǔ)充維生素治療,出院診斷為酒精中毒性腦病。
第二次入院:患者因漸進(jìn)性意識(shí)障礙10 d,加重1 d于2011年5月18日再次入院,血電解質(zhì)正常,血鈉:141.90 mmol/L,血鉀:3.90 mmol/L,血常規(guī)未見明顯異常,查體:淺昏迷,呼之不應(yīng),壓眶可見痛苦表情,雙瞳孔不等大,左瞳直徑約3.0mm,右瞳約4.5 mm,右側(cè)對(duì)光反射消失,左側(cè)對(duì)光反射遲鈍,角膜反射未引出,左側(cè)肢體肌力1 級(jí),右側(cè)肢體肌力4+級(jí),四肢肌張力增高,膝反射等稱引出,雙側(cè)巴氏征(+),頸強(qiáng)直,克氏征及布氏征(-),感覺及共濟(jì)檢查不配合。2011 年5 月10日復(fù)查頭顱MRI示右側(cè)額、顳葉及雙側(cè)枕葉、雙側(cè)基底節(jié)、小腦、腦干多發(fā)病灶,長(zhǎng)T1長(zhǎng)T2信號(hào),且有占位效應(yīng),中線移位,病灶增大、增多,考慮腫瘤性病變可能性大,于2011年5月19日行頭顱MRI平掃+DWI+增強(qiáng)掃描示左側(cè)顳葉、右側(cè)額葉、雙側(cè)基底區(qū)、雙側(cè)小腦半球及雙側(cè)丘腦見片狀稍長(zhǎng)T1、稍長(zhǎng)T2信號(hào),T2flair呈高信號(hào),增強(qiáng)后病灶明顯強(qiáng)化。給予脫水降顱壓、醒腦護(hù)腦、激素、抗感染及對(duì)癥治療,患者病情無明顯改善,分析患者病情,亞急性起病,首發(fā)癥狀為頭痛、認(rèn)知功能障礙,曾一度改善,后又惡化,臨床表現(xiàn)為雙相病程,且本次頭顱MRI顯示較當(dāng)?shù)蒯t(yī)院MRI有改善,考慮本病是酒精中毒引起的脫髓鞘疾病,頭顱MRI顯示多處病灶,既有腦橋基底部對(duì)稱性病變,又存在腦橋外病變,增強(qiáng)掃描有部分強(qiáng)化,診斷為ODS,患者一直呈淺昏迷狀,住院期間出現(xiàn)肺部感染(痰培養(yǎng)示肺炎克雷伯氏菌,菌落計(jì)數(shù)4+)、上消化道出血(多次胃管抽出咖啡色胃液共約260 ml),給予加強(qiáng)抗感染、護(hù)胃、止血等對(duì)癥支持治療,2011年6月1日轉(zhuǎn)往當(dāng)?shù)蒯t(yī)院繼續(xù)治療,出院情況:淺昏迷,右瞳孔直徑4 mm,眼球外展位,左瞳孔直徑3.5 mm,眼球居中,左側(cè)肢體肌張力鉛管樣增高,右側(cè)肢體輕度增高,雙側(cè)巴氏征(+)。

圖1 2011年5月19日頭顱MRI增強(qiáng)顯示多部位明顯強(qiáng)化

圖2 DWI(2011-5-19)示左側(cè)顳葉、右側(cè)額葉、雙側(cè)基底節(jié)、雙側(cè)小腦半球及雙側(cè)丘腦見片狀高信號(hào)
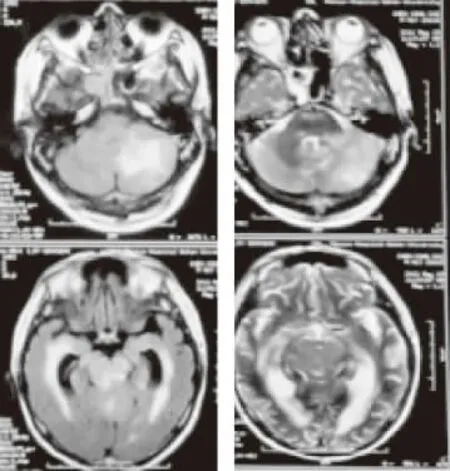
圖3 T2flair(2011-5-19)示左側(cè)顳葉雙側(cè)基底節(jié)、雙側(cè)小腦半球及雙側(cè)丘腦高信號(hào)

圖4 T1WI(2011-5-19)示左側(cè)顳葉、右側(cè)額葉、雙側(cè)基底節(jié)、雙側(cè)小腦半球及雙側(cè)丘腦見片狀稍長(zhǎng)T1信號(hào)
2 討 論
患者有長(zhǎng)期飲酒病史,既往體健,多次復(fù)查電解質(zhì)均正常,臨床表現(xiàn)為意識(shí)障礙、認(rèn)知功能下降、肢體癱瘓、肌張力障礙等,具有雙相病程,臨床癥狀有一定好轉(zhuǎn)后再次加重,第1次入院臨床表現(xiàn)以頭痛、認(rèn)知功能下降為主,查體:嗜睡,精神差,瞳孔等大等圓,左側(cè)中樞性面舌癱,左側(cè)肢體肌力4級(jí),肌張力正常。第2次入院較第1次病情加重,神志呈淺昏迷,瞳孔不等大,肢體癱瘓,左側(cè)肢體肌張力增高呈鉛管樣。頭顱MRI顯示多發(fā)病灶,病變不僅對(duì)稱性累及腦橋中央,還累及腦橋以外的部位,如基底節(jié)、小腦、丘腦、皮質(zhì)下白質(zhì)及中腦等,T1 WI加權(quán)低信號(hào)、T2 WI加權(quán)高信號(hào),增強(qiáng)可見明顯強(qiáng)化。1959年Adams等首次詳細(xì)提出了腦橋中央對(duì)稱性的髓鞘溶解,報(bào)道了4例因突發(fā)四肢癱瘓和假性球麻痹而死亡的患者,尸解發(fā)現(xiàn)腦橋基底部中央可見對(duì)稱性、非炎性神經(jīng)纖維脫髓鞘改變,但神經(jīng)細(xì)胞及軸突相對(duì)保存,血管未受累,無炎性改變,根據(jù)病變部位及病理特征首次命名為CPM[1]。不斷有研究報(bào)道,類似的對(duì)稱性脫髓鞘病變還可累及腦橋外的部位,如基底節(jié)、丘腦、小腦、大腦皮質(zhì)及皮層下等,被稱為EPM[2]。CPM 和EPM 合稱為ODS,二者既可單獨(dú)發(fā)生,也可合并出現(xiàn),病理相同,分別表現(xiàn)為腦橋及腦橋外對(duì)稱性脫髓鞘病變。
目前ODS的病因及發(fā)病機(jī)制尚未完全明確,大部分患者發(fā)生在快速糾正低鈉血癥后[3],尤其是伴有慢性酒精中毒、器官移植(尤其多見于肝移植的報(bào)道)、長(zhǎng)期營(yíng)養(yǎng)不良、惡性腫瘤、糖尿病酮癥酸中毒等慢性消耗性疾病,也可見于不恰當(dāng)抗利尿激素分泌綜合征、化療放療術(shù)后、腎功能衰竭、嚴(yán)重創(chuàng)傷等患者中[4]。國(guó)外報(bào)道的以酒精中毒多見[5]。ODS 可以沒有低血鈉,有個(gè)案報(bào)道此病也可以發(fā)生在血鈉正常、低血鉀的患者[6],本研究報(bào)道的患者多次查血鈉、血鉀均是正常的,第1 次 入 院:血 鈉141.7 mmol/L,血鉀3.6 mmol/L,第2次入院:血鈉141.90 mmol/L,血鉀3.90 mmol/L,沒有低鈉 血癥,既往主要是有長(zhǎng)期飲酒史,飲酒量大,平均每天500 g,飲酒史約30 年,結(jié)合病史及相關(guān)影像學(xué)檢查,且給予維生素治療后病情明顯好轉(zhuǎn),第1次入院誤診為酒精中毒性腦病,在臨床上非常少見,希望通過本文的病例報(bào)告來提高廣大臨床工作者對(duì)ODS的認(rèn)識(shí)程度,減少誤診和漏診率。
ODS的臨床表現(xiàn)復(fù)雜多樣,可從精神異常到完全四肢癱,與病變累及部位和范圍有關(guān)系,CPM 典型表現(xiàn)為快速出現(xiàn)的四肢痙攣性癱瘓、假性球麻痹、意識(shí)改變,偶有閉鎖綜合征、緘默癥。EPM 比CPM更少見,可出現(xiàn)錐體外系癥狀等運(yùn)動(dòng)障礙,表現(xiàn)為帕金森綜合征、肌張力障礙、共濟(jì)失調(diào)等,嚴(yán)重時(shí)可出現(xiàn)急性期的昏迷[7]。當(dāng)病灶同時(shí)累及腦橋內(nèi)外時(shí),則兩種表現(xiàn)都會(huì)出現(xiàn)。本報(bào)告為CPM 合并EPM,同時(shí)累及腦橋及腦橋外,以頭痛、智能下降、嗜睡等癥狀急性起病,第1 次住院給予改善循環(huán)、維生素B1、B12等相關(guān)治療后,患者精神明顯好轉(zhuǎn)。1月后患者病情加重,四肢癱瘓和腦干功能受損,意識(shí)漸進(jìn)性加重,第2次入院呈淺昏迷,呼之不應(yīng),瞳孔不等大,左側(cè)肢體肌張力增高呈鉛管樣。表現(xiàn)為雙相病程,病情有一定好轉(zhuǎn)后再次加重,出現(xiàn)新的癥狀和體征。
頭顱MRI檢查是診斷ODS的關(guān)鍵,在影像學(xué)檢查上存在“延遲效應(yīng)”,MRI往往在臨床表現(xiàn)出現(xiàn)1~2周后才顯示病變,因此,在2周左右復(fù)查MRI是必要的,以免漏診。一旦出現(xiàn)對(duì)稱性非炎癥腦橋中部的異常信號(hào)區(qū),則有診斷意義。CPM 的頭顱MRI表現(xiàn)為腦橋基底部中央有T1加權(quán)低信號(hào),T2加權(quán)高信號(hào)的“蝙蝠翅”樣病灶[8]。Flair加權(quán)病灶高信號(hào)更清楚[9]。10%腦橋中央髓鞘溶解癥可伴有腦橋外髓鞘溶解癥,表現(xiàn)丘腦、基底節(jié)區(qū)域有對(duì)稱性的T1加權(quán)低信號(hào)、T2加權(quán)高信號(hào)病灶[10]。值得注意的是,近年來關(guān)于ODS的很多報(bào)道表明病灶沒有強(qiáng)化或者僅輕度強(qiáng)化,李仲光等報(bào)道32例滲透性脫髓鞘綜合征,頭顱MRI均未見強(qiáng)化[11],劉春紅等報(bào)道7例滲透性脫髓鞘綜合癥,頭顱MRI亦均未見強(qiáng)化[12]。本報(bào)道出現(xiàn)明顯強(qiáng)化,須引起高度重視,鑒別診斷非常重要,橋腦病變應(yīng)排除腦梗死、轉(zhuǎn)移癌、膠質(zhì)瘤、多發(fā)性硬化、腦干腦炎等;腦橋外對(duì)稱性病變則應(yīng)與缺氧、缺血性腦損害、遺傳性或獲得性肝腦變性、線粒體腦病等進(jìn)行鑒別。隨著MRI的發(fā)展,ODS診斷率大大增加,得以早期診斷、早期治療。但應(yīng)該注意的是,頭顱MRI陰性不能完全排除ODS診斷,仍有MRI檢查陰性而在尸檢中發(fā)現(xiàn)病灶。
ODS目前尚缺乏有效治療的方法,已報(bào)道有促甲狀腺素釋放激素(TRH)[13]、單用皮質(zhì)類固醇或聯(lián)用血漿置換、靜脈應(yīng)用免疫球蛋白及高壓氧療法等。但均系個(gè)案報(bào)道,缺乏大樣本病例的研究。為防治此病,應(yīng)首先治療原發(fā)病,盡可能避免電解質(zhì)紊亂,尤其低鈉血癥,也可以加強(qiáng)支持療法、功能康復(fù)鍛煉、良好護(hù)理等作為輔助治療。
從大量臨床個(gè)案報(bào)道來看,ODS的臨床預(yù)后并不一致,與影像學(xué)顯示病變大小、原發(fā)病及急性期患者神經(jīng)損傷的嚴(yán)重程度無關(guān)。對(duì)高危患者可引起高度重視,如突然出現(xiàn)血鈉的改變、肝移植、慢性酒精中毒及營(yíng)養(yǎng)不良的患者等,這樣可以避免誘發(fā)ODS。同時(shí)應(yīng)積極防治并發(fā)癥,如吸入性肺炎,尿路感染,深靜脈血栓和肺栓塞等,可以存活預(yù)后良好。需要強(qiáng)調(diào)的是,該病有一定的自限性,一旦出現(xiàn)ODS,無論病情有多嚴(yán)重,任何時(shí)候都不要放棄治療。
1 Adams RD,Victor M,Mancall E.Central pontine myelinolysis:A hitherto undescribed disease occurring in alcoholic and malnourished patients.Arch Neurol Psychiatry,1959,81(2):154-172.
2 Wright DG,Laureno R,Victor M.Pontine and extrapontine myelinolysis.Brain,1979,102(2):361-385.
3 Laureno R,Karp BI.Myelinolysis after correction of hyponatremia.Ann Intern Med,1997,126(1):57-62.
4 Kleinschmidt-De Masters BK,R0jiani Filley CM.Central and extrapontine myelinolysis then and now.J Neuropathol Exp Neurol,2006,65(1):l-11.
5 Lampl C,Yazdi K.Central pontine myelinolysis.Eur Neurol,2002,47(1):3-10.
6 Patel SV,Parish DC,Patel RM,eta1.Resolution of MRI findings in central pontine myelinosis associated with hypokalemia.AmJ Med Sci,2007,334(6):490-492.
7 蔣雯巍,蔣雨平.滲透性脫髓鞘綜合征.中國(guó)臨床神經(jīng)科學(xué),2007,15(3):306-309.
8 Choksi R,Roach ES.Ring-enhancing lesion in central pontine myelinolysis.Arch Neurol,2005,62(6):1016-1017.
9 Chu K,Kang DW,Ko SB,et a1.Diffusion-weighted MR findings of central pontine and extrapontine myelinolysis.Acta Neurol Scand,2001,104(6):385-388.
10 Martin RJ.Central pontine and extrappontine myelinolysis:the osmotic dmyelination syndrome.J Neurosurg Psychiatry,2004,75(Suppl 3):iii22-28.
11 李仲光,王小木,夏 峰,等.滲透性髓鞘脫失綜合征的臨床研究.中華神經(jīng)外科疾病研究雜志,2009,8(5):428-431.
12 劉春紅,張文英,宋彥峰.腦橋中央和腦橋外髓鞘溶解癥的臨床分析和影像學(xué)特點(diǎn).中國(guó)使用醫(yī)刊,2010,37(24):42-43.
13 Chemaly R,Halaby G,Mohasseb G,et al.Extrapontine myelinolysis:treatment with TRH.Rev Neurol(Paris),1998,154:163-165.

