植物耐鹽性研究進展
崔世友,夏禮如,邱海榮
(江蘇沿江地區農科所,江蘇省南通市耐鹽植物公共技術服務平臺,江蘇南通226541)
植物耐鹽性研究進展
崔世友,夏禮如,邱海榮
(江蘇沿江地區農科所,江蘇省南通市耐鹽植物公共技術服務平臺,江蘇南通226541)
土壤鹽漬化是全球農業面臨的主要非生物逆境之一。鹽脅迫中一連串的事件增加了磷脂酶D(PLD)的活性,接著產生高量的磷脂酸(PA),PA與MPK6結合并增強其活性,激活的MPK6可與SOS1結合并使其磷酸化;該過程將SOS、MAPK和PLD信號途徑整合在一起。在植物耐鹽性研究中,人們常常假設鹽逆境下過多的Na+引起生長和產量的下降,對耐氯研究重視不夠。從鹽逆境信號轉導途徑的整合與耐氯性等方面綜述了植物耐鹽性研究的進展。
鹽逆境;信號轉導;耐氯性
面對不斷增長的人口,要維持目前的糧食供應水平,到2025年和2050年全球糧食產量需分別增加38%和57%[1]。大多數可耕地已經用于種植,通過耕地面積的擴張增產糧食幾乎是不可能的,因此目標是增加單位面積的產量。據估計,世界耕地面積的15%因土壤侵蝕以及理化性狀變劣而退化,包括土壤鹽漬化[1]。近年來發展鹽土農業得到了各國廣泛的重視[2-3],筆者從鹽逆境信號轉導途徑和耐氯性研究2個方面介紹了植物耐鹽性研究的新進展。
1 鹽逆境信號轉導途徑的整合
植物防衛鹽分的一種主要方法是將其從細胞中排除,通過液胞的區隔化或從質膜外流。擬南芥SOS1蛋白是一種Na+/H+逆轉運蛋白[4],可被由SOS2蛋白激酶(SnrK3類蛋白)與SOS3(Ca2+感受蛋白)組成的蛋白復合體所激活。鹽逆境增加了胞內Ca2+濃度,進而激活SOS3,隨后與SOS2結合并激活之,SOS3/SOS2復合體激活SOS1,產生Na+的外運。轉基因植物中SOS1蛋白的過表達增加了植物的耐鹽性[5]。
鹽逆境也激活了促分裂素原活化蛋白激酶(MAPK)信號傳導途徑,該途徑包括蛋白激酶的一系列級聯,由生物或非生物逆境引發,也包含于發育過程中[6]。這些信號級聯特性研究得最清楚的是酵母高滲透性甘油(High Osmolarity Glycerol Response 1,HOG1)途徑,為應答超滲透條件傳遞甘油積累的信號,HOG1可使Na+/H+逆轉運蛋白磷酸化,該逆轉運蛋白的活性依賴于HOG1的存在[7]。在植物中,MAPK途徑的組分在鹽逆境下是上調轉錄或酶活性增強[8]。尤其是擬南芥的MPK6和MPK4[9],這些激酶可被上游的蛋白激酶MKK2部分地激活,其突變體是鹽敏感的[10]。不過對鹽逆境中MAPK信號的理解主要還是描述性的,該信號如何在植物鹽逆境中實際發揮功能還遠未真正了解。
第3個組分是磷脂酶D(PLD),在擬南芥和其他植物中,PLD酶由一個多基因家族編碼,已知鹽逆境誘導該家族一些成員的表達。與質膜有關的PLD酶從磷脂酰膽堿釋放磷脂酸(phosphatidic acid,PA),PA是許多不同逆境如活性氧的產生和誘導氣孔關閉應答的第二信使。此外,PLD突變體是鹽分過敏感的[11]。在PA與MAPK信號之間也存在關聯,因為在動物細胞中,增加PA濃度可激活MAPK激酶激酶(MAPKKK)Raf1。在植物中,PA與乙烯組成性三重應答(Constitutive Triple Response 1,CTR1)結合并抑制其活性,后者是乙烯信號傳導中的MAPKKK[12],PA在大豆傷害誘導MAPK的激活中也起作用[13]。
為將這些不同的信號整合在一起,Yu等[14]開展了一系列研究。首先通過生理分析以確認plda1突變體和mpk6突變體確實是鹽敏感的,鹽處理誘導擬南芥的PLD活性,進而研究了鹽處理后所產生PA的特性。因為PA可與許多不同的蛋白結合,包括MAPK信號途徑的組分[15]。在一個關鍵性的實驗中,研究了重組MPK6蛋白是否確實與不同形式固定的PA結合。研究者發現MPK6特異性地與那些PA分子的結合,且鹽分處理后得到強化;實驗還表明脫落酸信號蛋白ABI1也與PA結合[16]。此外,還發現這些特定形式的PA會刺激激免疫沉淀MPK6激酶活性,這些生化發現通過遺傳方面的研究而得到進一步證實,MPK6激酶活性通過鹽處理而得到增強,而在plda1突變體中則未增強。外源PA和鹽分添加給plda1和mpk6突變體,PA挽救了鹽敏感的plda1表型而不是mpk6表型,這些結果表明因PLD而產生的PA對于MPK6所賦予的耐鹽性是重要的[14]。
通過以上一系列的實驗建立了鹽逆境、PLD活性和MPK6活性間可信的聯系,研究者以此做了進一步的推論:在酵母中,假如HOG1將Nha1 Na+/H+逆轉運蛋白磷酸化,MPK6同樣地與Na+/H+逆轉運蛋白SOS1互作嗎?對于重組的SOS1蛋白和重組的以及免疫沉淀MPK6,研究者發現MPK6也與磷酸化的SOS1互作,而在來自鹽逆境植株的MPK6免疫沉淀以及將PA添加到對照植株的免疫沉淀中時,其磷酸化得到增強。
由此可將鹽脅迫植物生物學的幾個不同元素匯集在一起,鹽脅迫中一連串的事件增加了PLD活性(也許是通過增強鈣的濃度)[17],接著產生高量的PA,PA與MPK6結合并增強其活性,激活的MPK6可與SOS1結合并使其磷酸化。不過還有許多問題沒有澄清,如通過MPK6使SOS1磷酸化對于增強逆轉運蛋白活性是足夠的且必須的嗎?其中還含有其他MAP激酶嗎?SOS2/SOS3與MPK6之間是什么關系?需要回答的一個主要問題是PA如何增強MAPK6活性?MAPK活化可接受的模型是上游的MAPKK使其激活域的蘇氨酸和酪氨酸殘基磷酸化,不過,Yu等的實驗則是添加PA至來自非脅迫植株免疫沉淀的MPK6后而增強MPK活性[14];可能MPK6已經處于磷酸化狀態,而PA旨在加強該激酶的活性構象。更為復雜的事實是,盡管MKK9是MPK6的上游激活子,但mkk9突變體幼苗是耐鹽的[18]。很明顯,其中的一些重要的細節缺失了,但是Yu等的工作在整合植物逆境生物學中3個分離的元素中向前邁出了重要的一步[19]。
NaCl進入植物細胞刺激了胞內Ca的增加,這觸發了通過蛋白激酶SOS2和鈣受體SOS3對質膜SOS1的刺激,磷脂酶D(PLD)活性也因Ca2+而增強,產生磷脂酸(PA),PA與MPK6結合并增加其活性,MPK6可使SOS1磷酸化,可能增強了SOS1活性并導致Na+從細胞中外流。
2 鹽逆境中Cl-害的研究
了解作物耐高濃度NaCl的機制有助于改良鹽土下的作物產量。鹽逆境滲透階段在有毒離子大量積累前即可延遲出葉、抑制葉片擴展、促進葉片衰老[20-21],不過這可能是一種瞬間效應,長期暴露于高鹽分,一旦Na+和Cl-積累至高濃度時就會加重傷害。Na+和Cl-的離子平衡是減輕高等植物NaCl逆境的重要機制。人們常常假設鹽分下過多的Na+引起生長和產量的下降[22-25],進而對Na+離子進入細胞的機制進行了大量的研究,耐鹽性的排Na+機制已在分子水平上得到認識[26-28]。不過,在鹽逆境下生長的植物組織中常常發現高濃度的Cl-[29-30],而對鹽逆境中過多Cl-的可能毒性卻關注很少。
2.1 鹽逆境中Cl-害和Na+害具有同等重要性
盡管Cl-在鹽土中是一種主要的陰離子,但是對高濃度Cl-對耐鹽性的重要性以及耐Cl-機制的了解,比對Na+運輸少很多[31-32]。既然Na+和Cl-在胞質中積累到高濃度就會產生代謝毒性,則在研究中就應給予同樣的關注[21,32-34],。
氯是高度植物必需的微量營養之一,調節胞質中的酶活性,在光合作用水的光解過程中起活化劑的作用,并參與根和葉的細胞分裂,以及細胞和液泡內外的滲透調節和膨壓維持,作為一種抗衡陰離子(counter anion)在細胞內外的流動直接決定了胞內外pH梯度、膜電勢和相關電生理過程的變化[33-34]。
高濃度Cl-的對植物有毒,其臨界毒性濃度對敏感物種為4~7mg·g-1,而對耐Cl-物種則為15~50mg·g-1[33-34]。Cl-轉運體的控制和莖排Cl-與許多物種的耐鹽性有關,尤其是豆科植物如三葉草[35-36]、苜蓿[37]、大豆[38]和蓮[39]以及多年生樹木如柑桔和葡萄[40-41]。在蕓豆中發現葉片嚴重失綠和光合作用下降[42],高濃度Cl-引起生長速率下降。有關大豆的研究表明該物種對高濃度Cl-敏感[43-44]。研究表明豆科植物耐鹽性的一個重要的生理機制是莖排氯,7個豆科Lotus物種莖中氯含量與以LD50(50%植株死亡的天數)所表示的耐鹽性間相關密切,決定系數達0.65[45]。
Slabu等[46]認為生長于高濃度NaCl下的蠶豆,Na+是主要的毒性離子,因為其干擾K+的吸收,打斷了有效的氣孔調節,產生非生產性水分丟失以及壞死;而Cl-由于葉綠素降解而誘發失綠毒性癥狀。但該研究并未測定植物生長參數以檢測Na+和Cl-的相對重要性。
根據大量小麥和鷹嘴豆田間試驗的分析,Dang等[47]認為土壤中的Cl-濃度在減少生長和產量中比Na+更重要,所估測的表土臨界Cl-濃度(定義為生長或產量減少10%時的濃度)為490mg Cl-·kg-1土。他們發現隨著表土鹽分水平的增加,普通小麥、硬粒小麥和鷹嘴豆最年輕成熟葉中Cl-濃度的變化比Na+濃度的變化大[48],表明Cl-毒性對生長比Na+毒性相對更重要。
高Na+和高Cl-都能減少蠶豆的生長,但植物對Cl-比對Na+更敏感。生長和光合作用的減少在NaCl逆境下更大,其效應主要為加性。高NaCl濃度的鹽分可通過高濃度的Na+和高濃度Cl-的積累而同時減少生長,但2種離子的效應有差異,高Cl-濃度由于葉綠素降解而減少光合能力和量子產量,其原因可能來自高Cl-濃度對PSII的結構影響;而高Na+則是干擾了K+和Ca2+營養的吸收,擾亂了有效的氣孔調節,光合作用和生長下降。這些結果表明Cl-毒性在鹽逆境下生長和產量降低中的重要性可能被低估了[21]。在隨后的大麥研究中也得到了類似的結果[49]。
2.2 Cl-吸收中的轉運體

CCC:陽離子氯離子共運子;CHX:陽離子/H+交換子;CLC:電壓門控Cl-通道;CNGC:換核苷門控通道;GLR:谷氨酸類受體;HKT:高親和性K+轉運子,KCO:K+外向整流通道;KHX:K+/H+交換子;KIR:Shaker類K+內向整流子;KOR:Shaker類外向整流子;KUP/HAK:K+吸收通透酶;NHX:Na+/H+交換子;NSCC:非選擇性陽離子通道;TPK:二孔K+通道。圖1 水稻鹽逆境期間Na+、K+和Cl-穩態平衡中的主要基因家族[51]
由于細胞質膜存在內負外正的膜電勢,因此植物細胞對Cl-的吸收和液泡對Cl-的分隔是逆電化學勢梯度的主動運輸過程,需要消耗一定的能量。一般認為Cl-進入細胞需依賴質膜上運輸蛋白(Cl-/2H+共運子)或借助于陰離子(Cl-)通道才能完成。Cl-進入液泡常與其膜上質子泵H+-ATPase和H+-PPase驅動的H+跨膜轉運相伴隨,并通過其膜上的Cl-/H+逆轉運子來完成,或通過陰離子(Cl-)通道來實現[34,50]。圖1列出了水稻鹽逆境期間Na+、K+和Cl-穩態平衡中的主要基因家族。
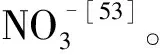
第二類潛在的Cl-轉運體為陽離子氯共運子(cation chloride cotranspoters,CCCs),在擬南芥中由一個基因編碼,在水稻中則由2個基因編碼。AtCCC在根和莖組織中表達,可能為2Cl-:K+:Na+共轉運體。擬南芥中AtCCC功能缺失導致根:莖Cl-比的改變,但Cl-的凈吸收增加,從而拮抗AtCCC在該離子吸收中的作用[55]。這樣,Cl-吸收的確切機制以及其中的蛋白仍是需要回答的2個問題。
2.3 Cl-通道在液胞Cl-區隔化中的作用

土根邊界Na+的吸收主要通過非選擇性陽離子通道如CNGCs和來自HKT家族的載體完成,在鹽生植物中K+如AKT1也吸收Na+。AtHKT1;1控制莖稈中Na+的積累和Na+從韌皮部返回,HKt2;1介導水稻中Na+的高親和吸收,也參與木質部Na+的承載,HKT1;5位于水稻韌皮部髓細胞,減少木質部Na+濃度進而減少莖中Na+的承載,Na+外流進入液胞和質外體通過逆轉運系統如液胞膜上的NHX1和質膜上的SOS1進行,其機制在物種間具有保守性。SOS1也與其他的逆轉運如CHXs一起介導木質部Na+的承載。氯的吸收和運輸仍未清楚,氯通道(CLCs)可能在氯區隔化進液胞中起作用,氯陰離子共運子(CCCs)可能介導木質部Cl-的承載,Cl-吸收系統的機制和特征未知。
[1]Wild A.Soils,land and food:managing the land during the twenty-first century[M].Cambridge,UK:Cambridge University Press,2003.
[2]Rozema J,Flowers T.Crops for a salinized world[J].Science,2008,322:1478-1480.
[3]Fedoroff N V,Battisti D S,Beachy R N,et al.Radically rethinking agriculture for the 21st century[J].Science,2010,327:833-834
[4]Wu S J,Ding L,Zhu J K.SOS1,a genetic locus essential for salt tolerance and potassium acquisition[J].Plant Cell,1996,8:617-627.
[5]Shi H,Lee B H,Wu S J,et al.Overexpression of a plasma membrane Na+/H+antiporter gene improves salt tolerance inArabidopsisthaliana[J].NatureBiotechnology,2002,21:81-85.
[6]Rodriguez MC,Petersen M,Mundy J.Mitogen-activated protein kinase signaling in plants[J].Annual Review of Plant Biology,2010,61:621-649.
[7]Proft M,Struhl K.MAP kinase-mediated stress relief that precedes and regulates the timing of transcriptional induction[J].Cell,2004,118:351-361.
[8]Nakagami H,Pitzschke A,Hirt H.Emerging MAP kinase pathways in plant stress signalling[J].Trends in Plant Science,2005,10:339-346.
[9]Ichimura K,Mizoguchi T,Yoshida R,et al.Various abiotic stresses rapidly activate Arabidopsis MAP kinases ATMPK4 and ATMPK6[J].Plant Journal,2000,24:655-665.
[10]Teige M,Scheikl E,Eulgem T,et al.The MKK2 pathway mediates cold and salt stress signaling in Arabidopsis[J].Molecular Cell1,2004,5:141-152.
[11]Bargmann B O,Munnik T.The role of phospholipase D in plant stress responses[J].Current Opinion in Plant Biology,2006,9:515-522.
[12]Testerink C,Larsen P B,van der Does D,et al.Phosphatidic acid binds to and inhibits the activity ofArabidopsisCTR1[J].Journal of Experimental Botany,2007,58:3905-3914.
[13]Lee S,Hirt H,Lee Y.Phosphatidic acid activates a wound-activated MAPK inGlycinemax[J].Plant Journal,2001,26:479-486.
[14]Yu L,Nie J,Cao C,et al.Phosphatidic acid mediates salt stress response by regulation of MPK6 inArabidopsisthaliana[J].New Phytologist,2010,188:762-773.
[15]Testerink C,Dekker H L,Lim Z Y,et al.Isolation and identification of phosphatidic acid targets from plants[J].Plant Journal,2004,39:527-536.
[16]Zhang W,Qin C,Zhao J,et al.Phospholipase D alpha 1-Derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling[J].Proceedings of the National Academy of Sciences,USA,2004,101:9508-9513.
[17]Pappan K,Zheng S,Wang X.Identification and characterization of a novel plant phospholipase D that requires polyphosphoinositides and submicromolar calcium for activity inArabidopsis[J].Journal of Biological Chemistry,1997,272:7048-7054.
[18]Alzwiy IA,Morris P C.A mutation in theArabidopsisMAP kinase kinase 9 gene results in enhanced seedling stress tolerance[J].Plant Science,2007,173:302-308.
[19]Peter C Morris.Integrating lipid signalling,mitogen-activated protein kinase cascades and salt tolerance[J].New Phytologist,2010,188:640-643.
[20]Rajendran K,Tester M,Roy S J.Quantifying the three main components of salinity tolerance in cereals[J].Plant,Cell and Environment,2009.32:237.
[21]Tavakkoli E,Rengasamy P,Mcdonald G K.High concentrations of Na+and Cl-ions in soil solution have simultaneous detrimental effects on growth of faba bean under salinity stress[J].Journal of Experimental Botany,2010,61:4449-4459
[22]Kingsbury R,Epstein E.Salt sensitivity in wheat.A case for specific ion toxicity[J].Plant Physiology,1986,80:651-654.
[23]Chi Lin C,Huei Kao C.Relative importance of Na+,Cl-,and abscisic acid in NaCl induced inhibition of root growth of rice seedlings[J].Plant and Soil,2001,237:165-171.
[24]Tsai Y C,Hong C Y,Liu L F,et al.Relative importnace of Na+and Cl-in NaCl-induced antioxidant systems in roots of rice seedlings[J].Physiologia Plantarum,2004,122:86-94.
[25]Hong C Y,Chao Y Y,Yang M Y,et al.Na+but not Cl-or osmotic stress is involved in NaCl-induced expression of glutathione reductase in roots of rice seedlings[J].Journal of Plant Physiology,2009,166:1598-1606.
[26]Amtmann A,Sanders D.Mechanisms of Na uptake by plant cells[J].Advances in Botanical Research,1998,29:75-112.
[27]Tester M,Davenport R.Na+tolerance and Na+transport in higher plants[J].Annals of Botany,2003,91:503-527.
[28]Apse M P,Blumwald E.Na+transport in plants[J].FEBS Letters,2007,581:2247-2254.
[29]Gorham J.Salt tolerance in the Triticeae:ion discrimination in rye and triticale[J].Journal of Experimental Botany,1990,41:609-614.
[30]Kingsbury R,Epstein E.Salt sensitivity in wheat.A case for specific ion toxicity[J].Plant Physiology,1986,80:651-654.
[31]Britto D T,Ruth T J,Lapi S,et al.Cellular and whole-plant chloride dynamics in barley:insights into chloride-nitrogen interactions and salinity responses[J].Planta,2004,218:615-622.
[32]Teakle N L,Tyerman S D.Mechanisms of Cl transport contributing to salt tolerance[J].Plant,Cell and Environment,2010,33:566-589.
[33]Xu G,Magen H,Tarchitzky J,et al.Advances in chloride nutrition of plants[J].Advances in Agronomy,2000,68:97-150.
[34]White P J,Broadley M R.Chloride in soils and its uptake and movement within the plant:a review[J].Annals of Botany,2001,88:967-988.
[35]Winter E.Salt tolerance of Trifolium alexandrinum L.II.Ion balance in relation to its salt tolerance[J].Australian Journal of Plant Physiology,1982,9:227-237.
[36]Rogers M E,Noble C L,Pederick R J.Identifying suitable forage legume species for saline areas[J].Australian Journal of Experimental Agriculture,1997,37:639-645.
[37]Sibole J V,Cabot C,Poschenrieder C,et al.Efficient leaf partitioning,an overriding condition for abscisic acid-controlled stomatal and leaf growth responses to NaCl salinization in two legumes[J].Journal of Experimental Botany,2003,54:2111-2119.
[38]Luo Q,Yu B,Liu Y.Differential sensitivity to chloride and sodium ions in seedlings of Glycine max and G.soja under NaCl stress[J].Journal of Plant Physiology,2005,162,1003-1012.
[39]Teakle N L,Flowers T J,Real D,et al.Lotus tenuis tolerates the interactive effects of salinity and waterlogging by ‘excluding’ Na+and Cl-from the xylem[J].Journal of Experimental Botany,2007,58:2169-2180.
[40]Romero-Aranda R,Moya J L,Tadeo F R,et al.Physiological and anatomical disturbances induced by chloride salts in sensitive and tolerant citrus:beneficial and detrimental effects of cations[J].Plant,Cell and Environment,1998,21:1243-1253.
[41]Moya J L,Gomez-Cadenas A,Primo-Millo E,et al.Chloride absorption in salt-sensitive Carrizo citrange and salt-tolerant Cleopatra mandarin citrus rootstocks is linked to water use[J].Journal of Experimental Botany,2003,54:825-833.
[42]Hajrasuliha S.Accumulation and toxicity of chloride in bean plants[J].Plant and Soil,1980,55:133-138
[43]Lauchli A,Wieneke J Z.Studies on growth and distribution of Na,K and CI in soybean varieties differing in salt tolerance[J].Pflanzenernaehrung Bodenkunde,1979,142:3-13.
[44]Parker M B,Gascho G J,Gaines TP.Chloride toxicity of soybeans grown on atlantic coast flat woods soils[J].Agronomy Journal,1983,75:439-443.
[45]Sanchez D H,Pieckenstain F L,Szymanski J,et al.Comparative functional genomics of salt stress in related model and cultivated plants identifies and overcomes limitations to translational genomics[J].PLOS one,2011,6 (2),e17094
[46]Slabu C,Z?rb C,Steffens D,et al.Is salt stress of faba bean (Viciafaba) caused by Na+or Cl-toxicity?[J].Journal of Plant Nutrition and Soil Science,2009,172:644-650.
[47]Dang Y P,Dalal R C,Mayer D G,et al.High subsoil chloride concentrations reduce soil water extraction and crop yield on vertisols in north-eastern Australia[J].Australian Journal of Agricultural Research,2008,59:321-330.
[48]Dang Y P,Dalal R C,Routley R,et al.Subsoil constraints to grain production in the cropping soils of the north-eastern region of Australia:an overview[J].Australian Journal of Experimental Agriculture,2006,46:19-35.
[49]Tavakkoli E,Fatehi F,Coventry S,et al.Additive effects of Na+and Cl-ions on barley growth under salinity stress[J].Journal of Experimental Botany,2011,62(6):2189-2203
[50]Hasegawa P M,Bressan R A,Zhu J K,et al.Plant cellular and molecular responses to high salinity[J].Annu Rev Plant Physiol Mol Biol,2000,51:463-499.
[51]Mian A A,Senadheera P,Maathuis F J M.Improving crop salt tolerance:anion and cation transporters as genetic engineering targets[J].Plant Stress,2011,5(Special Issue 1):64-72
[52]Flower T J,Colmer T D.The mechanism of salt tolerance in plant[J].New Phytologist,2002,179:945-963.
[53]Hechenberger M,Schwappach B,Fisher W N,et al.A family of putative chloride channel fromArabidopsisand functional complementation of a yeast strain with aCLCgene disruption[J].Journal of Biological Chemistry,1996,271:33632-33638.
[54]Diédhiou C J,Golldack D.Salt-dependent regulation of chloride channel transcript in rice[J].Plant Science,2006,170:793-800.
[55]Colmenero-Flores J M,Martinez G,Gamba G,et al.Identification and functional characterization of cation-chloride cotransporters in plant[J].The Plant Journal,2007,50:278-292.
[56]De Angeli A,Thomine S,Frachisse J M,et al.Anion channels and transporters in plant cell membranes[J].FEBS Letters,2007,581:2367-2374.
[57]Diédhiou C J.Mechanisms of salt tolerance:sodium,chloride and potassium homeostasis in two rice lines with differenct tolerance to salinity stress[D].Germany:University of Bielefeld,2006.
[58]Li W Y F,Wong F L,Tsai S N,et al.Tonoplast-located GmCLC1 and GmNHX1 from soybean enhance NaCl tolerance in transgenic bright yellow (BY)-2 cells[J].Plant,Cell and Environment,2006,29:1122-1137.
[59]Nakamura A,Fukuda A,Sakai S,et al.Molecular cloning,functional expression and subcellular localization of two putative vacuolar voltage-gated chloride channels in rice (OryzasativaL.)[J].Plant Cell Physiology,2006,47:32-42.
2012-08-22
江蘇省自主創新基金項目。
崔世友(1964-),男,江蘇海安人,博士,研究員,研究方向為分子遺傳與作物育種、鹽土農業。
10.3969/j.issn.1673-1409(S).2012.10.005
Q945.78
A
1673-1409(2012)10-S017-06

