氨肟化反應中雙氧水分解的影響因素探討
李紅梅
(中國石油化工股份有限公司巴陵分公司,湖南岳陽414003)
氨肟化反應中雙氧水分解的影響因素探討
李紅梅
(中國石油化工股份有限公司巴陵分公司,湖南岳陽414003)
在實驗裝置上對環己酮氨肟化反應體系中引發雙氧水分解的因素進行了分析,將實驗結果應用于工業化生產。結果表明:在氨肟化反應體系中,氨過量導致的堿性環境、雙氧水過量加入或氨肟化反應不完全是雙氧水分解的主要原因;反應溫度、反應時間等反應條件的變化可改變雙氧水的分解速度;微量的銅、鐵、鉻等金屬離子的存在會加速雙氧水的分解;適當控制氨濃度、環己酮∶雙氧水摩爾比、反應條件及降低金屬離子含量有利于提高雙氧水的有效利用率;在工業生產裝置中,控制反應液中氨質量分數2.0% ~2.8%,環己酮∶雙氧水摩爾比為1∶(1.05~1.10),反應溫度78~81℃,催化劑(相對于環己酮)質量分數小于4%,雙氧水利用率提高了3.7%。
雙氧水 分解 環己酮 氨肟化
環己酮肟是生產己內酰胺的中間體,90%的己內酰胺產品都由其重排而得。目前,環己酮肟工業化生產的主流工藝是環己酮-羥胺路線,存在著中間步驟多,工藝復雜,副產品多,三廢多等缺點。相比之下,環己酮氨肟化制環己酮肟工藝具有流程短、反應條件溫和、副產物少以及利于環保的特點[1]。
中國石油化工股份有限公司巴陵分公司(簡稱巴陵公司)于2003年7月建立了一套70 kt/a環己酮氨肟化工業裝置,過氧化氫(即雙氧水)消耗一直較高,主要原因是雙氧水在反應過程中存在較為明顯的分解副反應,雙氧水的有效利用率只有83%~88%,從而導致己內酰胺制造成本較高。根據氨肟化反應原理可知,雙氧水在氨肟化反應體系中作為氧化劑參與反應,雙氧水濃度及進料量對整個反應起著至關重要的影響[2],決定了氨肟化反應中環己酮轉化率和環己酮肟選擇性。而雙氧水的無效分解不但增加了生產成本,并且由于其分解產生的氧氣在一定條件下能與可燃蒸氣或氣體形成爆炸性混合物。因此,在氨肟化反應中應避免雙氧水的分解反應。作者在實驗裝置上對影響雙氧水利用率的反應溫度、反應物配比、體系酸堿度、催化劑等因素進行了分析,為提高雙氧水的有效利用率提供依據。
1 實驗
1.1 原料及試劑
雙氧水:分析純,北京化工廠產;氨水:分析純,北京益利精細化學品有限公司產;環己酮:質量分數99.88%,巴陵公司環己酮事業部產;叔丁醇:質量分數85%,北京平順化工廠生產。TS-l工業催化劑:Si與Ti的摩爾比為33,粒徑為0.2~0.8 μm ,巴陵公司提供。
1.2 設備及儀器
氨肟化小試實驗裝置:自建;SP3420氣相色譜儀:北京分析儀器廠制;TG16-WS高速離心機:湘儀離心機廠制。
1.3 實驗方法
環己酮氨肟化反應實驗在體積為250 mL、帶冷凝器的三口燒瓶中進行,水浴加熱,磁力攪拌。將鈦硅分子篩(TS-1)、叔丁醇、環己酮和氨水一次加入反應器中,待反應物料溫度升至反應溫度后再連續加入雙氧水。反應條件為:反應溫度50~85℃,反應壓力0.3 MPa,催化劑質量分數3.7%(相對于環己酮);反應原料環己酮∶氨∶雙氧水∶叔丁醇摩爾比為1∶(1~2)∶(0.80~1.35)∶(2 ~5)。
1.4 分析測試
有機物含量:反應液經高速分離后取上層清液采用氣相色譜分析有機物含量。
雙氧水含量:采用間接碘量法測定反應液中的雙氧水含量。
氨含量:采用化學滴定法分析。
氣體組成:采用氣相色譜分析,利用porapark Q、Porapark R固定相制備色譜柱,用外標法定量計算氣體組成。
2 結果與討論
2.1 反應液中氨含量
氨肟化反應中反應物氨、雙氧水及環己酮按等摩爾比進行反應,在TS-1催化作用及操作條件正常的情況下,環己酮轉化率和環己酮肟選擇性均較高,尾氣中氨及氧含量維持較低水平。實際生產中,為了維持較高的環己酮轉化率及環己酮肟的選擇性[2],采取增加溶液中氨含量的方法,使反應液呈堿性,而堿性環境對雙氧水的異裂分解起到催化作用。
由表1可見,隨著反應液中氨含量的升高,環己酮的轉化率和環己酮肟的選擇性都有所升高,雙氧水分解率略有下降,但是當反應液中氨質量分數大于3.08%時,環己酮肟選擇性和收率增長并不明顯,繼續升高反應液氨含量,環己酮肟收率反而略有下降,而雙氧水分解率則明顯升高,雙氧水的有效利用率降低。這主要是因為反應液中適當過量的氨能使氨肟化主反應轉化率及環己酮肟收率增加,從而使雙氧水分解率下降,但氨含量過高時導致反應環境堿度增加,雙氧水異裂分解速度加快,這也說明反應液過高的氨含量只會增加氨及雙氧水的消耗。
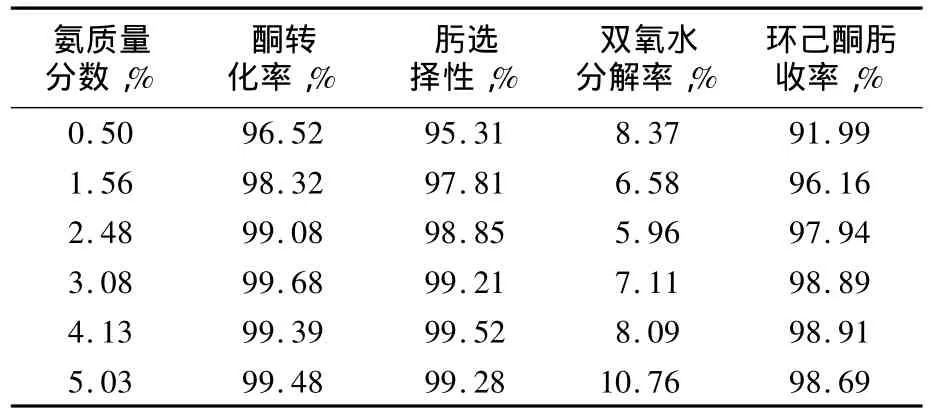
表1 氨含量對雙氧水分解的影響Tab.1 Effect of ammonia content on hydrogen peroxide decomposition
2.2 反應物配比
當反應中雙氧水過量加入或催化劑失活等原因引起的反應不完全時,多余部分的雙氧水迅速分解,且會增加與反應中生成的羥胺發生副反應,降低環己酮肟收率,因此應合理控制雙氧水的加入量,既要保證環己酮轉化率,又要避免過度的雙氧水分解副反應。由表2可見,隨著反應體系中雙氧水用量的增加,反應轉化率、選擇性及環己酮肟收率均增加,但雙氧水分解率也上升,尤其是當環己酮∶雙氧水摩爾比為1∶1.25時,對于肟化反應來說,雙氧水大量過量,酮轉化率也略微增加,但過氧化氫分解率增加明顯,由此可見,環己酮∶雙氧水摩爾比不宜小于1∶1.1;當環己酮∶雙氧水摩爾比高于1時,酮轉化率偏低,而且雙氧水也有一定的分解,因此生產中應將環己酮∶雙氧水摩爾比控制在1∶(1.05~1.1)。過量的雙氧水在堿性條件下快速分解生產氧氣,與氣相的氨氣、叔丁醇蒸汽形成爆炸性混合物,遇火源(靜電)就可發生空間閃爆。因此,在控制反應物配比時,也應密切關注反應體系催化劑狀況。
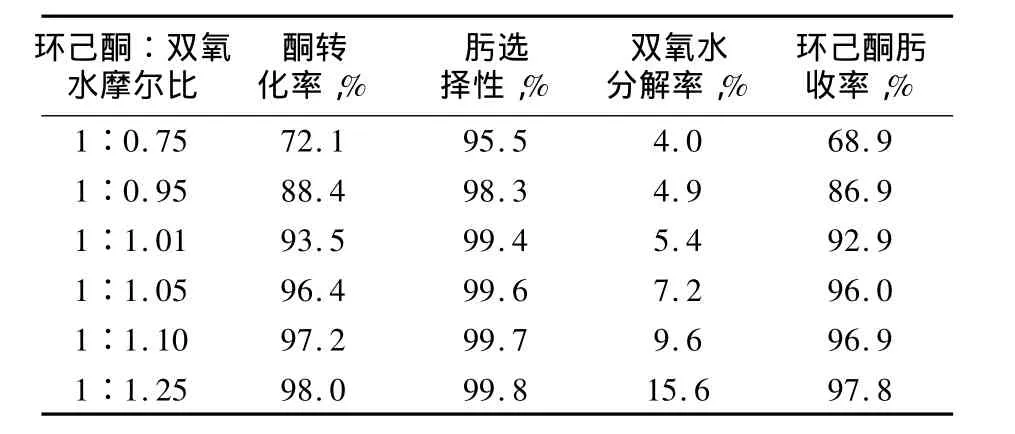
表2 環己酮/雙氧水摩爾比對雙氧水分解的影響Tab.2 Effect of cyclohexanone/hydrogen peroxide mole ratio on hydrogen peroxide decomposition
2.3 反應溫度
由表3可見,隨著反應溫度的升高,反應轉化率、選擇性及環己酮肟收率均增加,雙氧水有效利用率也上升,但當溫度增加至85℃以上時,雙氧水有效利用率開始下降。
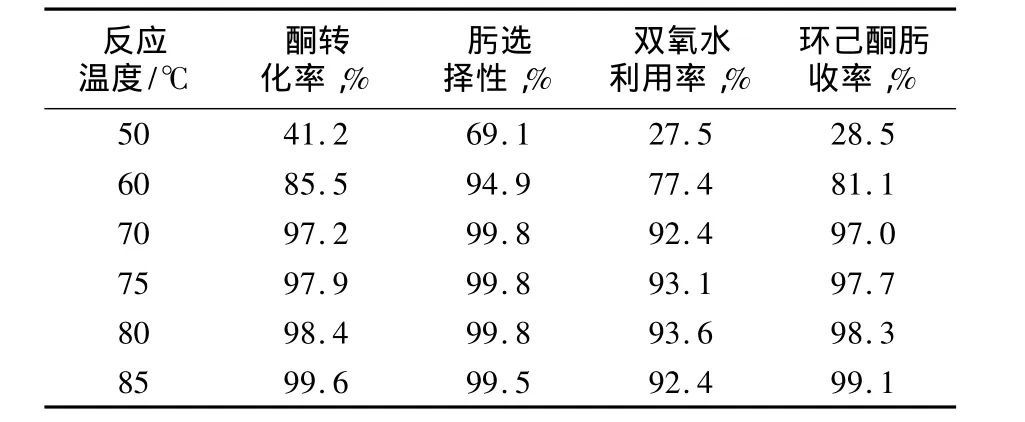
表3 反應溫度對雙氧水分解的影響Tab.3 Effect of reaction temperature on hydrogen peroxide decomposition
這是因為溫度較低時,TS-1催化活性較低,雙氧水主要發生分解副反應,當反應溫度升高至80℃時,TS-1催化活性及選擇性均較高,反應系統中的雙氧水主要用于生成環己酮肟的反應[3],當溫度繼續升高時,由于催化劑的活性達到極致,而雙氧水分解隨溫度升高而快速增加。因此,雙氧水利用率反而開始下降。
2.4 金屬離子
反應液中微量的錳、鋅、銅、鐵、鎳等金屬離子的存在能催化雙氧水的分解,其中以銅最為明顯[4],實驗增加考察了pH值對雙氧水分解的影響。在100 mL三口玻璃反應器中進行實驗,維持等溫和強烈攪拌,先加入雙氧水,然后依次改變金屬離子、pH值及溫度等條件。
由表4可知,沒有金屬離子存在的條件下,雙氧水的分解率很低,在加入金屬離子后雙氧水的分解明顯加劇。由表4也可看出,不同的金屬離子對雙氧水的催化作用差別較大,以銅離子的影響最為明顯。
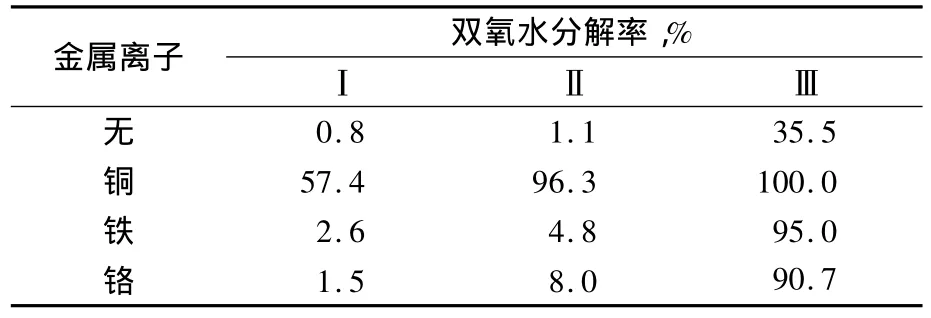
表4 金屬離子對雙氧水分解的影響Tab.4 Effect of metal ion on hydrogen peroxide decomposition
當pH值為11時,即使分解溫度控制在50℃時,金屬離子對雙氧水的催化分解作用明顯強于中性環境下的,而氨肟化反應在堿性環境下(pH為10~12)進行,因此應嚴格控制反應系統中金屬離子尤其是銅離子含量。
2.5 雙氧水濃度
雙氧水濃度的影響分為兩方面,一是加入氨肟化反應體系的原料雙氧水濃度,二是反應液中殘留雙氧水濃度。
張志剛[5]、許志忠[6]等的研究表明,質量分數為30%的雙氧水初始熱分解溫度為34.5℃,雙氧水分解速率隨著濃度的升高而增大。正常條件下,氨肟化反應器為連續釜式全混反應器,各物料濃度均勻,體系中雙氧水濃度很低,一般小于0.2%,不會對雙氧水分解率造成影響。當氨肟化催化劑失活或物料配比失調導致雙氧水殘留濃度升高,此時原料雙氧水濃度高低對氨肟化裝置的安全影響大,高濃度的原料雙氧水安全隱患更大,同時在催化劑使用周期的末期,出現雙氧水殘留濃度增加而使雙氧水分解量上升。因此,在氨肟化體系中,應該合理控制雙氧水濃度,避免因濃度過高而造成雙氧水分解副反應。
根據雙氧水在反應體系濃度的變化規律可知,較為緩和的反應條件更有利于降低雙氧水分解副反應。因此,在不影響轉化率和選擇性的前提下,可通過延長反應時間來提高雙氧水利用率。
2.6 催化劑濃度
由圖1可見,在氨肟化反應體系中當催化劑質量分數(相對于環己酮)為4%左右時,反應尾氣中氧含量變化較小,但隨著催化劑質量分數上升至5%時,氨肟化反應后尾氣中氧含量明顯上升,而尾氣氧含量的上升說明雙氧水的分解反應加快,即在氨肟化反應體系中,當催化劑質量分數大于4%以后,催化劑濃度的增加可明顯加快雙氧水的分解反應,這種現象與文獻[7]相符,出現這種現象的原因是氨肟化工業催化劑中銳鈦礦的含量很低,在氨肟化反應體系中,只有當催化劑濃度較高時,催化劑中的銳鈦礦含量達到一定水平時才會催化雙氧水的分解反應。
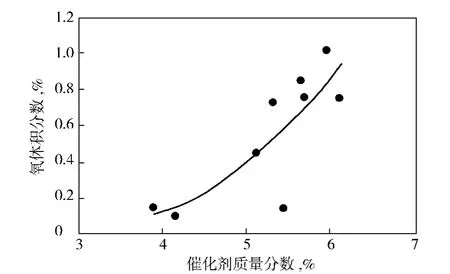
圖1 催化劑濃度與尾氣中氧含量的關系Fig.1 Relationship between catalyst concentration and oxygen content of tail gas
2.7 工業化生產
根據上述實驗結果,在氨肟化反應環境中,反應液氨含量、反應物配比以及反應溫度是影響雙氧水分解率的主要因素。提出以下改進措施,指導工業化生產,控制氨肟化反應體系中雙氧水的分解反應,提高其有效利用率。
(1)控制反應液中氨質量分數在2.0% ~2.8%時,提高雙氧水的有效利用率。
(2)控制環己酮∶雙氧水的摩爾比在1∶(1.05~1.10)為宜。另外,當催化劑失活或其他原因引起反應不完全時應馬上停車處理,避免反應物配比失調。
(3)控制反應溫度應在78~81℃為宜,保證反應效果,并提高雙氧水的有效利用率。
(4)加強對原料中金屬離子的分析控制,控制原料雙氧水濃度的穩定,避免反應體系雙氧水濃度升高。
(5)合理控制催化劑濃度或降低催化劑中銳鈦礦含量,控制催化劑質量分數小于4%。
改進效果見表5。

表5 改進前后雙氧水消耗對比Tab.5 Hydrogen peroxide consumption contrast before and after reformation
通過對氨肟化反應條件優化,氨肟化裝置生產環己酮肟對雙氧水的單耗由原來的1 300 kg/t降低至1 245 kg/t,雙氧水的利用率由原來的84.2%提高到 87.9%,上升了 3.7%。
3 結論
a.在氨肟化反應體系中,引起雙氧水分解的主要原因是氨過量導致的堿性環境、雙氧水過量加入或雙氧水濃度過高以及氨肟化反應不完全,反應溫度、反應壓力及微量的銅、鐵、鉻等金屬離子都會影響雙氧水的分解。
b.控制適當的氨濃度及環己酮∶雙氧水摩爾比、反應條件以及降低金屬離子含量有利于提高雙氧水的有效利用率。
[1]趙虹,周繼承.TS-1催化環己酮氨氧化反應本征動力學模型[J].化工學報,2004,55(4):575 -579.
[2]羅樂.蒽醌法雙氧水生產裝置的危險性和預防措施[J].化工技術與開發,2007,36(3):110 -113.
[3]張向京.鈦硅分子篩TS-1催化環己酮氨肟化過程分析[D].天津:天津大學,2006.
[4]張健揚,史淑鳳,崔海香,等.金屬離子對過氧化氫的催化分解作用研究[J].唐山師范學院學報,2005,27(5):10-13.
[5]張志剛,蔣慧靈,黃平.雙氧水爆炸事故機理分析及預防措施研究[J].安全與環境學報,2007,7(4):108-110.
[6]許志忠,李曉春.雙氧水分解影響因素分析[J].染整技術,2006,28(1):33 -36.
[7]宋芬,劉月明,王玲玲,等.加料方式及底物濃度對Ti-MWW催化劑上環己酮氨肟化反應的影響[J].催化學報,2006,27(7):562-566.
Influential factors on hydrogen peroxide decomposition in ammoxiation
Li Hongmei
(SINOPEC Baling Company,Yueyang414003)
The influential factors on hydrogen peroxide decomposition were analyzed during cyclohexanone ammoxiation process on an experimental unit.The experimental results was applied in commercial production.The results showed that for ammoxiation reaction system,the principal factors causing the hydrogen peroxide decomposition did not exclusively comprise the alkaline condition in presence of excessive ammonia,excessive hydrogen peroxide and incomplete ammoximation;the reaction conditions including reaction temperature and time could change the decomposition rate of hydrogen peroxide;the existence of metal ions like trace copper,iron and chromium accelerated the hydrogen peroxide decomposition;and the reasonable control of ammonia content,cyclohexanone/hydrogen peroxide mole ratio,reaction conditions and metal ion content was helpful to improving the effective availability of hydrogen peroxide.The availability of hydrogen peroxide was improved by 3.7%in commercial production when the reaction conditions were controlled as followed:ammonia mass fraction 2.0% -2.8%,cyclohexanone∶hydrogen peroxide mole ratio 1∶(1.05 -1.10),reaction temperature 78 -81℃,catalyst mass fraction below 4%based on cyclohexanone.
hydrogen peroxide;decomposition;cyclohexanone;ammoxiation
TQ234.21
A
1001-0041(2012)04-0034-04
2012-01-20;修改稿收到日期:2012-06-05。
李紅梅 (1964—),女,工程師,主要從事化工生產工藝管理工作。E-mail:lihm.blsh@sinopec.com。

