納米抗體的特性及其應用研究進展
郭 婷,張宇昊,2,馬 良,3,*
(1.西南大學食品科學學院,重慶 400716;2.重慶市特色食品工程技術研究中心,重慶 400716;3.農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400716)
納米抗體的特性及其應用研究進展
郭 婷1,張宇昊1,2,馬 良1,3,*
(1.西南大學食品科學學院,重慶 400716;2.重慶市特色食品工程技術研究中心,重慶 400716;3.農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400716)
納米抗體與傳統IgG抗體相比,具有分子質量小、更容易被生產、穩定性好、抗原結合力高等特點,目前在醫學、食品科學等很多方面展開了積極有效的研究和應用。本文重點就納米抗體的結構、特性和在食品科學領域的應用進行綜述和分析,并對納米抗體在食品檢測方面的應用前景進行展望。
納米抗體;特性;食品;應用
基于抗原-抗體特異性反應的免疫分析技術因其操作簡單、準確性高、檢測速度快等特點,近些年發展迅猛,在食品安全檢測領域中發揮著越來越重要的作用。目前免疫分析法主要利用單克隆抗體、多克隆抗體等來實現真菌毒素、農獸藥殘留、食品添加劑、非法添加物等各種食品危害物的檢測。單克隆抗體的特異性強,容易純化、標記。但其制備復雜、價格較昂貴[1-2],不能進行沉淀和凝膠反應[1-3],應用范圍受到一定限制。多克隆抗體的反應強度大,與抗體的親和力和靈敏度相對較高,但特異性相對較低,在檢測中很容易出現假陽性現象。目前,小分子功能抗體作為免疫學研究的熱點[3],主要有Fab片段(L和Fd)、Fv(VH和VL)、ScFv、納米抗體等。與其他小分子功能抗體相比,納米抗體的親和力高、穩定性好,更易制備成穩定的融合子,有較大的發展潛力。
生物學家Ward在1989年分離檢測駱駝血清中抗體時發現,駱駝血液中除常規的四鏈抗體外,還有一些僅含重鏈的抗體。1993年,Hamers-Casterman等[4]研究表明,駱駝抗體天然缺失輕鏈,只含有重鏈,因此又稱重鏈抗體(heavy chain antibodies,HCAbs)。另有研究者[5]發現,駱駝抗體中還缺少CH1。克隆重鏈抗體的可變區得到只由一個重鏈可變區組成的單域抗體,稱為VHH抗體(variable domain of heavy chain of heavy-chain antibody,VHH)。VHH晶體直徑2.5nm,長4nm,因此又稱為納米抗體(nanobody,Nb)[6-7],是自然存在的可與抗原結合的最小片段。納米粒子具有的顆粒尺寸小、比表面積大、表面能高等特點,以及表面效應、尺寸效應和宏觀量子隧道效應[8]使得納米抗體在諸多方面均優于傳統抗體。納米抗體在疾病的檢測和治療方面有顯著應用成果[9-11],而在食品領域的應用處于起步階段,今后將在食品工業及檢測方面發揮巨大的作用。本文主要針對納米抗體的特性和在食品科學領域中的應用進行綜述和分析,對納米抗體在食品檢測方面的應用前景進行展望。
1 納米抗體的結構
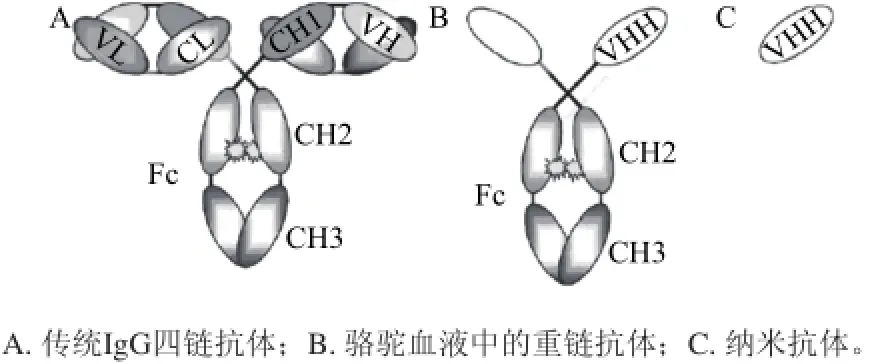
圖1 抗體結構模式圖[7]Fig.1 Antibody structure[7]
納米抗體(圖1C)一般結構呈橢圓形,體積很小,分子質量為單克隆抗體的1/10(15kD)[12],與普通抗體(圖1A)相比,化學性質更加活潑,具有納物質的量級親和力,能更有效地與抗原縫隙結合[13]。納米抗體的基因組中存在恒定區(constant region of heavy chain 1,CH1),它是輕鏈錨定的部位,但在mRNA形成中被剪切掉,所以納米抗體缺乏輕鏈[5]。納米抗體的二級結構是2個β片層形成支架,3個高變區聚集在一側參與抗原識別。與駱駝的重鏈抗體相比,納米抗體僅由重鏈可變區組成。而駱駝的重鏈抗體(圖1B)含有一個鉸鏈區,兩個恒定區(CH2和CH3)和獨特的重鏈可變區(VHH)。
駱駝源VHH(即Nb)和人體VH的基因同源性達到80%~90%[14],結構十分相似,都包含3個高變區(hypervariable region,HVR)和4個骨架區(framework region,FR)。通過比較發現,駱駝VHH 與人體VH之間存在微小但不容忽視的區別,主要包含兩方面:1)它們的互補決定區(complementarity determining region,CDR)不同。VHH的CDR1和CDR3比VH更長。VHH的CDR3長度為16~18個氨基酸,而人和小鼠VH的平均長度分別只有14和12個氨基酸[15-17]。2)它們的區別在于FR2中的氨基酸[18]。普通抗體的FR2中V37、G44、L45和W47這4個氨基酸殘基是疏水性殘基,在進化中是相當保守的[15]。而VHH中,它們突變為親水性的氨基酸殘基F37、E44、R45、G47,增加了VHH的溶解性[15](圖2)。因此,將人源抗體VH結構域FR2中的一些氨基酸進行VHH特征性改造,可以獲得穩定性好、溶解性好,并且保持原有抗體特異性和親和力的VH 抗體[19]。目前,人源化已經取得成功[14]。

圖2 人源VH和駱駝源VHH基因序列[7]Fig.2 Gene sequences of human VH and camel VHH[7]
2 納米抗體的特性
2.1 理化性
納米抗體在許多理化性質方面具有三方面的明顯優勢:1)Nb溶解性高。由于Nb的FR2中一些親水性氨基酸取代疏水性氨基酸,使Nb的溶解性增加,從而提高作為藥物的利用率。2)Nb抗熱性強。研究發現,在37℃放置1周后Nb仍能保持80%以上的生物活性,這使其在室溫條件下更易于使用和保存[20-21]。然而單鏈抗體的穩定性差,常常顯示聚集傾向,在37℃產生聚集現象[22],大大限制了其應用。Nb內部存在二硫鍵是其抗熱性強的主要原因[23]。3) Nb易復性。在高于90℃的環境中長期放置,Nb仍能重新獲得生物活性[24-25]。同時,Nb在強變性劑的條件下也表現出較高的耐受性[26]。其他抗體則發生不可逆的熱聚合[18]。2.2 抗原結合性
納米抗體有較高的抗原結合力和目標親和力。Nb包含了骨架區的氨基酸殘基,在一定程度上彌補缺失輕鏈造成的抗原結合力低的不足;同時Nb的CDR3較長,形成穩定的凸形結構,可深入抗原內部更好地結合抗原。普通抗體只能識別抗原表面的位點。因此Nb的抗原結合能力更廣泛,不僅可結合小分子半抗原和肽,還可結合大分子蛋白和病毒,甚至當識別位點被深入包埋時,小分子的Nb也可對其進行表位識別[27]。
2.3 免疫原性
納米抗體對人體的免疫原性弱,生物相容性好。免疫原性是指能夠刺激機體形成特異性抗體或致敏淋巴細胞的能力。免疫原性與分子大小、化學結構等有關,分子質量越小免疫原性越小。Nb分子質量很小,只有一個結構域,缺少Fc段,從而避免了Fc段引起的補體反應,對人體的免疫原性很低。在動物實驗中,納米抗體未引起任何體液和細胞免疫應答[28]。因此,可通過帶有人VH FR2烙印的納米抗體來獲得非免疫原性納米抗體。但有研究表明,納米抗體作為藥物長期反復使用會增加免疫原性,影響治療[29]。
2.4 穿透性
相對單克隆抗體顯影劑組織穿透力差、不易清除的不足[30],納米抗體的組織穿透能力很強,可以進入致密的組織,并且多余未結合的納米抗體能夠被快速清除,有利于疾病的診斷。Cortez-Retamozo等[31]制備的納米抗體顯影劑穿透性好、親和力高、腫瘤組織的顯像效果好,并且對正常組織幾乎沒有損傷。近期報道[32],納米抗體用于分子顯像會強烈地滯留在腎臟中,影響胰臟附近檢測分子信號的靈敏度。用18F標記的納米抗體的腎臟滯留量最小(<7%)[33]。另有研究[34]表明,納米抗體能夠有效地穿透血腦屏障,為腦部供藥提供新方法。
2.5 生產性
納米抗體的分子質量小、結構簡單,能被單個基因編碼,利用基因工程能在酵母菌、大腸桿菌等微生物中大量表達。納米抗體相對價格低廉、可進行大規模生產,易于普及和應用。涂追等[35]利用半巢式PCR法構建天然噬菌體單域重鏈抗體文庫,文庫的多樣性較好,可以用于后續淘汰。Ablynx公司表示,他們將酵母反應器釀造納米抗體的產量提高,達到0.5g/L的產量[31]。
3 納米抗體在食品科學領域的應用
納米抗體具有普通抗體沒有的獨特性質,對其進行基因改造,使其攜帶特定的結構,在疾病的診斷與治療上比其他抗體更有優勢,近幾年在這些方面的應用報道逐年增多。而納米抗體在食品科學領域,如食品毒理學研究、食品分析檢測等方面的研究和應用較晚,但已成為新的研究熱點。尤其是近兩年涌現出不少研究和應用成果,顯示出納米抗體在該領域應用的巨大潛力。
3.1 食物中毒的解毒
食品毒理學研究表明,Nb能與細菌結合,抑制細菌產酶的活性,從而起到一定的治療作用。此外,Nb還可以中和細菌毒素、蛇蝎毒素。Hmila等[36]篩選出抗蝎子毒素Aa2hI’的Nb,這種抗體可以高效中和AahI’毒素,用于解毒。
3.2 食品污染物的脫毒
研究表明,應用納米粒子的表面效應可對飼料中AFT進行脫毒處理,能有效降低AFT的危害[37]。納米抗體是一種納米粒子,具有納米粒子的三大效應,即表面效應、尺寸效應、宏觀隧道量子效應。因此可以運用納米抗體的表面效應進行食品及原料中污染物的脫毒研究。
3.3 食品檢測
納米抗體屬于新型抗體,在國內外食品檢測方面研究和應用相對較晚,尤其是國內相關的研究和應用報道較少。但隨著納米抗體等小分子功能抗體自身優勢不斷體現,近些年研究逐漸增多,2010—2011年國內相關研究機構相繼報道了一批有關小分子功能抗體的研究結果,充分顯示了納米抗體等小分子功能抗體巨大的應用前景。
據報道[38-39]江南大學制備出抗黃曲霉毒素B1的小分子功能抗體ScFv片段,利用該ScFv片段檢測醬油中的黃曲霉毒素B1
[40]。管笛等[41]制備出AFM1標準品的無毒替代物F(ab')片段,也屬于小分子功能抗體,并將其用于花生樣品檢測。另有學者制備出各種小分子功能抗體,如抗克倫特羅ScFv片段[42-43]、抗有機磷ScFv片段[44]、抗氨基甲酸酯ScFv片段[45]等,這些片段可用于建立針對小分子物質的非競爭性免疫檢測,具有分子質量小、穿透力強、免疫原性低等優點。然而,有研究[22,46]發現上述片段仍存在穩定性相對較差、親和性較低等缺點,限制了其在食品檢測方面的應用。
2009年,Kirchhofer等[47]篩選出能調節綠色熒光蛋白(GFP)構象及光譜性質的納米抗體。名為Enhancer的納米抗體與GFP結合,使熒光效果增強5倍;而名為Minimizer的納米抗體使蛋白的某特定區遠離發光區,從而使熒光效果降低5倍。該研究表明,Nb可以在體內或體外控制蛋白構象。目前,研究人員正在篩選與其他熒光蛋白特異的納米抗體。利用納米抗體增強熒光強度來提高食品檢測的靈敏性,有重要的現實意義。另外,Muyldermans等[8]重組Nb,將其作為生物傳感器的探針。在食品工業中可利用探針能與待測物質特異性結合的性質來檢測食品中的有毒有害物質。
4 結 語
納米抗體的穩定性好、親和力較高,克服了小分子功能抗體的缺點,同時又具有分子質量小、免疫原性弱、組織穿透力強等單克隆抗體、多克隆抗體不具備的優點,適應用于食品檢測、疾病治療等方面。在食品免疫及相關檢測方面還有待于進一步深入地研究和應用,經過綜述與分析,在以下3個領域極具開發和研究潛力:1)利用細胞工程技術、基因工程技術等新型技術,構建基于納米抗體的雙功能抗體,與兩種性質不同的抗原發生結合,在多殘留檢測、天然噬菌體單域重鏈抗體文庫構建等方面發揮重要的作用。2)利用納米抗體對組織穿透力強和對靶位點的親和力高的特點,進入致密組織,檢測被深入包埋的物質,實現肉制品、蛋制品、乳制品、餅粕飼料等各種復雜基質食品中非法添加物和小分子污染物等的高靈敏度檢測。3)利用納米抗體控制熒光蛋白的熒光特性,選擇性增強或猝滅熒光,用熒光探針技術提高毒素、農獸藥殘留物等物質的分析檢測靈敏度。
[1] 吳石金, 孫培龍. 簡明免疫學原理[M]. 北京: 化學工業出版社, 2008: 173.
[2] 馮仁青, 郭振泉. 現代抗體技術及其應用[M]. 北京: 北京大學出版社, 2006: 55-76.
[3] 胡圣堯. 免疫學與生物技術[M]. 北京: 人民衛生出版社, 2003: 61.
[4] HAMERS-CASTEMAN C, ATARHOUCH T, MUYLDEMANS S, et al. Naturally occurring antibodies devoid of light chains [J]. Nature, 1993, 363: 446-448.
[5] NGUYEN V K, HAMERS R, WYNS L, et al. Loss of splice consensus signal is responsible for the removal of the entire CH1 domain of the functional camel IGG2A heavy-chain antibodies[J]. Mol Immunol, 1999, 36(8): 515-524.
[6] 楊珂, 王冬. 納米抗體及其應用[J]. 細胞與分子免疫學雜志, 2008(4): 425-427.
[7] MUYLDERMANS S, BARAL T N, CORTEZ RETAMOZZO V, et al.Camelid immunoglobulins and nanobody technology[J]. Veterinary Immunology and Immunopathology, 2009, 128: 178-183.
[8] 李國秀, 李建科. 納米技術在食品領域中的應用[J]. 糧食與油脂, 2007(8): 13.
[9] SKOTTRUP P D, LEONARD P, KAZMAREK J Z, et al. Diagnostic evaluation of a nanobody with picomolar affinity toward the protease RgpB from Porphyromonas gingivalis[J]. Analytical Biochemistry, 2011, 415: 158-167.
[10] ABBADY A Q, al-MARIRI A, ZARKAWI M, et al. Evaluation of a nanobody phage display library constructed from a Bruella-immunised camel[J]. Veterinary Immunology and Immunopathology, 2011, 142: 49-56.
[11] STEYAERT J, KOBILA K. Nanobody stabilization of G proteincoupled receptor conformational states[J]. Current Opinion in Structural Biology, 2011, 21: 567-572.
[12] MUYLDERMANS S, LAUWEREYS M. Unique single-domain antigen binding fragments derived from naturally occurring camel heavy-chain antibodies[J]. Mol Recognit, 1999, 12: 1-10.
[13] de GENST E, SILENCE K, DECANNIERE K, et al. Molecular basis for the preferential cleft recognition by dromedary heavy-chain antibodies[J]. PNAS, 2006, 103: 4586-4591.
[14] VINCKE C, LORIS R, SAERENS D, et al. General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold[J]. J Bio Chem, 2009, 284: 3273-3284.
[15] MUYLDERMANS S, ATARHOUCH T, SALDANHA J, et al. Sequence and structure of VH domain from naturally occurring camel heavy chain immunoglobulins lacking light chains[J]. Protein Eng, 1994, 7(9): 1129-1135.
[16] VU K B, GHAHROUDI M A, WYNS L et al. Comparison of llama VH sequences from conventional and heavy chain antibodies[J]. Mol Immunol, 1997, 34: 1121-1131.
[17] WU T T, JOHNSON G, KABAT E A. Length distribution of CDR H3 in antibodies[J]. Proteins: Struct Funct Genetics, 1993, 16: 1-7.
[18] NGUYEN V K, DESMYTER A, MUYLDERMANS S, et al. Functional heavy-chain antibodies in Camelidae[J]. Adv Immunol, 2001, 79: 261-296.
[19] DAVIES J, RIECHMANN L. Camelising human antibody fragments: NMR studies on VH domains[J]. FEBS Letters, 1994, 339(3): 285-290.
[20] GHAHROUDI M A, DESMYTER A, WYNS L, et a1. Selection and identification of single domain antibody fragments from camel heavychain antibodies[J]. FEBS Lett, 1997, 414: 521-526.
[21] van der LINDEN R H, FRENKEN LG, de GEUS B, et al. Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonaI antibodies[J]. Biochim Biophys Acta, 1999, 1431: 37-46.
[22] 秦海燕, 毛曉燕, 喬玉玲, 等. 單鏈抗體的研究進展[J]. 現代生物醫學進展, 2011, 11(4): 795-797.
[23] 王更如, 姜廣水. 納米抗體的研究進展[J]. 現代免疫學, 2010, 30(1): 73-77.
[24] PéREZ J M J, RENISIO J G, PROMPERS J J, et al. Thermal unfolding of a llama antibody fragment: a two-state reversible process[J]. Biochemistry, 2001, 40: 74-83.
[25] EWERT S, CAMBILLAU C, CONRATH K, et al. Biophysical properties of camelid VHH domains compared to those of human VH3 domains[J]. Biochemistry, 2002, 41: 3628-3636.
[26] DUMOULIN M, COURATH K, van MEIRHAEQHE A, et al. Single domain antibody fragments with high conformational stability[J]. Protein Sci, 2002, 11(3): 500-515.
[27] STIJLEMANS B, CONRATH K, CORTEZ-RETAMOZO V, et al. Efficient targeting of conserved cryptic epitopes of infectious agents by single-domain antibodies. African trypanosomes as a paradigm[J]. J Biol Chem, 2004, 279(2): 1256-1261.
[28] CORTEZ-RETAMOZO V, BACKMANN N, SENTER P D, et al. Efficient cancer therapy with a nanobody-based conjugate[J]. Cancer Res, 2004, 64(8): 2853-2857.
[29] 蘇幼紅, 李江偉. 駱駝來源單域抗體在免疫治療中的研究進展[J].生物技術通報, 2010(6): 27-32.
[30] 王興華, 于曉玲, 董寶瑋. 超聲介導超聲造影劑在分子影像與基因治療領域中的應用[J]. 中華超聲影像學雜志, 2004, 13(11): 865-867.
[31] CORTEZ-RETAMOZO V, LAUWEREYS M, HASSANZADEH G H G, et a1. Efficient tumor targeting by single-domain antibody fragments of camels[J]. Int J Cancer, 2002, 98: 456-462.
[32] ANEYCKEN I, D’HUYVETTER M, HERNOT S, et al. Immunoimaging using nanobodies[J]. Current Opinion in Biotechnology, 2011, 22: 877-881.
[33] VANEYCKEN I, XAVIER C, BLYKERS A, et al. Synthesis and first in vivo evaluation of18F-anti-HER2-nanobodies: a new probe for PET imaging of HER2 expression in breast cancer[J]. J Nucl Med, 2011, 52: 664-1664.
[34] HARMSEN M M, de HAARD H J. Properties, production, and applications of camelid single-domain antibody fragments[J]. Appl Microbiol Biotechnol, 2007, 77: 13-22.
[35] 涂追, 許楊, 何慶華, 等. 半巢式PCR法構建天然噬菌體單域重鏈抗體文庫[J]. 食品科學, 2010, 31(19): 299-303.
[36] HMILA I, ABDALLAH RBA, SAERENS D, et al. VHH, bivalent domains and chimeric heavy chain-only antibodies with high neutralizing efficacy for scorpion toxin AahI’[J]. Mol Immunol, 2008, 45: 3847-3856.
[37] 湯俊琪, 龐廣昌. 免疫傳感器測定食品中的黃曲霉毒素的研究進展[J]. 食品科學, 2009, 30(17): 318-329.
[38] 王鐵斌, 丁虎生, 楊煉, 等. 抗黃曲霉毒素B1單鏈抗體的篩選和鑒定[J]. 微生物學報, 2009, 49(1): 135-140.
[39] 楊煉, 劉自琴, 劉蓉, 等. 抗黃曲霉毒素B1單鏈抗體的表達載體的比較[J]. 食品科學, 2010, 31(9): 171-176.
[40] 劉蓉, 楊煉, 孫秀蘭, 等. 應用抗黃曲霉毒素單鏈抗體檢測醬油中黃曲霉毒素B1[J]. 食品工業科技, 2011, 32(1): 281-283.
[41] 管笛, 李培武, 張奇, 等. 黃曲霉毒素B1標準替代物的制備及其在花生樣品檢測中的應用[J]. 中國油料作物學報, 2011, 33(5): 503-506.
[42] 王弘, 劉細霞, 潘科, 等. 抗克倫特羅單鏈抗體基因構建及蛋白結構模擬[J]. 食品科學, 2009, 30(13): 227-231.
[43] 劉細霞, 孫遠明, 董潔嫻, 等. 抗克倫特羅核糖體展示單鏈抗體文庫的構建及鑒定[J]. 食品科學, 2011, 32(15): 200-204.
[44] 賀江, 梁穎, 樊明濤, 等. 噬菌體展示技術制備甲氧基有機磷農藥抗獨特型抗體[J]. 分析化學研究報告, 2011, 39(2): 178-182.
[45] 王俊平, 張偉偉, 杜欣軍, 等. 西維因單鏈抗體基因克隆、表達及活性分析[J]. 食品工業科技, 2010, 31(11): 161-164.
[46] 齊永華, 董永軍, 寧紅梅, 等. 單鏈抗體技術在農獸藥殘留檢測方面的研究進展[J]. 東北農業大學學報, 2011, 49(9): 7-11.
[47] KIRCHHOFER A, HELMA J, SCHMIDTHALS K, et al. Modulation of protein properties in living cells using nanobodies[J]. Nat Struct Mol Biol, 2009, 17: 133-138.
Properties and Application Prospects of Nano-Antibody in Food Industry
GUO Ting1,ZHANG Yu-hao1,2,MA Liang1,3,*
(1. College of Food Science, Southwest University, Chongqing 400716, China;2. Food Engineering and Technology Research Center of Chongqing, Chongqing 400716, China;3. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservations (Chongqing), Ministry of Agriculture, Chongqing 400716, China)
Compared with IgG antibodies, nano-antibodies have the properties with smaller size, easier production, high stability and excellent aff i nity. Currently, nano-antibodies are developed and applied in the fi eld of medical and food science. In this paper, the structure, properties and applications of nano-antibodies in food industry have been reviewed and analyzed, which will provide extensive application prospect in food detection.
nano-antibody;property;food;application
TS207.3
A
1002-6630(2013)03-0294-04
2011-12-28
國家“863”計劃項目(2007AA10Z427);中央高校基本科研業務費專項(XDJK2011B001)
郭婷(1988—),女,碩士研究生,研究方向為食品安全與質量控制。E-mail:heavencandy@163.com
*通信作者:馬良(1979—),女,副教授,博士,研究方向為食品安全與食品檢測技術。E-mail:zhyhml@163.com

