DCE-MRI在局部進展期乳腺癌新輔助化療療效評估中的應用價值
李 鹍,郭曉敏,謝 瑜,丁瑩瑩
(昆明醫科大學第三附屬醫院,昆明650118)
新輔助化療療效評估及治療乳腺癌是女性常見的惡性腫瘤,術前新輔助化療(NAC)配合手術被認為是目前提高局部進展期乳腺癌(LABC)患者生存率的有效手段。因此早期判斷腫瘤對化療有無反應非常重要,這樣可以協助制定個體化的治療方案。近年來,由于磁共振軟硬件技術的不斷發展,磁共振動態增強掃描技術(DCE-MRI)能更加成熟地用于乳腺檢查。2011年1月~2012年1月,我們對24例擬行新輔助化療的LABC患者行DCE-MRI檢查,現將DCE-MRI血流動力學參數在LABC新輔助化療療效評估及預后判斷等方面的準確性及敏感性情況報告如下。
1 資料與方法
1.1 臨床資料 擬行NAC的24例LABC患者(26個病灶),年齡33~77歲,中位數年齡47.9歲。均經化療前空芯針穿刺活檢及化療后手術病理證實診斷,國際抗癌聯盟臨床分期為Ⅱ、Ⅲ期。患者均被告知檢查內容并簽署知情同意書。新輔助化療全療程結束后,以手術病理結果為金標準進行分組并分析。手術后病理未見浸潤灶為病理完全緩解組(簡稱緩解組),術后病理發現殘留浸潤灶為病理非完全緩解組(簡稱非緩解組)。
1.2 DCE-MRI檢查方法及圖像后處理 分別于化療前、第1周期化療后及全程化療后行DCE-MRI檢查。采用德國Siemens 1.5T Avanto超導型磁共振掃描儀,4通道雙穴乳腺相控陣線圈。常規掃描:軸位快速小角度激發三維動態成像序列(FLASH 3D)T1WI(TR 8.6 ms,TE 4.7 ms,層厚1 mm,層間距0.2 mm,視野320 mm×320 mm,激勵次數1次)、短翻轉時間反轉恢復序列(STIR)T2WI(TR 5 600 ms,TE 56 ms,視野340 mm ×340 mm,層厚4.0 mm,層間距1.0 mm,激勵次數2次)和矢狀位快速自旋回波(FSE)T2WI脂肪抑制掃描(TR 3 400 ms、TE 65 ms、層厚4.0 mm、層間距1.0 mm、視野200 mm×200 mm,激勵次數1次)。動態增強掃描:主要參數同平掃T1WI。所用對比劑為釓噴酸葡胺注射液Gd-DTPA,經手背靜脈注射(0.2 mmol/kg)。腫瘤最大徑、腫瘤退縮率的測量由兩名影像診斷醫師獨立完成,所有數據傳輸至SIEMENS Sygno工作站及軟件包進行數據的處理。根據時間—信號強度曲線(TIC)計算早期強化率。早期強化率分別選取注藥完成后第1分鐘、第2分鐘及第3分鐘的平均信號強度值作為研究對象。早期強化率第N分鐘=(平均信號強度第N分鐘-信號強度蒙片)÷信號強度蒙片×100%。繪制受試者工作特征曲線(ROC),以術后病理診斷結果為金標準,分別計算各項參數測量值及其改變值評估全程化療后病理反應的ROC曲線下面積(AUC)。并選擇合適的診斷試驗截斷值。
1.3 統計學方法 采用SPSS17.0統計軟件。對所有病例3個監測點的腫瘤軸位最大徑、早期強化率行配對t檢驗;對兩組在3個時間點所測的腫瘤軸位最大徑、早期強化率、全程化療后的腫瘤退縮率行兩獨立樣本t檢驗。P≤0.05為差異有統計學意義。
2 結果
所有病例在第1周期化療后瘤體的平均最大徑為(3.45±1.44)cm,低于化療前 (3.67±1.55)cm,但二者無統計學差異(P=0.054);而全程化療后瘤體最大徑的均值[(1.59±1.20)cm]明顯低于化療前,二者的差異具有統計學意義(P<0.05)。
26個病灶中達到病理完全緩解13個(圖1A~H),病理非完全緩解13個(圖2A~H)。兩組在三個監測時間點所測的最大徑無明顯差異(P>0.05)。緩解組與非緩解組的腫瘤退縮率分別為(0.689 6±0.192 4)×100%和(0.408 7±0.337 9)×100%,二者差異有統計學意義(P=0.017)。兩組三個監測時間點的早期強化率測量值比較見表1。
三個監測時間點的腫瘤最大徑、早期強化率測量值不具診斷效能(AUC<0.5)。根據各個參數改變值的AUC可以看出,在第1周期化療后和全程化療后,腫瘤退縮率的改變值診斷效能最大,在各項參數中評估效能最佳(圖3),當腫瘤退縮率>54.44%時,其診斷病理完全緩解的敏感性為84.6%,特異性為75.0%。其次為血流動力學改變值。在血流動力學方面,第3分鐘強化率的診斷效能最高。
3 討論
DCE-MRI是在注射對比劑過程中連續獲得一系列磁共振圖像,其能全程描述對比劑進入和排出腫瘤的過程。DCE-MRI除能直觀提供腫瘤形態學特征,還能反映腫瘤的動力學特征及血管性質。其分析方法有兩種,一是通過分析信號強度變化的半定量方法,二是通過藥代動力學模型計算對比劑濃度變化的定量法[1]。其中通過TIC測得的早期強化率是反映腫瘤血流動力特征的半定量指標,TIC可反映組織微血管密度和血管通透性。化療藥物通過破壞現有的腫瘤血管,抑制新血管的生成達到治療目的。若化療藥物通過介入手段進入腫瘤可以造成小血管炎癥和水腫,動脈壁或內膜增厚,從而使血管腔變窄或阻塞,細小動脈痙攣,甚至在壞死灶的血管內出現血栓。因此,化療造成的腫瘤血管改變將會使對比劑在病灶局部濃集和滲出,加之惡性腫瘤內部常見的動靜脈短路等情況,改變了腫瘤局部的微循環狀態,這些均是DCE-MRI能反映化療后腫瘤局部灌注改變的病理學基礎。
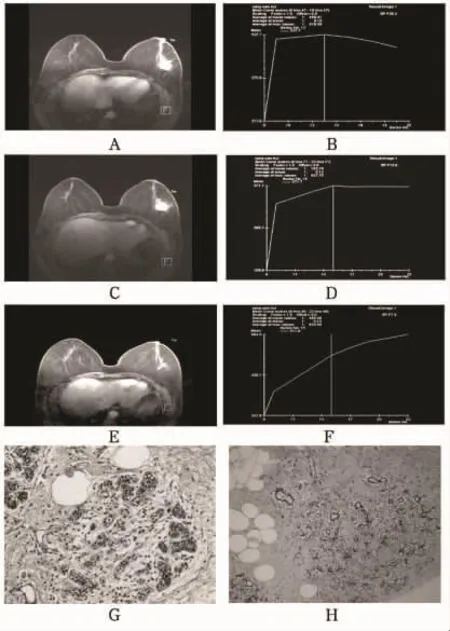
圖1 完全緩解組增強T1WI圖及TIC圖
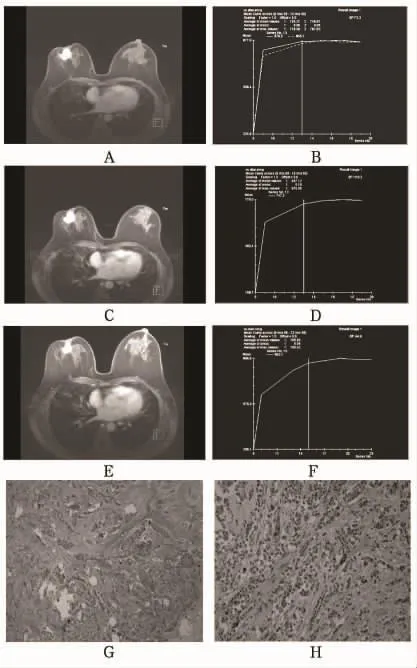
圖2 非緩解組增強T1WI圖及TIC圖
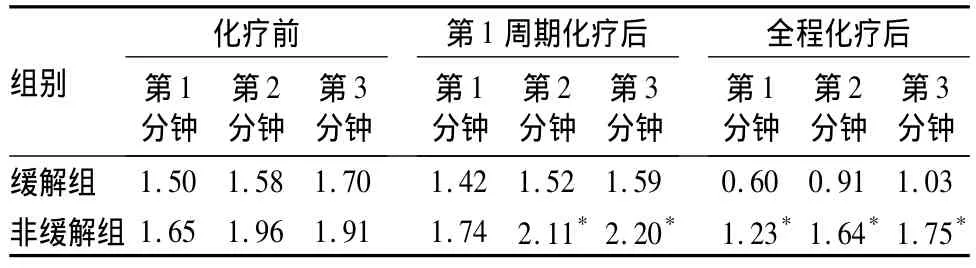
表1 兩組三個監測時間點的早期強化率測量值比較(%)
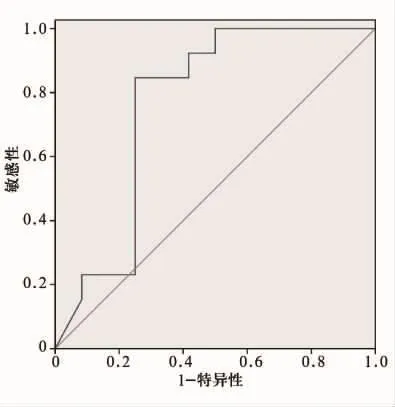
圖3 腫瘤退縮率診斷病理完全緩解的ROC曲線
臨床常選擇4~6個周期的乳腺癌化療方案,總時間可能長達3個月左右,在整個療程中選擇恰當的監測時間點顯得尤為重要。Line等[2]認為雖然在第1周期化療結束后腫瘤發生了一系列的變化,但動態增強參數仍不足以預測全療程結束后的最終效果(是否獲得病理緩解)。本研究中,前兩個監測時間點(化療前、第1周期)測得的早期強化率相比并無明顯差異,得出與Line相似的結果。推測其主要原因是化療藥物的作用還未對腫瘤血供及灌注發揮明顯的破壞及阻斷作用。直至全程化療后,早期強化率才明顯降低,同時伴有腫瘤的明顯退縮。因此乳腺癌病灶強化方式的變化出現較晚,不宜使用第1周期化療后的早期強化率作為判斷療效的指標,還需在第2周期至全程化療結束之間尋找動態增強曲線可能發生明顯變化的監測時間點。
全程化療后的早期強化率在緩解組與非緩解組之間有統計學差異,這個結果可以從乳腺浸潤性癌的血流供應方面解釋。腫瘤血管生成是實體腫瘤發生發展的一個重要環節。Folkman等[3]認為,當實體腫瘤直徑超過2 mm時就需要有血管來提供氧和營養物質,否則腫瘤中心部位將發生缺血、壞死。有研究認為[4,5],乳腺浸潤性癌屬血管較為豐富的實體腫瘤,癌細胞突破乳腺導管基底膜并侵入間質,腫瘤的惡性程度(易轉移性)與其血供的豐富程度有著密切的關系。非緩解組具有殘留的癌細胞浸潤,因此治療后殘余的癌巢仍具有惡性腫瘤動脈血供的特點。本研究結果亦顯示,在局部進展期乳腺癌第1周期化療后,第2、3分鐘的早期強化率在兩組之間有統計學差異,而第1分鐘強化率則無差異。緩解組在三個監測時間點的早期強化率在數值上均低于非緩解組,并且這種差異隨著化療周期的增加而逐漸增大。從以上結果可以看出,緩解組與非緩解組在血流動力學方面存在的差異,在第1周期化療后即顯現,并且這種差異在注藥后第2、3分鐘較第一分鐘更加明顯。已有研究[6]證實惡性病變在早期灌注過程中已出現滲漏,但在化療后有效組與無效組之間,流出段的參數變化才更加明顯[7]。
本研究發現,3個監測時間點的腫瘤軸位最大徑、早期強化率測量值不具有診斷意義。在改變值方面,第1周期化療后的血流動力學改變值的AUC亦不超過0.7,其評價效能較小。說明通過第1周期化療后的指標來預測全程化療后療效缺乏說服力。諸多學者[8~12]認為腫瘤徑線預測腫瘤新輔助化療的效果好,Loo等[13]發現腫瘤最大徑線縮小率小于25%時預示腫瘤化療效果不佳。
本研究得出,全程化療后的腫瘤退縮率、早期強化率的改變值對化療后病理完全緩解均有診斷意義,其AUC較化療第1周期后的改變值有所提高。其中,腫瘤退所率所得AUC最大,其診斷的準確性較高。當腫瘤退縮率>54.44%時,預示化療效果較好,無浸潤性腫瘤細胞殘留的機會較大,其敏感性為84.6%,特異性為75.0%。
綜上所述,在用早期參數預測化療療效是否達到病理完全緩解時,選擇正確的監測時間點尤為重要,化療第1周期結束的動態增強數據并不能得出化療最終是否有效的結論;全程化療結束后腫瘤退縮率是最佳的診斷病理完全緩解的指標,其次為注藥后第3分鐘的早期強化率。本研究的不足在于病例數較少,未按照學術界的共識來進行病理學的分組,筆者將繼續收集病例以完善結果。在未來的研究中,通過尋找更為敏感的腫瘤灌注指標(如Ktrans等)來描述化療早期的血流動力學變化,真正實現能早期、簡便地判斷腫瘤功能學改變、預測全程化療效果的設想。
[1]趙登玲,鄧鋼.CT及MR評價腫瘤血管生成的研究進展[J].東南大學學報(醫學版),2007,(5):393-396.
[2]Jensen LR,Garzon B,Heldahl MG,et al.Diffusion-weighted and dynamic contrast-enhanced MRI in evaluation of early treatment effects during neoadjuvant chemotherapy in breast cancer patients[J].J Magn Reson Imaging,2011,34(5):1099-1109.
[3]Folkman J,Shing Y.Angiogenesis[J].J Biol Chem,1992,267(11):10931-10934.
[4]Weider N,Semple JP,Welch WR,et al.Tumor angiogenesis and metastasis correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1):1-8.
[5]Weider N,Folkman J,Pozza F,et al.Tumor angiogensis:a new significant and independent prognostic indicator in early stage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1887.
[6]王麗,翟仁友,蔣濤,等.乳腺疾病動態增強MRI半定量參數與微血管密度的相關性[J].中國醫學影像技術,2007,23(3):388-392.
[7]Yu HJ,Chen JH,Mehta RS,et al.MRI measurements of tumor size and pharmacokinetic parameters as early predictors of response in breast cancer patients undergoing neoadjuvant anthracycline chemotherapy[J].J Magn Reson Imaging,2007,26(3):615-623.
[8]Manton DJ,Chaturvedi A,Hubbard A,et al.Neoadjuvant chemotherapy in breast cancer:early response prediction with quantitative MR imaging and spectroscopy[J].Br J Cancer,2006,94(3):427-435.
[9]Padhani AR,Hayes C,Assersohn L,et al.Prediction of clinicopathologic response of breast cancer to primary chemotherapy at contrast-enhanced MR imaging:initial clinical results[J].Radiology,2006,239(2):361-374.
[10]Martincich L,Montemurro F,De Rosa G,et al.Monitoring response to primary chemotherapy in breast cancer using dynamic contrast-enhanced magnetic resonance imaging[J].Breast Cancer Res Treat,2004,83(1):67-76.
[11]Pickles MD,Lowry M,Manton DJ,et al.Role of dynamic contrast enhanced MRI in monitoring early response of locally advanced breast cancer to neoadjuvant chemotherapy[J].Breast Cancer Res Treat,2005,91(1):1-10.
[12]Hylton NM,Blume JD,Bernreuter WK,et al.Locally advanced breast cancer:MR imaging for prediction of response to neoadjuvant chemotherapy-results from ACRIN 6657/I-SPY TRIAL[J].Radiology,2012,263(3):663-672.
[13]Loo CE,Teertstra HJ,Rodenhui SS,et al.Dynamic contrast-enhanced MRI for Prediction of breast Cancer response to neoadjuvant chemotherapy:Initial results[J].AJR,2008,19(11):1331-1338.

