“氧化還原-沉淀-超濾”法處理含鉻放射性廢水
郭寧博 賈銘椿 董興泰
(海軍駐葫蘆島431廠軍事代表室1) 葫蘆島 125004) (海軍工程大學動力工程學院2) 訓練部3) 武漢 430033)
0 引 言
某些核設施檢修或退役時會產生一定量的含鉻放射性廢水,其放射性水平極低,從放射性廢水排放的角度而言,可以滿足國標規定的近海排放標準[1],但是其中Cr(VI)的含量卻達到300mg/L以上,遠遠高于國家規定的向天然水體中排放的標準(0.5mg/L以下)[2].因此,對于此類廢水,處理的目的主要是除鉻而不是去放射性.但是除鉻過程中產生的二次廢物屬于放射性廢物,為實現放射性廢物最小化,必須在工藝設計中考慮如何減少二次廢物的產生量.因此除鉻的效率和二次廢物的產生量是處理這種廢水需要特別關注的問題.
目前處理含鉻廢水的方法很多,有化學法、離子交換法、生物法、電解法、光催化法[3-4]等.離子交換法工藝成熟、除鉻效率高,一度得到大規模應用,但含鉻廢水一般質量濃度較高,需要消耗大量的離子交換樹脂,且樹脂吸附后再生困難,因此目前工業上采用此法較少.生物法、電解法和光催化法都是除鉻新方法,這些方法因能耗低或無二次污染而獲得越來越多的關注,國內外研究較多,但大多技術尚不成熟而未得到廣泛應用.化學法工藝簡單,技術成熟,是工程上最常用的方法,但污泥量大是化學法中常遇到的問題,這使其在處理放射性含鉻廢水的應用中受到限制.過氧化氫是一種環境友好型氧化還原劑,其分解產物僅為水和氧氣.超濾(UF)[5-6]是一種以膜為過濾介質的分離技術,因其高效、操作方便的特點近年來在污水處理中的應用日益廣泛.本文選用過氧化氫作還原劑,改絮凝沉淀為超濾膜處理,采用“氧化還原-沉淀-超濾”的工藝處理模擬含鉻放射性廢水,旨在探索出一種高效且二次廢物產生量少的處理方法.
1 實驗部分
為減緩設備腐蝕,某些核設施屏蔽水箱和冷卻管路的水中加入了重鉻酸鉀作為緩蝕劑,其Cr(VI)質量濃度從80~400mg/L不等.反應堆檢修或退役時這些水排出成為廢水,需處理達標后排放.取樣測量其放射性活度僅為幾十Bq/L,Cr(VI)質量濃度大于300mg/L.因此本實驗配制含Cr(VI)300mg/L的重鉻酸鉀溶液作為模擬廢水(以下簡稱廢水).
實驗分為3個步驟:(1)用過氧化氫將廢水中的Cr(VI)還原為Cr(III);(2)除去殘留過氧化氫并加堿液,將Cr(III)轉化為氫氧化鉻;(3)用超濾膜截留氫氧化鉻,實現鉻與廢水的分離.
實驗工藝流程見圖1.其中超濾膜組件采用天津膜天膜工程技術有限公司生產的MIF-1A型超濾膜,膜孔徑0.1μm,面積0.2m2,PVDF材質;供水泵為杭州新西山實業有限公司生產的MP-70RZ型磁力驅動循環泵,流量20L/min,揚程12m.
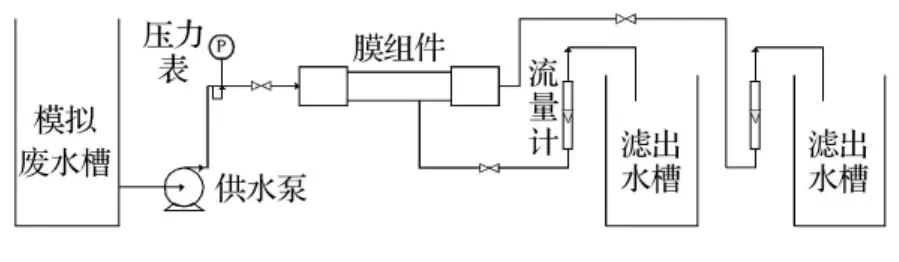
圖1 實驗工藝流程圖
儀器采用北京普析通用儀器有限責任公司TU-1900雙光束紫外可見分光光度計,上海精密科學儀器有限公司PHS-3D型pH計,梅特勒-托利多儀器有限公司的電子天平.
鉻濃度測定中部分藥品按國家標準采用優級純試劑,其余藥品均為分析純試劑.總鉻的測定方法為高錳酸鉀氧化-二苯碳酰二肼分光光度法[7].六價鉻的測定方法為二苯碳酰二肼分光光度法[8].
2 結果與討論
2.1 過氧化氫還原Cr(VI)的影響因素分析
重鉻酸鉀在酸性介質中與過氧化氫發生反應[9]
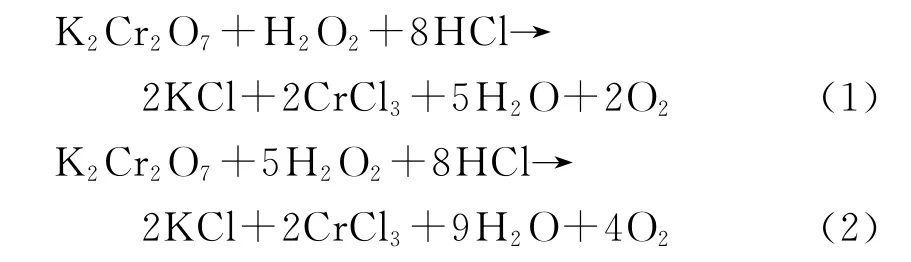
這是重鉻酸鉀與不等量的過氧化氫發生的2種氧化還原反應.可以看出,在過氧化氫和鹽酸共同作用下,Cr(VI)被還原為 Cr(III).過氧化氫最終轉化為對環境無害的水和氧氣,不產生二次廢物,有利于放射性廢物的處理.
為了研究廢水初始pH值對還原效果的影響,量取廢水50mL,用鹽酸調節廢水樣品的初始pH 值至1.61,1.66,1.72,1.78,1.87,均加入過氧化氫2mmol,2h后測量殘留Cr(VI)質量濃度并計算轉化率,結果見圖2.
可以看出,初始pH值對Cr(VI)的轉化率影響很大,初始pH值越低,轉化率越高.從式(1)和式(2)來看,酸作為反應物,其質量濃度的提高能直接促進反應向右進行,使更多的Cr(VI)轉化為Cr(III).
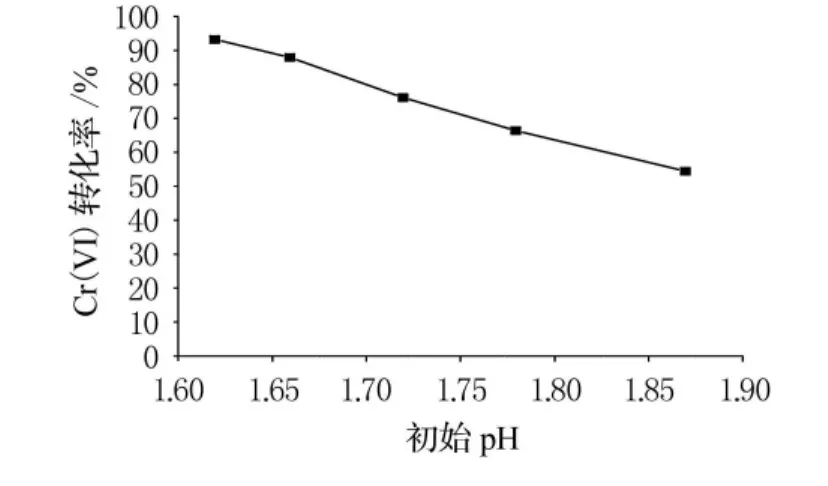
圖2 初始pH值對Cr(VI)轉化率的影響
處理含鉻廢水所用過氧化氫量應該適當控制.如果投加不足,則Cr(VI)反應不充分,廢水達不到排放要求;如果投加過量,則會造成浪費,使處理成本增加.量取廢水50mL,過氧化氫加入量與Cr(VI)轉化率之間的關系見圖3.
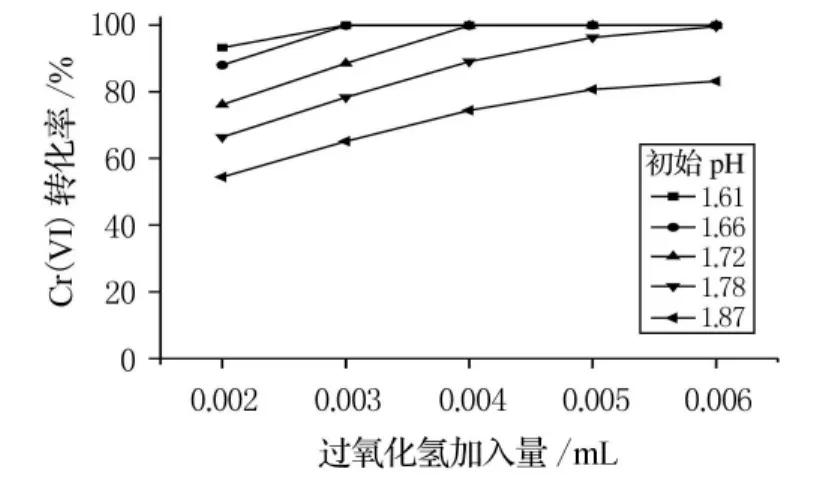
圖3 過氧化氫加入量對還原效果的影響
從圖3可以看出,當初始pH值大于1.78時,Cr(VI)轉化率隨著過氧化氫加入量的增加而增大;當初始pH值不大于1.78時,Cr(VI)轉化率在實驗區間內有極限值(Cr(VI)幾乎完全反應),初始pH 值為1.78和1.72時極限值在6mmol/(50mL 廢 水)和4mmol/(50mL 廢水)時出現,初始pH值為1.61和1.66時極限值在3mmol/(50mL廢水)時出現.因此將初始pH值調至1.66以下可以大大減少過氧化氫的用量.
根據式(1)和式(2)可以確定過氧化氫的理論用量,即0.144mmol/(50mL廢水)至0.720m mol/(50mL廢水).但實驗發現過氧化氫過量時Cr(VI)才能較充分地被還原,在初始pH值為1.61~1.87范圍內,要達到較高的還原率,過氧化氫加入量至少為3mmol/(50mL廢水),即理論用量的4倍以上.根據周紅敏等[10]的研究,過氧化氫是一種二元弱酸,在強酸性條件下不易離解生成,而能夠作還原劑的自由基則要通過反應+H2O2→HO2·+HO·+OH-生成,這就造成強酸性條件下過氧化氫活性不足.但Cr(VI)的氧化性又要通過強酸性條件表現,因此只能用過量的過氧化氫來保證Cr(VI)的充分還原.
Cr(VI)轉化率隨時間變化規律見圖4.
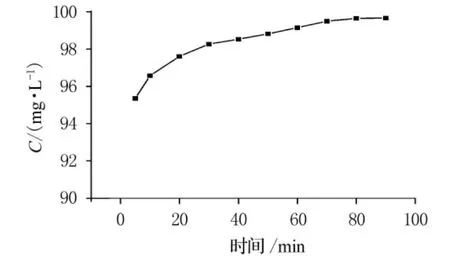
圖4 Cr(VI)轉化率隨時間變化規律
開始時,反應物充足,反應迅速進行,5min內Cr(VI)轉化率即達到95%以上.隨著過氧化氫和酸的不斷消耗,二者濃度下降,反應動力減小,反應速度減緩.30~80min時進入緩慢反應階段.80min后Cr(VI)幾乎反應完全,轉化率達到最大.因此最佳反應時間為80~90min.根據實驗數據進行零級、一級和二級反應動力學方程的歸納分析,通過以質量濃度C,lnC和1/C對時間t作圖(如圖5~7),依次得出零級、一級和二級反應速率常數分別為-0.111 89,-0.031 71和0.013 56,相關系數分別為0.848 49,0.979 1和0.770 79.從反應動力學方程的相關系數可知,此反應對于Cr(VI)應為一級反應.
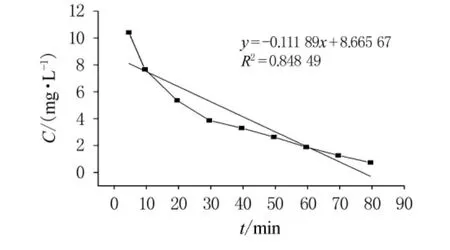
圖5 零級反應動力學方程分析(C-t圖)
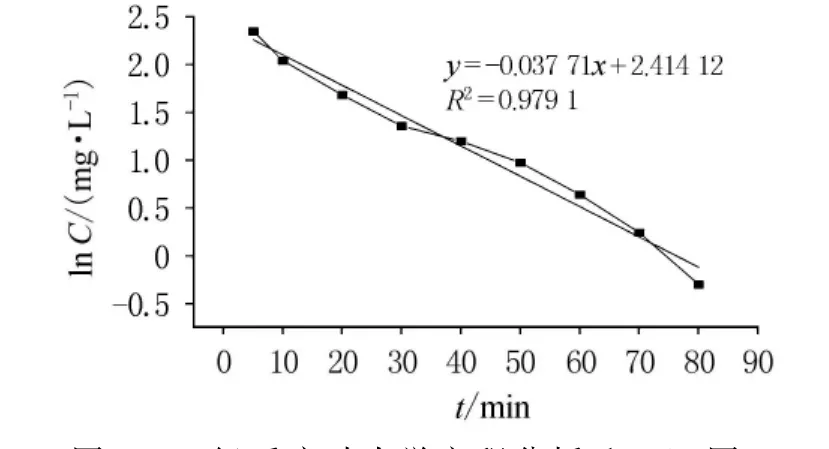
圖6 一級反應動力學方程分析(ln C-t圖)
2.2 殘留過氧化氫的去除和Cr(III)沉淀
調節廢水pH值至中性或堿性,Cr(III)與氫氧根離子結合生成氫氧化鉻沉淀,才能實現鉻與廢水分離.在堿的作用下,Cr(III)又非常容易被殘留的過氧化氫氧化為鉻酸根離子,因此在加堿沉淀Cr(III)之前,要先除去廢水中殘留的過氧化氫.
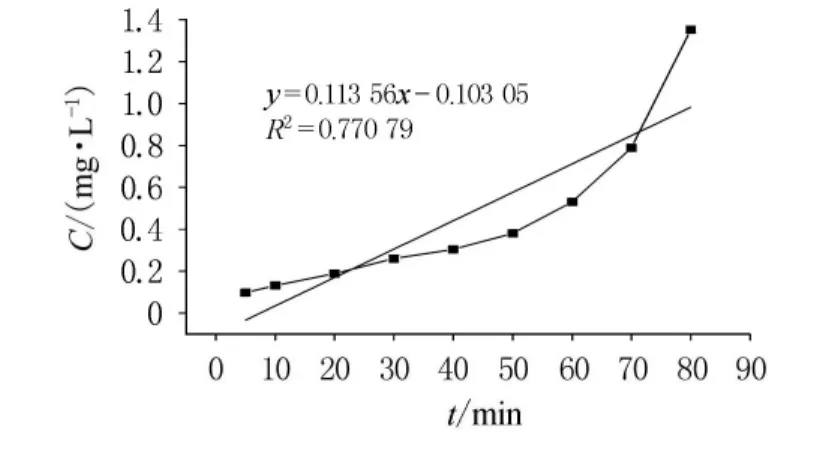
圖7 二級反應動力學方程分析(1/C-t圖)
2.2.1 金屬離子催化分解殘留過氧化氫的比較
文獻[11-12]中報道,某些金屬離子能夠催化分解過氧化氫.本實驗選取研究較多的Fe(III)和Mn(II)作為催化劑,研究其分解殘留過氧化氫的效果.因為Cr(VI)和Cr(III)的存在,高錳酸鉀法或碘量法不適于測定溶液中過氧化氫的濃度,本實驗用加堿前后Cr(VI)濃度的變化表征金屬離子對過氧化氫的催化分解效果.取廢水100mL,調節初始pH值至1.66,加入6mmol過氧化氫.1.5h后加入5mmol/L的 Fe(III)或 Mn(II)5mL,去離子水作參比.1h后加堿液調節各溶液pH值至7.溶液中Cr(VI)轉化率變化見圖8.
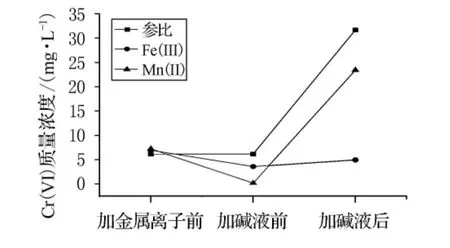
圖8 金屬離子催化分解過氧化氫的比較
由圖8可知,加堿液后參比溶液和含Mn(II)溶液中的Cr(VI)質量濃度大幅升高,說明Mn(II)催化分解殘留過氧化氫的效果較差,溶液中仍存在的大量過氧化氫與Cr(III)作用生成了鉻酸根離子.加堿液后含Fe(III)溶液的Cr(VI)濃度只有小幅上升,說明加堿液前溶液中只剩下微量過氧化氫,Fe(III)催化分解過氧化氫效果顯著.
2.2.2 氫氧化鈉與氨水沉淀Cr(III)的比較 量取100mL廢水,調節初始pH 為1.66,加入6mmol過氧化氫,用5mmol/L的Fe(III)催化分解過量過氧化氫,用0.1mol/L的氫氧化鈉和0.1mol/L的氨水調節溶液pH,使 Cr(III)成為氫氧化鉻沉淀,測得Cr(VI)轉化率見表1.
從表1可見,氨水作沉淀劑時,Cr(VI)轉化率總是高于同質量濃度的氫氧化鈉作沉淀劑時的Cr(VI)轉化率,這是因為氨水堿性較弱,不利于過氧化氫與Cr(III)作用生成鉻酸根.因此與氫氧化鈉相比,氨水更適合做Cr(III)沉淀劑.氨水作沉淀劑時,7為最佳沉淀pH值.
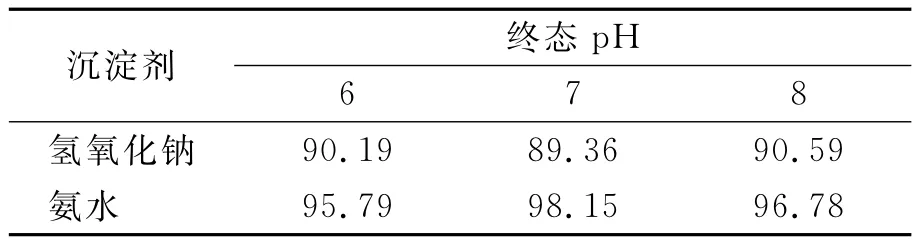
表1 不同條件下Cr(VI)總轉化率 %
2.3 “氧化還原-沉淀-超濾”法除鉻效果分析
配制模擬廢水20L,調節pH值至1.66,加入30%過氧化氫120mL,充分攪拌,靜置2h,使反應完全.加入0.28gFe(III)催化分解殘留過氧化氫.1h后分別用0.1mol/L和0.01mol/L的氨水調節模擬廢水pH值至7,向前者加去離子水使二者體積相等.
分別對上述廢水進行超濾實驗.啟動超濾裝置,調節操作壓力至0.08MPa,起始透過水流量25L/h,濃縮水流量20L/h.開機5min后,開始取透過水樣并測量Cr(VI)和總鉻濃度,10min取樣一次.測量結果見表2.
每組實驗后,用去離子水對超濾膜反洗10 min,正洗10min,使超濾膜純水通量恢復到90%以上;若恢復率小于90%,用濃度為0.3%的鹽酸溶液低壓循環清洗直至恢復率達到90%以上.
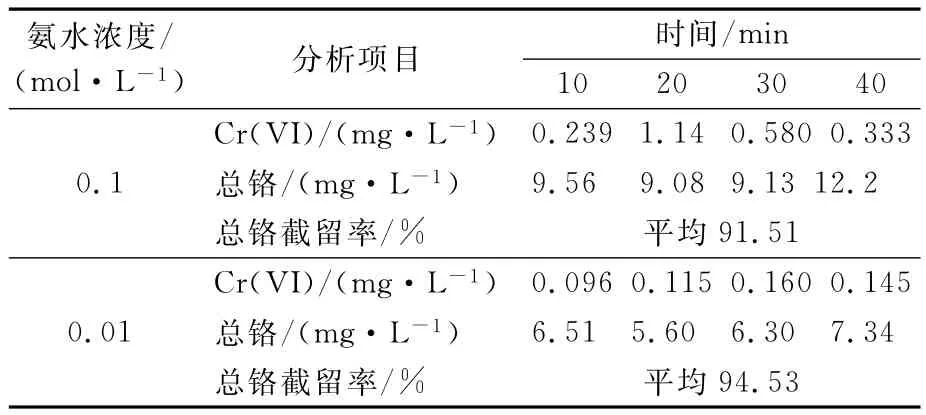
表2 超濾實驗結果
從表2可以看出,用濃度為0.1mol/L或0.01mol/L的氨水調節pH值時,總鉻平均截留率分別為91.51%和94.53%,配制300mg/L的Cr(III)溶液替代模擬廢水進行對比實驗,總鉻平均截留率分別為99.919%和99.955%.比較發現,用0.01mol/L的氨水調節廢水pH值能有效提高總鉻截留率,其可能的原因是氫氧化鉻更容易溶解于高濃度的氨水形成Cr(NH3)3+6鉻離子,從而降低了超濾膜對總鉻的截留率.用0.1mol/L的氨水調節pH值時,透過水中Cr(VI)平均濃度為0.573mg/L,略高于國家污水綜合排放標準(0.5mg/L 以下),用0.01mol/L 的氨水調節pH值時,透過水中Cr(VI)平均質量濃度為0.129mg/L,達到排放標準.
3 結 論
通過研究廢水初始pH值、過氧化氫用量和時間對Cr(VI)轉化率的影響,確定了初始pH值1.66、過氧化氫用量6mmol/(100mL廢水)并反應80min時,Cr(VI)轉化率達到99.86%.提高酸度和增加過氧化氫用量,Cr(VI)轉化率最高達到99.96%.過氧化氫在含鉻放射性廢水的處理中具有良好的應用前景.
在沉淀Cr(III)階段,用0.25mmol/(1L廢水)的 Fe(III)催化分解殘留過氧化氫,用0.01mol氨水沉淀Cr(III),能有效地減少Cr(III)重新轉化為Cr(VI),提高最終Cr(VI)轉化率.
實驗條件下,“氧化還原-沉淀-超濾”法處理模擬含鉻放射性廢水,出水總鉻平均濃度6.44 mg/L,截留率達到94.53%.其中Cr(VI)平均濃度為0.129mg/L,達到國家污水綜合排放標準.
本文選用過氧化氫作還原劑,對“氧化還原-沉淀-超濾”法處理模擬含鉻放射性廢水的效果進行了初步探索.過氧化氫在酸性條件下還原Cr(VI)效果很好,但在pH值較高時表現出較強的氧化性,對Cr(III)的沉淀造成了不利影響,下一步將選擇氧化性較弱的還原劑如亞硫酸鹽等進行研究.
[1]中華人民共和國國家質量監督檢驗檢疫總局.GB14500-2002放射性廢物管理規定[S].北京:標準出版社,2002.
[2]中華人民共和國國家質量監督檢驗檢疫總局.GB8978-1996污水綜合排放標準[S]..北京:標準出版社,1996.
[3]胡 濤,李亞云.含鉻廢水的治理研究[J].污染防治技術,2005,18(4):5-7.
[4]汪德進,何小勇.含鉻廢水處理的研究進展[J].安徽化工,2007,33(1):12-15.
[5]任建新.膜分離技術及其應用[M].北京:化學工業出版社,2003.
[6]王 湛.膜分離技術基礎[M].北京:化學工業出版社,2000.
[7]中華人民共和國國家質量監督檢驗檢疫總局.GB7466-87水質 總鉻的測定 高錳酸鉀氧化-二苯碳酰二肼分光光度法[S].北京:標準出版社,1987.
[8]中華人民共和國國家質量監督檢驗檢疫總局.GB7467-87水質 六價鉻的測定 二苯碳酰二肼分光光度法[S].北京:標準出版社,1987.
[9]陳壽椿.重要無機化學反應[M].2版.上海:上海科學技術出版社,1994.
[10]周紅敏,石雙群.Fe(III)、Cr(III)對過氧化氫分解作用再研究[J].河北化工,1995(2):22-24.
[11]姜成春,旁素艷,江進,等.Fe(Ⅲ)催化過氧化氫分解影響因素分析[J].環境科學學報,2007,27(7):1197-1202.
[12]張健揚,史淑鳳,崔海香.金屬離子對過氧化氫的催化分解作用研究[J].唐山師范學院學報,2005,27(5):10-13.

