魚藤素誘導食管癌Ec-109細胞株凋亡
白美玲 李玉珍 金春亭
(河北北方學院基礎醫學院病理教研室,河北 張家口 075000)
食管癌就診時多為中晚期患者,臨床上一般采取手術結合化療。而常規的藥物治療副作用大,效果欠佳,故新的抗癌藥物的研發迫在眉睫。近年來一些學者嘗試從植物中提取有效成分成為尋找抗癌藥物的新途徑。魚藤素是魚藤屬植物及灰葉屬植物中提取的一種黃酮類化合物,具有抗病毒、抗腫瘤作用,本實驗采用多種方法與手段通過體外觀察魚藤素對食管癌細胞的影響。
1 材料與方法
1.1 主要藥物及試劑 人食管癌細胞株Ec-109購自中國醫學科學院腫瘤醫院腫瘤研究所,河北北方學院實驗中心凍存保留。魚藤素購自ALEXIS公司,純度為95.6%,用DMSO溶解配成10 mmol/L的儲存液,等量分裝,-20℃保存,使用前用RPMI1640稀釋。RPMI1640培養基為美國Gibco公司產品,胎牛血清(FCS)購自杭州四季青生物工程材料有限公司。Annexin V/PI雙染試劑盒為美國BD公司產品。
1.2 實驗方法
1.2.1 Ec-109細胞培養與分組 將人食管癌細胞株Ec-109細胞用含10%胎牛血清的RPMI-1640培養基在含有5%CO2、37℃恒溫培養箱中進行培養。觀察細胞生長進入對數生長期后,用0.25%的胰蛋白酶消化細胞,細胞計數后進行傳代培養,待細胞貼壁后,將實驗分為5組:對照組(加入等量培養液)及5、10、20 和40 nmol/L魚藤素組。
1.2.2 熒光顯微鏡下觀察細胞形態 將不同濃度魚藤素藥物組及對照組作用24 h的Ec-109細胞懸液少許滴在干凈的載玻片上,通過熒光顯微鏡觀察其形態學改變。
1.2.3 Annexin-V FITC/PI雙標法流式細胞術檢測細胞早期凋亡 收集不同濃度藥物組及對照組作用24 h的Ec-109細胞,每組計數1×106個細胞,離心,棄去上清液,用PBS緩沖液洗滌兩遍,再按照流式試劑盒的說明向細胞中分別加入185μl緩沖液,5μl Annexin V和10μl PI,混勻避光20 min,離心后棄去上清,再加入冷PBS洗滌一次,用500μl PBS緩沖液懸起細胞,采用流式細胞儀進行細胞早期凋亡檢測。
1.2.4 線粒體跨膜電位的檢測 將魚藤素作用24 h的Ec-109細胞計數并調整細胞密度為1×106/ml,離心,棄去培養基;再用無血清的培養基洗滌Ec-109細胞兩遍,離心,懸浮Ec-109細胞,標記羅丹明123(Rho 123),使其終濃度為10μg/ml,混勻;在37℃、5%的CO2培養箱中孵育30 min;PBS緩沖液洗滌兩遍,棄去上清;上流式細胞儀進行檢測。
1.2.5 免疫組化法檢測Bcl-2蛋白與Bax蛋白的表達 常規免疫組化染色法,將5、10、20與40 nmol/L魚藤素組分別作用于Ec-109細胞24 h后,觀察Bcl-2蛋白與Bax蛋白表達情況,并與未加魚藤素的對照組進行對比。
1.3 統計學處理 采用SPSS16.0統計軟件進行數據處理,計量資料以x±s表示,組間比較行q檢驗。
2 結果
2.1 熒光顯微鏡下觀察EC-109細胞的形態學改變 對照組細胞大小一致,細胞核呈彌散均勻的藍色熒光,實驗組可見細胞體積縮小,胞質濃縮,胞核固縮,染色質邊集,核碎裂,染色質分割成塊,細胞核呈致密濃染的顆粒狀熒光和形成凋亡小體等典型的凋亡細胞形態改變(圖1)。
2.2 魚藤素對食管癌Ec-109細胞凋亡的影響 魚藤素處理Ec-109細胞24 h后,用Annexin V-FITC和PI雙染法對Ec-109細胞標記后經流式細胞儀檢測,結果顯示魚藤素對食管癌Ec-109細胞有明顯的誘導細胞凋亡和促進細胞死亡作用,5、10、20和40 nmol/L魚藤素用藥組細胞早期凋亡率分別為(4.37±0.35)%、(6.71±0.14)%、(15.62±0.21)% 和(19.78±0.15)%,與對照組自發早期凋亡率(1.10±0.08)%相比均有顯著差異(P<0.05),并隨魚藤素濃度的升高,凋亡率也相應增高,呈正相關。
2.3 魚藤素對食管癌Ec-109細胞線粒體跨膜電位的影響本實驗數據顯示對照組Ec-109細胞的熒光強度最強,給予5 nmol/L魚藤素作用24 h后,出現了一個明顯的未被羅丹明123染色的峰,隨著魚藤素濃度的增加,弱熒光部分Ec-109細胞含量逐漸增多,細胞熒光強度逐漸減弱,熒光像素向左移動逐漸增多,說明細胞的線粒體跨膜電位逐漸降低,細胞凋亡或壞死的數量也增加。若把對照組熒光強度看作100%,5、10、20與40 nmol/L魚藤素組熒光指數分別為(93.40±0.70)%、(80.29±0.66)%、(71.15±0.59)%、(63.51±0.53)%。5 nmol/L魚藤素組與對照組差異不明顯(P>0.05),而10、20與40 nmol/L魚藤素組較對照組相明顯下降(P<0.05)。
2.4 Bcl-2蛋白、Bax蛋白在食管癌Ec-109細胞中表達的免疫組化結果 Bcl-2蛋白與Bax蛋白表達陽性均表現為細胞質或細胞膜出現灶性或彌漫分布的棕黃色顆粒,我們以陽性細胞的數量和顏色綜合判斷兩種蛋白的表達情況。實驗結果顯示(圖2)對照組Bcl-2蛋白與Bax蛋白表達均高,魚藤素組Bcl-2蛋白表達量隨著藥物濃度的升高而降低,而Bax蛋白隨著用藥濃度的升高而增高。

圖1 對照組與實驗組的細胞形態(×400)
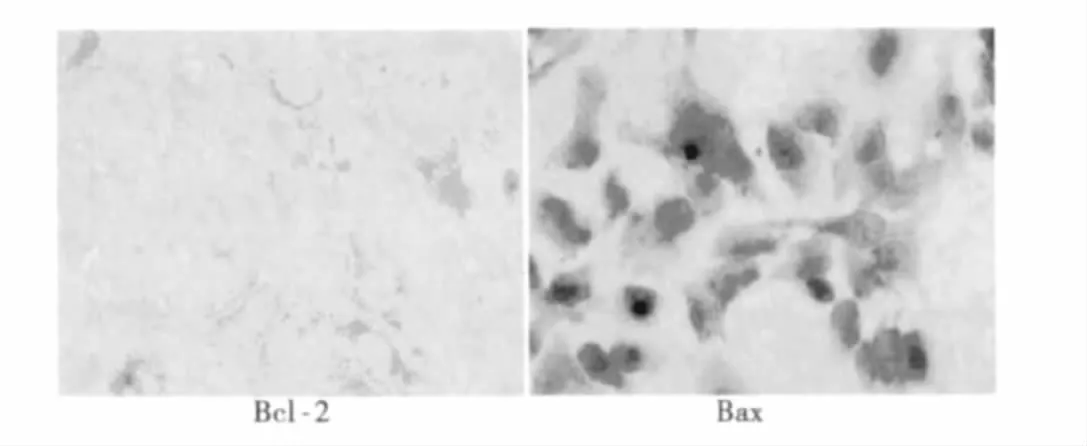
圖2 40 nmol/L魚藤素用藥組Bcl-2蛋白、Bax蛋白的表達情況(DAB,×400)
3 討論
現在普遍認為〔1〕,大多數抗腫瘤藥物都可通過誘導腫瘤細胞凋亡的形式殺滅腫瘤細胞從而達到良好的治療效果,有報道提示〔2,3〕魚藤素對非小細胞肺癌有明顯的誘導凋亡作用,而對正常人體細胞沒有殺傷作用。為探討魚藤素對食管癌Ec-109細胞的凋亡作用,本實驗發現,藥物濃度與作用時間呈劑量-時間依賴關系,這與文獻報道的藥物濃度范圍一致〔4〕。
近年來體外實驗證實〔5〕,線粒體是處于調控腫瘤細胞的凋亡的中心位置,機體有多種信號途徑可以誘導細胞凋亡,但所有這些途徑都可能集中于細胞的線粒體。本實驗結果表明隨著魚藤素濃度的增高,Ec-109細胞的熒光強度逐漸降低,表明Ec-109細胞的線粒體跨膜電位(△Ψm)逐漸降低,細胞凋亡或壞死漸多。我們推斷是由于魚藤素導致線粒體膜電位損傷,使得進入細胞內的熒光染料減少,檢測到的熒光變弱,而線粒體跨膜電位的崩潰導致NADPH耗盡,隨后呼吸鏈上過氧化陰離子過度產生,引發呼吸鏈的解聚,最終伴隨三磷酸腺苷合成不足甚至合成停止,加速了細胞凋亡或壞死的進程。線粒體作為細胞活性氧如氧反應產物的主要來源之一,凋亡刺激使線粒體產生的氧反應產物增多,也促進了細胞凋亡〔6〕。
Bcl-2和Bax是Bcl-2基因家族中的重要成員,在細胞凋亡調控機制方面起重要作用〔7〕。Bcl-2蛋白主要表達于線粒體膜與核膜上,其在線粒體水平上即可對抗各種凋亡刺激,主要體現在增強線粒體膜電位,維持線粒體膜的完整性,從而抑制線粒體釋放促凋亡蛋白,已有研究顯示Bcl-2蛋白還具有直接抗氧化作用〔8〕。Bax在正常細胞中主要定位表達于細胞質,在細胞受到死亡信號刺激后,發生構像變化,從細胞質轉移到細胞器膜上,尤其是線粒體外膜上,與抗凋亡蛋白Bcl-2形成異源二聚體〔9〕,拮抗Bcl-2,使Bcl-2喪失對凋亡的抑制作用,引起細胞器功能喪失和各種促凋亡因子的釋放,最終導致細胞的凋亡。從本實驗結果顯示,魚藤素作用于Ec-109細胞能夠上調Bax表達且下調Bcl-2表達,這說明魚藤素通過上述某些途徑激活了促進食管癌細胞凋亡的基因,同時也能夠下調抑制凋亡的基因,這種雙重作用的結果導致了凋亡的產生。
本文結果表明魚藤素可導致線粒體跨膜電位的開放,同時促進凋亡蛋白的釋放及下調抗凋亡蛋白含量,從而誘導食管癌細胞的凋亡,為魚藤素的臨床應用提供體外實驗證據。
1 呂冬霞,劉 娜,范曉艷,等.灰樹花多糖對人宮頸癌HeLa細胞凋亡的影響〔J〕.中國老年學雜志,2011;31(4):1215-7.
2 Lee HY.Molecular mechanisms of deguelin-induced apoptosis in transformed human bronchial epithelial cells〔J〕.Biochem Pharmacol,2004;68(6):1119-24.
3 Ji BC,Yu CC,Yang ST,et al.Induction of DNA damage by deguelin is mediated through reducing DNA repair genes in human non-small cell lung cancer NCI-H460 cells〔J〕.Oncol Rep,2012;27(4):959-64.
4 劉紅利,陳 燕,吳秋珍,等.魚藤素對淋巴瘤Daudi細胞株細胞增殖細胞凋亡的影響及其機制〔J〕.中華腫瘤雜志,2007;9(3):176-80.
5 陸 雯,薛耀明,朱 波,等.低糖誘導的HUVEC-12細胞氧化損傷與線粒體膜電位的關系〔J〕.中華內科雜志,2011;50(10):873-6.
6 Hua YY,Wang XS,Zhang Y,et al.Intense picosecond pulsed electric fields induce apoptosis through a mitochondrial-mediated pathway in He La cells〔J〕.Mol Med Rep,2012;5(4):981-7.
7 Chen X,Wang J,Qin Q,et al.Mono-2-ethylhexyl phthalate induced loss of mitochondrial membrane potential and activation of Caspase3 in HepG2 cells〔J〕.Environ Toxicol Pharmacol,2012;33(3):421-30.
8 Métrailer RI,Pagano A,Carnesecchi S,et al.Bcl-2 protects against hyperoxia-induced apoptosis through inhibition of the mitochondria dependent pathway〔J〕.Free Radic Biol Med,2007;42(7):1062-74.
9 Lalier L,Cartron PF,Juin P,et al.Bax activation and mitochondrial insertion during apoptosis〔J〕.Apoptosis,2007;12(5):887-96.

