小腦頂核電刺激干預在卒中后抑郁大鼠細胞因子發病機制中的作用
李寶強,隋汝波,張 磊,劉欣躍遼寧醫學院附屬第一醫院 神經內科,遼寧錦州 00;遼寧醫學院,遼寧錦州 00
卒中后抑郁(post-stroke depression,PSD)是卒中的常見并發癥之一,占卒中患者的20%~50%[1]。PSD嚴重阻礙了卒中患者神經功能和日常生活能力的恢復,并與卒中患者的社交回避和病死率增高密切相關[2]。Spalletta等[3]認為抑郁患者血中炎性細胞因子水平明顯增加,導致了抑郁。近年大量臨床研究發現電刺激小腦頂核能顯著改善抑郁癥狀[4]。本文通過電刺激小腦頂核后觀察PSD大鼠海馬組織中炎性細胞因子水平的變化,進而探討電刺激小腦頂核對PSD大鼠海馬細胞因子變化的影響。為新型抗抑郁方法的研發提供依據。
材料和方法
1 實驗動物 選用健康雄性SD(Sprague-Dawley,SD)大鼠72只,體質量250~350 g(遼寧醫學院實驗動物中心提供)。許可證號:SCXK(遼)。實驗動物級別:普通級。
2 試劑和儀器 RNAiso Plus,TNF-α,IL-6,IL-1β反轉錄試劑盒、RNA提取試劑盒購日本TAKARA公司;無RNA酶水購自美國Thermo公司;IL-1,IL-6,IL-1βRat Elisa Kit購自美國R&D公司。BH6018型四探頭自動r計數器:北京核儀器廠;ABI PRISM 7900HT熒光定量PCR儀:Sigma;RF-5000熒光分光光度儀:Sigma;腦立體定位儀:中國深圳瑞沃德生命科技有限公司;離心機1-14K:Sigma;酶標儀Sigma 960:Sigma;勻漿機:Sigma。
3 動物分組 將實驗大鼠適應飼養1周,自然晝夜節律光照,自由攝食進水,通風良好,(21±2) ℃恒溫。期間訓練飲用蔗糖水消耗和曠野實驗(openfield test,OFT)基線值。選擇評分相近大鼠72只,隨機分為四組,每組18只。假手術組:給予假手術處理,除拴線不插入頸總動脈外,余同手術組;卒中組:行大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)術;卒中后抑郁(PSD)組:MCAO術后第3天加以慢性不可預見的溫和刺激(chronic unpredictable mild stress,CUMS),小腦頂核電刺激組:CUMS結合孤養法后在各個時間點行小腦頂核電刺激(60 Hz,60 min),共計3次,直到CUMS流程結束。
4 大鼠局灶性腦缺血模型的建立[5](middle cerebral artery occlusion,MCAO) 手術前12 h禁食不禁水。選用標準大鼠麻醉劑量,以10%水合氯醛3 ml/kg,經腹腔麻醉,仰臥固定于手術臺上,頸部正中切開皮膚及淺筋膜,鈍性分離胸鎖乳突肌與胸骨舌骨肌,暴露左側頸總動脈(CCA)和迷走神經、頸外動脈(ECA)、頸內動脈(ICA)、ICA的顱外分支翼腭動脈,在近心端結扎CCA,在頸總動脈分叉處結扎ECA,結扎翼腭動脈。將ICA遠心端用動脈夾夾閉,距頸總動脈分叉處近心端0.5 cm處將頸總動脈剪一小口,插入備好的碳素魚線,去除動脈夾,沿著ICA輕輕向前推進,注意不要誤入翼鄂動脈,當到達指定長度(18 mm左右)時結扎ICA并固定魚線。假手術組動物,除手術過程中不插入線栓以外,其他過程相同。以青霉素局部消毒后縫合皮膚。術后保持環境溫度在25~30 ℃左右。尤其要注意動物頭部的保溫。模型成功的標志是大鼠即刻出現右側Horner征。
5 建立大鼠卒中后抑郁模型 CUMS:按Willner等[6]和Katz等[7]的方法:1)禁食禁水20 h,2)禁水17 h,3)傾斜鼠籠,共18 d。孤養:將PSD和FNS組動物單籠飼養。
6 行為學觀察和測試 CUMS開始第7、14、21天,行曠野實驗測試,每周行蔗糖水實驗并測量體重,應激結束后行強迫游泳實驗。1)曠野實驗:室內隔音,測定5 min水平和垂直運動得分及中央格停留時間、修飾次數和糞便顆粒;2)蔗糖水實驗:20 h禁食禁水后,測定1 h糖水飲用比例(糖水消耗/總液體消耗×100%);3)強迫游泳實驗:連續觀察5 min,累計大鼠在水中停止掙扎、成漂浮狀態的時間。
7 RNA提取和Real time-PCR 動物完成觀察時間后,于相應時間點,在大鼠盡量安靜的條件下迅速斷頭取腦,在冰盤上迅速分離出病灶側(正常組相對應側)的海馬區腦組織,立即放入液氮中保存,按下面不同方法進行各項指標檢測。取液氮中保存的各時間點海馬標本,按照RNAiso Plus一步法提取組織總RNA。紫外分光光度計測定濃度和純度。取總RNA 2 μg用逆轉錄試劑盒合成cDNA,再行PCR擴增。RT-PCR引物由上海生工生物工程公司合成,序列如下:TNF-α:5'-TCT TCT CAT TCC TgC TCg Tgg-3'(上游),(下游),5'-CCT CCT TgT Tgg Gac CgA T-3',長度為110 bp;IL-1β:5'-CCT CgT gCT gTC TgA CCC AT-3'(上游),5'-gCC ACA ggg ATT TTg TCg TT-3'(下游),長度為131 bp;IL-6:5'-ACA AAg CCA gAg TCA TTC AgA gC-3'(上 游),5'-ggA AgT Tgg ggT Agg AAg gAC T-3'(下游),長度為135 bp;β-Actin:5'-TACATGGTCTACATGTTCCAGTATG-3'(上 游),(下 游)5'-CAGGAGGCATTGCTGACAATCTTG-3',長度127 bp。擴增條件為50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40個循環。95 ℃ 15 s,60 ℃ 1 min,95 ℃15 s,60 ℃ 15 s。反應在ABI PRISM 7900HTPCR儀上進行。為了控制樣本間mRNA質量的變異,同時檢測βactin基因表達表達。結果采用SDS軟件進行相對定量分析。
8 ELISA法檢測海馬組織IL-6,IL-1β及TNF-α蛋白表達 嚴格按照Rat Elisa Kit說明書操作。
9 統計學處理 實驗數據計量資料均用-x±s表示(先經正態性檢驗),采用SPSS17.0統計軟件:多組計量資料顯著性檢驗進行單因素方差分析(oneway ANOVA)和兩兩比較(LSD法)。P<0.05為差異有統計學意義。
結 果
1 大鼠行為 與對照組相比,卒中組在應激狀態下,大鼠的體質量及糖水消耗略有下降,垂直運動略有下降(cP<0.01);與卒中組相比,PSD組大鼠體質量和糖水消耗量下降,垂直運動降低(aP<0.01);FNS組可增加PSD大鼠體質量和糖水消耗量,提高垂直運動水平(bP<0.01)。見表1。
2 Real time-PCR法檢測海馬組織中IL-6、IL-1β及TNF-α mRNA表 達 IL-6、IL-1β 及TNF-α 的mRNA在正常大鼠海馬組織中呈低水平表達,與對照組比較,在卒中組海馬組織中三種細胞因子mRNA含量于MCAO術后應激作用下開始增加(P<0.05),14 d達到高峰(P<0.05),隨后開始迅速下降;與卒中組比較PSD組三種細胞因子mRNA水平均不同程度顯著增加(P<0.05)IL-6 mRNA表達以后雖有所降低,但三種細胞因子mRNA表達仍均維持于較高水平(P<0.05);與PSD組比較,FNS組三種細胞因子mRNA水平均不同程度降低(P<0.05)。見圖1。
3 ELISA法檢測海馬組織IL-6,IL-1β及TNF-α蛋白水平的表達變化 與卒中組比較,PSD組大鼠海馬組織中IL-6,IL-1β及TNF-α的蛋白表達明顯升高(P<0.05);與PSD組比較,FNS組三種細胞因子蛋白表達不同程度降低(P<0.05)。見圖2。
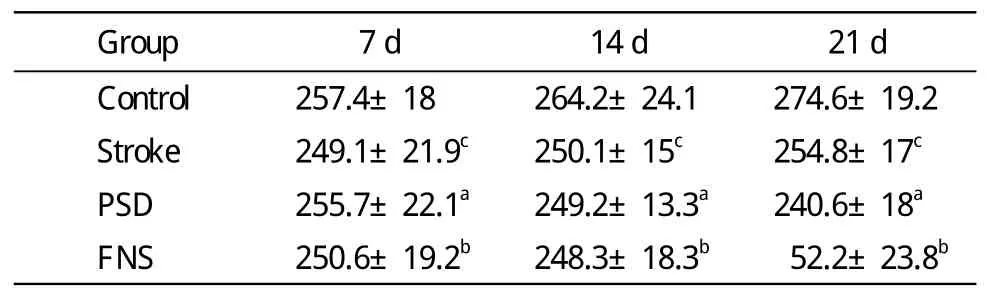
表1 各組大鼠在不同時間點的體質量變化Tab. 1 Weight of rats in different groups at different time points (g)
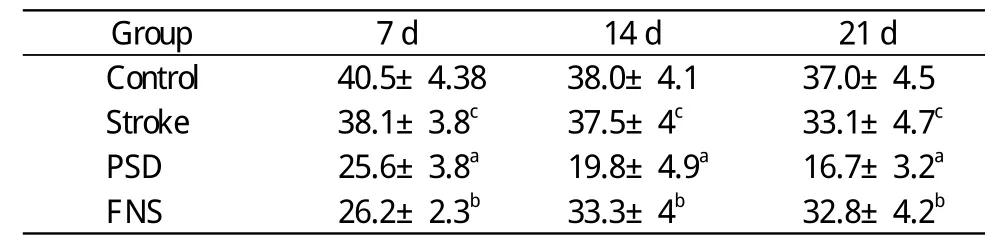
表2 各組大鼠在不同時間點的糖水消耗Tab. 2 Sugar consumption of rats in different groups at different time points (ml)
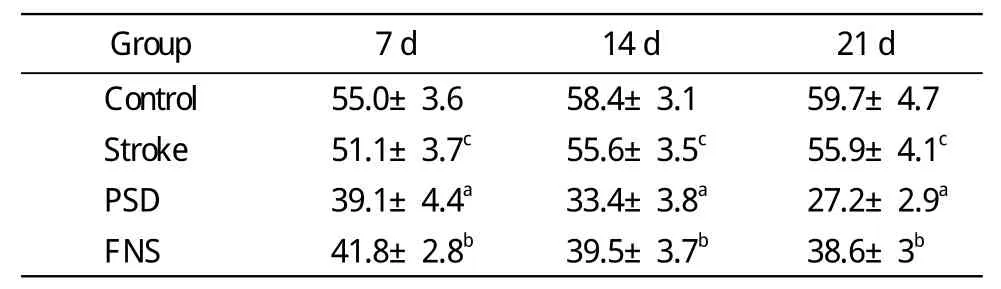
表3 各組大鼠不同時間點的垂直運動水平Tab.3 Vertical motion of rats in different groups at different time points (cm)
討 論
本研究結果表明,電刺激小腦頂核后PSD大鼠體質量增加,蔗糖水消耗增加,同時PSD大鼠在曠野試驗中水平運動評分也增加,因此,FNS后PSD大鼠的抑郁癥狀改善。Schutter等[8]在應用經顱重復電刺激小腦治療抑郁的研究中證實,電刺激小腦能顯著改善抑郁癥狀。然而,關于電刺激小腦頂核治療PSD的基礎研究尚未見報道。
本實驗也著眼于對PSD大鼠FNS前后海馬組織炎性細胞因子基因及蛋白表達變化的研究。與卒中組相比,PSD時炎性細胞因子IL-6,IL-1β及TNF-α水平明顯升高;與PSD組相比,FNS后炎性細胞因子IL-6,IL-1β及TNF-α表達顯著降低。目前,PSD的發病機制不明,細胞因子學說是公認的最重要假說,它闡述了PSD后IL-6,IL-1β及TNF-α等炎性細胞因子水平持續升高[9-10]。本研究中PSD后炎性細胞因子升高與此學說一致。同時,電刺激小腦頂核可能通過穩定細胞因子網絡改善PSD大鼠的抑郁癥狀。國內劉競麗等[11]應用電刺激小腦頂核治療PSD患者41例,結果顯著改善了PSD患者的抑郁癥狀,與本研究結果相符,但FNS后細胞因子降低的機制尚無研究。電刺激小腦頂核能極顯著地抑制炎癥反應,降低細胞因子水平,這種作用主要是通過對下丘腦外側區和室旁核的抑制來完成的[12-13]。這可能是FNS后PSD大鼠抑郁癥狀改善的原因。

圖 1 IL-6、 IL-1β and TNF-α mRNA在PSD大鼠海馬組織中的表達 與對照組比較, 卒中組3種細胞因子mRNA表達增加(aP<0.05); 與卒中組比較, PSD組3種細胞因子mRNA表達明顯增加(bP<0.01); 與PSD組比較, FNS組3種細胞因子mRNA表達下降(cP<0.05)Fig. 1 Expressions of IL-6, IL-1βand TNF-αmRNA in hippocampal tissues of PSD rats aP<0.05, vs control group, bP<0.01, vs stroke group, cP<0.05, vs PSD group
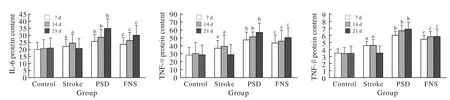
圖 2 IL-6、IL-1β and TNF-α在PSD大鼠海馬組織中的蛋白含量測定 與對照組比較,卒中組3種細胞因子蛋白含量有所增加(aP<0.05);與卒中組比較,PSD組3種細胞因子蛋白含量明顯增加(bP<0.01);與PSD組比較,FNS組3種細胞因子表達下降(cP<0.05)Fig. 2 Protein levels of IL-6, IL-1βand TNF-α in hippocampal tissues of PSD ratsaP<0.05, vs control group, bP<0.01, vs stroke group, cP<0.05, vs PSD group
目前臨床抗抑郁藥療效已經得到廣泛認可,但其價格昂貴以及不良反應給患者造成經濟負擔及身體傷害。本研究結果表明電刺激小腦頂核能顯著降低PSD大鼠海馬組織細胞因子水平,進而改善PSD大鼠的抑郁癥狀。FNS后降低海馬組織細胞因子水平的機制仍不明確,可能與其雙向免疫調節功能有關[14-15]。即維持體內免疫系統處于平衡狀態:既能提高免疫功能,又能防止免疫系統的矯枉過正,既阻止致炎性細胞因子的過度生成同時又防止抗炎性細胞因子的過度減少,從而穩定細胞因子網絡平衡,達到治療PSD的目的。國內外關于電刺激的神經保護作用研究較多,但尚未發現有關于電刺激對PSD作用研究的報道,而其對PSD時海馬組織炎性細胞因子影響的研究更尚未見報道。本實驗從此角度研究電刺激的保護作用,從而為PSD的治療提供新的思路及實驗依據。
1 Frühwald S, L?ffler H, Baumhackl U. Depression after cerebrovascular injury. Review and differentiation from other psychiatric complications[J]. Fortschr Neurol Psychiatr, 1999, 67(4): 155-162.
2 江擁軍,康濤生,肖雁.卒中后抑郁119例臨床分析[J].軍醫進修學院學報,2010,31(4):354-355.
3 Spalletta G, Bossù P, Ciaramella A, et al. The etiology of poststroke depression: a review of the literature and a new hypothesis involving inflammatory cytokines[J]. Mol Psychiatry, 2006, 11(11):984-991.
4 Nitsche MA, Boggio PS, Fregni F, et al. Treatment of depression with transcranial direct current stimulation (tDCS): a review[J]. Exp Neurol, 2009, 219(1):14-19.
5 陳佳俊,石巖殊,韓雪梅. 線栓法大鼠局灶性腦缺血模型(PMCAO)的實驗研究[J]. 吉林醫學,2004,25(10):16-17.
6 Willner P, Towell A, Sampson D, et al. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant[J]. Psychopharmacology (Berl), 1987,93(3): 358-364.
7 Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression[J].Neurosci Biobehav Rev, 1981, 5(2): 247-251.
8 Schutter DJ, van Honk J. A framework for targeting alternative brain regions with repetitive transcranial magnetic stimulation in the treatment of depression[J]. J Psychiatry Neurosci, 2005, 30(2):91-97.
9 Maes M. Evidence for an immune response in major depression:a review and hypothesis[J]. Prog Neuropsychopharmacol Biol Psychiatry, 1995, 19(1):11-38.
10 Pucak ML, Kaplin AI. Unkind cytokines: current evidence for the potential role of cytokines in immune-mediated depression[J]. Int Rev Psychiatry, 2005, 17(6): 477-483.
11 劉競麗,李勁頻,董為偉.電刺激小腦治療腦卒中后抑郁的臨床探討[J].中國臨床康復,2003,7(13):1926-1927.
12 Mani N, Khaibullina A, Krum JM, et al. Vascular endothelial growth factor enhances migration of astroglial cells in subventricular zone neurosphere cultures[J]. J Neurosci Res, 2010, 88(2): 248-257.
13 Min BI, Oomura Y, Katafuchi T. Responses of rat lateral hypothalamic neuronal activity to fastigial nucleus stimulation[J]. J Neurophysiol, 1989, 61(6): 1178-1184.
14 Sui R, Zhang L, Min L, et al. Cerebellar dysfunction May play an important role in post-stroke depression[J]. Med Hypotheses,2009, 72(6): 643-646.
15 Komaba Y, Mishina M, Utsumi K, et al. Crossed cerebellar diaschisis in patients with cortical infarction: logistic regression analysis to control for confounding effects[J]. Stroke, 2004, 35(2):472-476.

