尋常型銀屑病皮損處ASC和caspase-1的表達
胡 堅,楊閏平,李恒進,趙 華
解放軍總醫院 皮膚科,北京 100853
銀屑病是一種慢性炎癥性皮膚病,多被認為由T淋巴細胞介導,但近年來研究發現多種固有免疫細胞和成分也在銀屑病的發病中起到了重要作用。其中凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein,ASC)和半胱氨酸蛋白酶-1(caspase-1)是NLRP3(NOD-like receptor family pyrin domain containing 3)炎癥小體的組成部分。NLRP3炎癥小體作為一種固有免疫系統NOD樣受體(nucleotide binding oligomerization domain-,NOD)家族的胞內模式識別受體,通過識別多種內源性和外源性危險信號,合成和釋放IL-1β和IL-18參與炎癥反應并啟動T細胞的免疫反應[1-2]。以往研究發現,NLRP3炎癥小體參與了類風濕性關節炎、2型糖尿病、克羅恩病等疾病的發生[3],而銀屑病同樣作為一種非感染性炎癥性疾病,NLRP3炎癥小體是否參與其發病研究尚少。我們采用免疫組化方法對尋常型銀屑病皮損中ASC和caspase-1的表達進行了檢測,并與正常人對照。
對象和方法
1 研究對象 2011年2月-2012年5月我科門診確診的尋常型銀屑病30例,其中首次發病5例,復發25例,均為進展期,男18例,女12例,年齡23~54(40.45±9.58)歲,病程2個月~20年,銀屑病皮損面積和嚴重程度指數評分為5.61~20.10(12.34±5.02)分,所有患者2個月內無系統用藥,2周內未使用銀屑病外用藥物。正常對照20例,年齡、性別與銀屑病患者匹配,為我科色痣患者切除時距離色痣邊緣3 mm以外的周邊正常組織。
2 免疫組化檢測 小鼠ASC、caspase-1多克隆抗體購自美國Abcam公司。常規方法制作標本,2 μm厚度連續切片,Elivision免疫組化染色:高壓鍋加熱修復,雙氧水消除過氧化酶,分別滴加1∶100 ASC和1∶100 caspase-1一抗,4 ℃濕盒過夜后PBS洗3次,每次3 min,滴加二抗,室溫靜置20 min后PBS再洗3次,加三抗,操作步驟同前。DAB顯色,蘇木素復染,脫水、透明、中性樹膠封片。以PBS代替一抗作陰性對照。
3 結果判定 以細胞質和細胞核棕黃色或棕褐色為陽性。由兩位醫生對免疫組化染色進行評估。每張切片隨機觀察5個視野(×400),計算平均每100個角質形成細胞中染色陽性細胞百分比,以及染色強度進行綜合評分。根據陽性細胞比例,<5%、5~25%、26%~50%、51%~75%和 ≥76%分別計為0~4分;并按染色強度無、弱、中、強分別計為0~3分。綜合兩個指標將評分分為4級,0分為陰性、1~3分為弱陽性、4~5分為陽性、6~7分為強陽性。
4 統計學處理 采用SPSS17.0統計軟件進行統計學處理,兩獨立樣本正態分布定量資料,但組間方差不齊,采用Wilcoxon秩和檢驗,P<0.05為差異有統計學意義。
結 果
1 ASC兩組表皮中的表達 銀屑病患者皮損處表皮全層強陽性表達ASC,主要分布在胞漿、胞核,少數表達于胞膜,免疫組化綜合評分為4.48±0.36;正常人對照ASC主要表達于表皮中、下部,胞膜、胞漿、胞核均有表達,以輕、中度表達為主,免疫組化綜合評分為2.10±0.24。兩組比較差異有統計學意義(t=49,P<0.01),見圖1。
2 Caspase-1兩組表皮中的表達 在銀屑病患者皮損處caspase-1亦表達于表皮全層,位于胞漿,染色呈強陽性,免疫組化綜合評分為3.95±0.53;正常人對照caspase-1表達于基底細胞和棘細胞層下部,染色強度較弱,免疫組化綜合評分為1.48±0.22。兩組比較差異有統計學意義(t=55,P<0.01),見圖2。
討 論
在銀屑病的發病機制中,T淋巴細胞介導的適應性免疫反應被認為具有重要作用。固有免疫系統通過產生和釋放一系列細胞因子、趨化因子、內源性抗微生物物質及激活固有免疫細胞和轉錄因子來消除外來病原,并啟動適應性免疫反應,其可能的作用途徑有:1)Toll樣受體(TLRs):研究發現,銀屑病皮損處表皮上層角質形成細胞高表達TLR1、TLR2,低表達TLR3、TLR4,此外使用TLR7激動劑咪喹莫特可加重銀屑病皮損。TLR作為一種模式識別受體,通過MyD88/IRAK/TRAF6信號轉導途徑激活NF-κB,從而激活下游免疫反應。2)抗菌肽(AMPs):由角質形成細胞和免疫細胞表達。AMPs除殺傷微生物外,AMPs的高表達可能通過募集炎癥細胞而促進局部炎性反應、血管生成、角質形成細胞增殖,從而形成銀屑病皮損。3)角質形成細胞:作為一種前炎性細胞生產TNF-α、IL-1α、IL-6等細胞因子,繼而誘導IL-8等趨化因子的產生而趨化中性粒細胞和T淋巴細胞。4)NKT細胞:生成IFN-γ啟動適應性免疫,IFN-γ是導致銀屑病的重要介質。5)DC細胞:表達自身肽/MHC復合物誘導T細胞的失能以及Treg細胞的產生,從而打破免疫活性和免疫耐受的平衡,誘導慢性炎癥反應,并可加強NKT細胞的活性。6)補體系統:C5a等誘導中性粒細胞和淋巴細胞浸潤,C5b-9也可能促進角質形成細胞的增殖[4-5]。
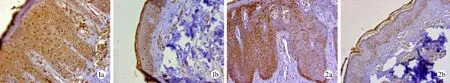
圖 1 a: SC表達于銀屑病皮損處表皮全層 ,呈強陽性 ,免疫組化(×200); b: ASC在正常人表皮表達較弱,免疫組化(×200)圖 2 a: caspase-1表達于銀屑病皮損處表皮全層,呈強陽性 ,免疫組化(×200); b: caspase-1表達于正常人表皮中、下部,且染色強度弱,免疫組化(×200)Fig. 1 a:Immunohistochemical staining of ASC in psoriasis vulgaris patients(×200); b: Immunohistochemical staining of ASC in epidermis of normal persons(×200)Fig. 2 a: Immunohistochemical staining of caspase-1 in psoriasis vulgaris patients(×200); b: Immunohistochemical staining of caspase-1 in epidermis of normal persons(×200)
NLRP3炎癥小體是近年來引起關注的一種固有免疫系統的胞漿內模式識別受體,是由NLRP3、接頭蛋白ASC、半胱氨酸蛋白酶前體procaspase-1共同形成的功能性多蛋白復合體。NLRP3炎癥小體作為固有免疫和適應性免疫之間的重要聯系,通過識別內源性與外源性危險信號,參與啟動適應性免疫應答。ATP、ROS、紫外線、微生物及其產物等促使NLRP3在胞漿內寡聚并募集ASC和前caspase-1,前caspase-1自活化形成caspase-1,裂解前IL-1β和前IL-18為有活性的IL-1β和IL-18[6]。IL-1β 和IL-18同屬IL-1家族,被認為在銀屑病等炎癥性皮膚病的發病中發揮重要作用[7]。IL-1β和IL-18調節Th17細胞分化,促進IL-17產生,同時誘導IFNγ的產生。此外NLRP3炎性小體還參與、促進初始T細胞形成Th1和Th17效應細胞,從而參與銀屑病發病過程[1-8]。
本實驗結果表明,銀屑病皮損處ASC和caspase-1在表皮全層強陽性表達,ASC在正常對照組雖然全層表達,但染色強度較弱;而caspase-1在正常對照組僅表達在基底層細胞和棘細胞層下部。國外研究亦顯示,銀屑病皮損處ASC和caspase-1表達增強,caspase-1的活化以及之后的IL-1β和IL-18的產生、分化、成熟對于銀屑病的炎癥過程具有關鍵作用[7-9]。高表達的ASC和caspase-1提示銀屑病皮損中NLRP3炎癥小體活性增強,NLRP3炎癥小體通過誘導IL-1β、IL-18的合成,啟動了Th1和Th17細胞介導的適應性免疫應答和炎癥反應,促進了銀屑病的發生和發展,同時也提示角質形成細胞作為一種重要的免疫細胞參與了發病過程[10]。新近研究還發現NLRP3基因rs10733113位點的單核苷酸多態性與銀屑病的遺傳易感性相關,該發現支持固有免疫在銀屑病的發病機制中發揮作用[3]。
1 黃謙,謝青. NLRP3炎性小體與適應性免疫研究進展[J]. 國際流行病學傳染病學雜志,2012,39(2):125-128.
2 林靜,李大主. 細胞焦亡:一種新的細胞死亡方式[J]. 國際免疫學雜志,2011,34(3):213-216.
3 Carlstr?m M, Ekman AK, Petersson S, et al. Genetic support for the role of the NLRP3 inflammasome in psoriasis susceptibility[J]. Exp Dermatol, 2012, 21(12): 932-937.
4 Büchau AS, Gallo RL. Innate immunity and antimicrobial defense systems in psoriasis[J]. Clin Dermatol, 2007, 25(6): 616-624.
5 Bos JD, de Rie MA, Teunissen MB, et al. Psoriasis: dysregulation of innate immunity[J]. Br J Dermatol, 2005, 152(6): 1098-1107.
6 江興林,左云飛. 細胞凋亡相關斑點樣蛋白與半胱氨酸蛋白酶-1在肝癌中的表達及臨床意義[J]. 中國醫師雜志,2011,13(5):584-586.
7 Johansen C, Moeller K, Kragballe K, et al. The activity of caspase-1 is increased in lesional psoriatic epidermis[J]. J Invest Dermatol,2007, 127(12): 2857-2864.
8 Kanazawa N. Rare hereditary autoinflammatory disorders: towards an understanding of critical in vivo inflammatory pathways[J]. J Dermatol Sci, 2012, 66(3): 183-189.
9 Salskov-Iversen ML, Johansen C, Kragballe K, et al. Caspase-5 expression is upregulated in lesional psoriatic skin[J]. J Invest Dermatol, 2011, 131(3): 670-676.
10 Kopfnagel V, Wittmann M, Werfel T. Human keratinocytes Express AIM2 and respond to dsDNA with IL-1β secretion[J]. Exp Dermatol, 2011, 20(12): 1027-1029.

