原子力顯微鏡對常用7種單克隆抗體形態的觀察
侯永微,紀小龍,王美娥遼寧醫學院 病理學與病理生理學,遼寧錦州 00;武警總醫院 病理科,北京 00039
原子力顯微鏡(atomic force microscope,AFM)在醫學領域中的應用越來越廣泛,并已在各系統的正常及病變的細胞膜形態的探索上取得了很多成果[1-2]。目前臨床免疫組織化學過程中出現的假陽性、假陰性、共同表達、例外表達等問題的進一步解釋亟需抗原及抗體高分辨率的成像。因此,抗體分子的成像也是AFM研究的熱門內容,并可間接了解相應抗原的形態,為抗原-抗體結合提供直觀的形態學基礎。本文應用AFM觀察常用的7種鼠抗人單克隆抗體的形態,初步探討不同抗體形態的相對特異性。
材料和方法
1 試劑和儀器 近1個月內中杉金橋公司制備的7種鼠抗人單克隆抗體(廣譜細胞角蛋白、波形蛋白、白細胞共同抗原、S100蛋白、細胞角蛋白7、Dog-1、甲狀腺球蛋白)的工作液。ECLIPSE TE2000-U倒置相差顯微鏡(購自日本NIKON公司);Nanoscope Ⅲa型原子力顯微鏡(購自Digital Instruments Inc,Santa Barbara,CA),采用氮化硅(Si3N4)懸臂,SNL-10型針尖(contact模式),微懸臂長85 μm,力常數2.5 N/m,探針針尖曲率半徑為20~30 nm,X軸掃描256線。
2 制備掃描樣本 先將載玻片(單頭單面硅化黏附載玻片)用記號筆圈定直徑為1.5 cm的圓形范圍,將上述7種鼠抗人單克隆抗體的工作液分別滴加于載玻片上并均勻鋪于圓形范圍內,每張載玻片滴加1滴,將載玻片放入加有10%中性緩沖甲醛的濕盒內,置于37 ℃,1 h后,取出載玻片,于蒸餾水中輕輕涮洗1 min,取出,置于超凈工作臺(上海錦屏儀器儀表有限公司,型號為SW-CJ-3)中晾干以備掃描。依上述方法同時制備不滴加任何抗體的空白載玻片作為對照。
3 AFM掃描7組樣品 載玻片晾干后置于AFM載物臺上,利用Nikon倒置顯微鏡觀察抗體的分布情況,選取分散較好,呈點狀均勻分布的區域,在操作軟件中選擇contact模式進行掃描。每組掃描10張樣本片,每張掃描10個部位,每個部位按100 μm-50 μm-20 μm-10 μm-5 μm-1 μm范圍依次進行掃描,掃描頻率為0.5 Hz,空氣濕度50%,溫度25 ℃。觀察各組抗體形態的差異,并利用AFM圖像分析系統對掃描顆粒的寬度、最大峰高度和平均粗糙度進行定量測量。
4 統計學方法 采用SPSS13.0統計軟件對所得數據進行分析,7組樣品的寬度(width)、最大峰高度(maximum height)、平均粗糙度(mean roughness)以-x±s表示,方差分析, P<0.05為差異有統計學意義。
結 果
1 倒置相差顯微鏡觀察 抗體沉淀黏附法制備的樣品在倒置相差顯微鏡下觀察時背景干凈、抗體分散度較好,利于AFM的掃描。
2 AFM掃描成像 1)細胞角蛋白鼠抗人單克隆抗體的2D圖像見長桿狀物質,由多個小類圓形物組合在一起,也有部分比圖A所示更加長而窄,部分呈類橢圓形;在3D圖像上突起似幾座山峰連在一起(圖1)。2)波形蛋白鼠抗人單克隆抗體的2D圖像見類圓形但局部不規則的物質,中心最亮,四周稍暗;3D圖像上見高低起伏的突起,中間最高,四周環繞稍低的突起,如幾座小山峰圍繞一座主峰(圖1)。3)白細胞共同抗原鼠抗人單克隆抗體的2D圖像中見由多個大小不一、形狀不規則形物質組成類圓形,且表面明暗不一;3D圖像中見突起高低起伏,中間最高。4)S100蛋白鼠抗人單克隆抗體的2D掃描圖中見不規則長條形結構,明暗不一;3D圖像中見不規則長形突起,表面凹凸不平,由多個大小不等的突起組成。5)Dog-1鼠抗人單克隆抗體的2D圖像中見類圓形的物質,明暗不一致;3D圖中可見不規則突起,似“山包”,表面凹凸不平,為多個小“山包”組成。6)細胞角蛋白7鼠抗人單克隆抗體的黏附載玻片上掃描的2D圖中可見類圓形物質,亮度較一致;3D掃描圖見半球形“山包”狀突起。7)甲狀腺鼠抗人單克隆抗體的2D圖像中可見三角形物質,明暗不一,由多個不規則形物質組成;3D圖像見突起呈三角錐形,表面凹凸起伏(圖1)。
3 各組單克隆抗體形態的參數分析 廣譜細胞角蛋白鼠抗人單克隆抗體為長桿狀,其寬度明顯大于其他6組(P<0.05),Dog-1鼠抗人單克隆抗體的寬度大于細胞角蛋白7(P<0.05),其他各組間單克隆抗體的寬度差異無統計學意義(P>0.05);細胞角蛋白7鼠抗人單克隆抗體的最大峰高度大于廣譜細胞角蛋白、甲狀腺球蛋白、Dog-1鼠抗人單克隆抗體(P<0.05),Dog-1鼠抗人單克隆抗體的最大峰高度大于白細胞共同抗原鼠抗人單克隆抗體(P<0.05),其他各組間單克隆抗體的最大峰高度無統計學差異(P>0.05);各組間平均粗糙度無統計學差異(P>0.05),見表1。
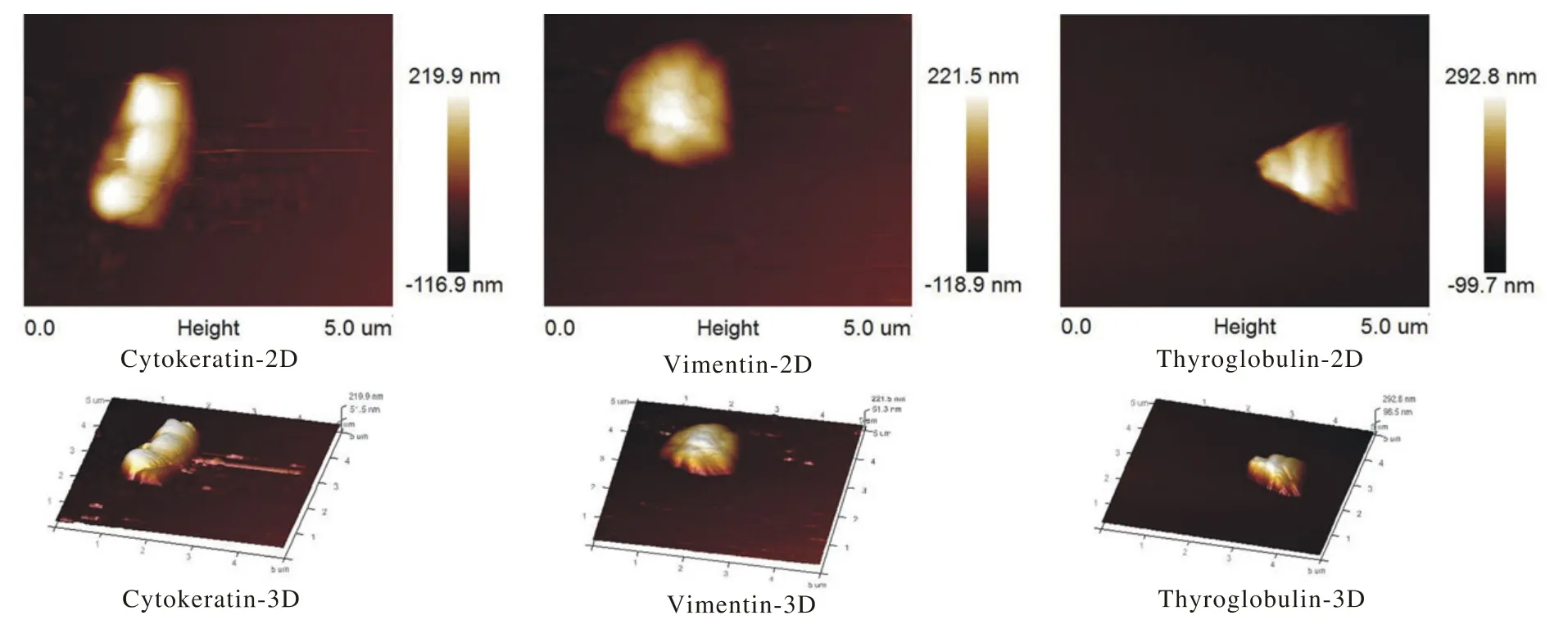
圖 1 三種具有代表性形態的單克隆抗體2D與3D圖Fig. 1 2D and 3D of 3 monoclonal antibodies with representative morphologies
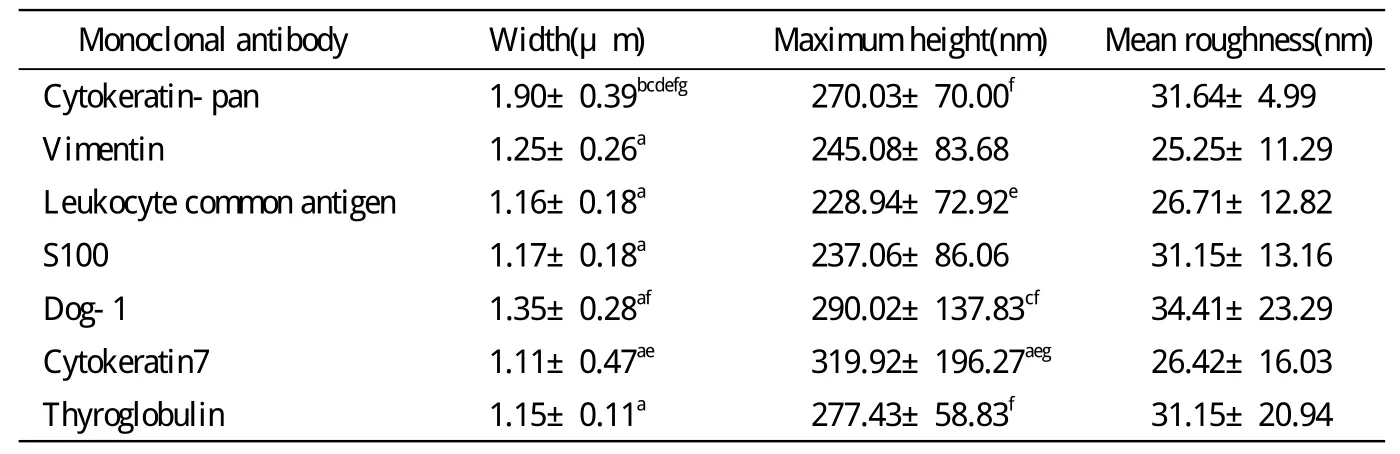
表1 7組單克隆抗體寬度、最大峰高度、平均粗糙度的比較Tab. 1 Width, maximum height and mean roughness of 7 monoclonal antibodies
討 論
目前常用的基質材料有云母、二氧化硅、金屬、聚苯乙烯等[3]。本實驗顯示黏附載玻片可以作為AFM掃描中方便實用的材料之一。甲醛是公認的組織細胞固定液,有保持細胞形態、保護蛋白的作用,而乙醇會使細胞變性,丙酮會使細胞萎縮變性[4]。由于10%甲醛溶液中含不規則形的顆粒,因此本研究用10%中性緩沖甲醛的蒸汽固定法保持抗體形態[5]。
細胞角蛋白(cytokeratin,CK)是細胞骨架蛋白中最為復雜的中間絲,它由30多種不同的基因編碼,可以轉錄成20多種不同的多肽,主要表達在各種上皮細胞中。AE1/AE3是廣譜抗細胞角蛋白抗體,是AE1克隆與AE3克隆的混合[6];用于上皮細胞及上皮細胞來源腫瘤的標記。克隆AE1識別Ⅰ型細胞角蛋白CK10、CK15、CK16、CK19;克隆AE3識別CK1、CK2、CK3、CK5、CK6及CK8。不同公司的廣譜抗細胞角蛋白抗體識別的種類并不完全一致。而掃描出來的廣譜CK抗體形態并不單一也說明了此抗體是多種單克隆抗體的混合液。
應用原子力顯微鏡對各組單克隆抗體平均粗糙度的觀察測量得出各組間差異無統計學意義。這與細胞之間測量的結果不同,正常細胞與腫瘤細胞之間表面的平均粗糙度可得出明顯的差異[2]。癌細胞膜表面粗糙度增加與其抗體表達的種類和數量有關,如Kaul-Ghanekar等[7]發現相對于正常相鄰近的組織切片,SMAR1表達減低的人類乳腺癌組織切片的表面粗糙度增高,然而不同種類抗體本身的平均粗糙度是否有明顯差異需進一步研究。
目前,對于抗原-抗體之間作用力的研究較多,而對于特異性抗體形態的研究較少[8-9]。本實驗中用AFM掃描的7種單克隆抗體中形態各不相同,但其2D形態圖大其致可分為三種:類圓形、不規則長桿形和三角形。對于更多抗體的掃描將會觀察到更多特異的形態。這在形態上直觀地印證了不同抗體的多態性及每種抗體具有相對特異性。在不同種類及不同分化階段的細胞中表達的抗原是不同的,明確抗體的特異形態對各種抗體形態的觀察為在少量細胞情況下,滴加相應抗體進行AFM掃描來判斷細胞種類、分化程度及其與癌癥的關系提供形態學基礎。
通過對7種單克隆抗體形態的觀察,我們初步認為,抗原-抗體結合如鎖-鑰匙的關系,應是一一對應的,但當某些抗體的形態極為相似時,也有可能會同時與兩種抗原結合,即出現一把鑰匙開兩把鎖的情況,這是“例外表達”的形態學基礎。AFM對更多抗體納米級形態的觀察分析將對細胞抗原的共同表達及例外表達提供更加客觀的解釋。
1 Binnig G, Quate CF, Gerber C. Atomic force microscope[J]. Phys Rev Lett, 1986, 56(9): 930-933.
2 王曉東,舒清明.醫學中原子力顯微鏡在細胞層面的應用[J].軍醫進修學院學報,2011,32(1):97-99.
3 Ouerghi O, Touhami A, Othmane A, et al. Investigating specific antigen/antibody binding with the atomic force microscope[J].Biomol Eng, 2002, 19(2-6):183-188.
4 郭以河,張閩峰,孟加榕,等.不同固定方法對胸水細胞塊組織形態及免疫細胞化學的影響[J].現代腫瘤醫學,2010,18(10):1925-1927.
5 馬亞敏,紀小龍,尹彤,等.原子力顯微鏡對9種常用液體有形顆粒的觀察[J].中國實驗診斷學,2004,8(1):38-39.
6 初培國.細胞角蛋白染色在腫瘤診斷中的應用[J].中華病理學雜志,2004,33(3):273-276.
7 Kaul-Ghanekar R, Singh S, Mamgain H, et al. Tumor suppressor protein SMAR1 modulates the roughness of cell surface: combined AFM and SEM study[J]. BMC Cancer, 2009, 9:350.
8 Lv Z, Wang J, Chen G, et al. Probing specific interaction forces between human IgG and rat anti-human IgG by self-assembled monolayer and atomic force microscopy[J]. Nanoscale Res Lett,2010, 5(6): 1032-1038.
9 Wakayama J, Sekiguchi H, Akanuma S, et al. Methods for reducing nonspecific interaction in antibody-antigen assay via atomic force microscopy[J]. Anal Biochem, 2008, 380(1): 51-58.

