替米沙坦對糖尿病大鼠腎臟表達E-選擇素的影響
馬 旭 邵鳳明 (河南省人民醫院腎內科,河南 鄭州 450003)
糖尿病腎病(DN)是糖尿病(DM)最為嚴重的慢性微血管并發癥之一,嚴重影響患者的生活質量和威脅患者的生命,但其發病機制尚未完全清楚。研究提示,E-selectin介導的炎癥反應參與了DN發生發展,能增加尿蛋白,促進細胞外基質的沉積,引起腎小球纖維化〔1,2〕。有學者觀察血管緊張素受體Ⅱ(AngⅡ)拮抗劑(ARB)通過抑制黏附分子合成而減輕腎小球炎癥〔3〕。本文旨在觀察替米沙坦對DM大鼠腎小球E-selectin表達的影響,從黏附分子角度探討替米沙坦對DN保護機制。
1 材料與方法
1.1 材料:全自動生化分析儀(美國Beckman公司,CX5CE);HIMAS-2000圖像分析系統(湖北千屏影像有限公司);STZ(美國Sigma公司,批號:BF1003);替米沙坦(德國勃林格殷格翰制藥有限公司);SP試劑盒(北京中山公司,);山羊抗大鼠ICAM-1和山羊抗大鼠VCAM-1抗體(Santa Cruz公司);Trizol試劑盒(美國GIBCO公司)。健康SD大鼠30只,雄性,體重(180±20)g(鄭州大學醫學院實驗動物中心提供)。
1.2 方法
1.2.1 動物模型的建立與分組 健康雄性SD大鼠,于左腎切除后1 w,大鼠禁食10 h后,單次腹腔注射50 mg/kg鏈脲質毒素(STZ),用0.1 mol/lL無菌檸檬酸緩沖液配制,pH4.5)。72 h后取尾靜脈血測血糖,尿糖試紙測尿糖。血糖≥16.7 mmol/L,尿糖(3+~4+)者選入DM大鼠模型〔2〕。正常對照組僅注射等量的檸檬酸緩沖液。DM大鼠隨機分成DM組10只;替米沙坦組R組10只;正常對照組C組替米沙坦10只。各組以替米沙坦5 mg·kg-1·d-1ig給藥;其他兩組每天同體積生理鹽水灌胃。所有大鼠在整個灌胃期間均飼以標準飲食,不使用胰島素。12 w后處死并收集3 ml下腔靜脈血及處死前24 h尿,留取右側腎臟,稱重,部分腎組織以10%甲醛固定,其余組織置于-80℃冰箱中凍存。
1.2.2 生化檢查 留24 h尿檢測尿蛋白定量。血標本檢測血糖、血肌酐。并計算左腎重與體重之比。
1.2.3 腎組織病理學檢查 腎小球PAS染色及病理程度分析:常規固定、包埋、3 μm切片PAS染色。高倍鏡下順序觀察,每張切片觀察5個腎小球,每組5張切片,用HIMAS-2000圖像分析系統定量測量每個腎小球面積(GA),腎小球內細胞外基質面積(ECM),結果用ECM/GA表示,代表腎小球增生程度。
1.2.4 免疫組化 采用SP法。腎臟標本固定,石蠟包埋切片,分別按試劑盒說明進行E-selectin染色。再由兩位免疫病理人員對染色標本進行評定并觀察陽性細胞在腎小球內的分布。利用HIMAS-2000病理圖像分析系統,測定E-selectin陽性著色的平均灰度×面積比。對E-selectin進行半定量分析。
1.2.5 腎組織總蛋白提取和Western-印跡檢測 稱取100 mg腎組織,剪碎,1 ml蛋白裂解液(50 mmol/L Tris〔pH7.5〕,150 mmol/L NaCl,5 mmol/L MgCl2,5 mmol/L EDTA,0.5%NP40,1 mmol/L PMSF,20 μg/ml Aprotintin)中勻漿后考馬斯亮藍G250測蛋白濃度。取腎組織蛋白100 μg經10%的SDSPAGE凝膠電泳后,轉移至硝酸纖維素膜上,用含5%脫脂奶粉的TBST溶液4℃封閉過夜,加入山羊抗大鼠E-selectin 4℃過夜,再用AP標記的兔抗山羊IgG進行雜交,洗膜后進行NBT/BCIP顯色。雜交結果MGIAS-1000凝膠成像分析系統測量吸光度值。
1.3 統計學分析 利用SPSS13.0軟件,計量數據用表示,多組間比較采用方差分析,兩組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 生化、腎重及病理改變 與正常對照組相比,DM組及替米沙坦組大鼠血糖、蛋白尿定量、血清肌酐均顯著性升高(P<0.01)。與DM組相比,替米沙坦組大鼠蛋白尿定量與血清肌酐顯著降低(P<0.01),血糖無明顯變化。與正常對照組相比,DM組大鼠腎臟重量增大,替米沙坦組腎重小于DM組并大于正常對照組,但無顯著性意義。見表1。大鼠腎組織光鏡下可見DM組及替米沙坦組腎小球部分體積增大,系膜區有不同程度增生,間質可見中性粒及單核淋巴細胞浸潤,正常對照組未見明顯異常。見圖1和圖2。
表1 各組大鼠血、尿生化結果(,n=10)

表1 各組大鼠血、尿生化結果(,n=10)
與正常對照組相比:1)P<0.05,2)P<0.01;與DM組相比:3)P<0.05,4)P<0.01
組別 血糖(mmol/L) 尿蛋白(mg/d) 血清肌酐(μmol/L) ECG/GA 腎重/體重(×10-3)正常對照組 5.46±0.79 10.50±2.48 58.69±12.63 0.21±0.034.70±0.67 DM組 22.38±2.371) 59.03±11.371) 152.12±18.631) 0.63±0.041) 8.92±0.851)替米沙坦組 20.50±1.731) 38.21±3.71)2) 89.09±12.393)4) 0.41±0.033)4) 7.66±1.001)

圖1 各組腎臟病理結果(PAS,×400)
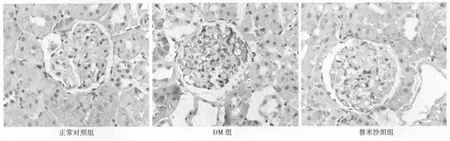
圖2 各組E-selectin免疫組化檢測結果(×10)
2.2 E-selectin免疫組化及Western印跡結果 E-selectin免疫組化及Western印跡結果示表達呈相同趨勢,與正常對照組比較,DM組及替米沙坦組E-selectin表達增加(P<0.01),但R組表達顯著低于DM組(P<0.01)。見表2,見圖3。
表2 各組大鼠E-selectin免疫組化及Western印跡結果(,n=6)

表2 各組大鼠E-selectin免疫組化及Western印跡結果(,n=6)
與正常對照組相比:1)P<0.01;與DM組相比:2)P<0.01
組別 免疫組化 Western 0.18±0.06 0.02±0.03 M組 2.13±0.181) 0.23±0.261)R組 1.18±0.261)2) 0.07±0.181)2)印跡C組

圖3 各組E-selectin免疫印跡結果
3 討論
本實驗模型成功,與文獻〔4〕基本一致,大鼠尚處于DN早期。DN時白細胞在腎小球和腎間質的浸潤是DN組織的特征性表現之一,并在腎小球硬化方面起重要作用。Hirata等〔5〕發現在DN患者中,E-selectin沿腎小球毛細血管及系膜區分布,DN組與其他腎病組(微小病變性腎病、膜性腎病、狼瘡腎炎等)比較,腎組織中E-selectin表達增加有顯著意義。由此認為E-selectin介導的腎小球、間質炎性細胞浸潤可能是間質纖維化、細胞外基質增生、腎小球硬化的重要機制。Narumi等〔6〕通過原位雜交的方法檢測DNkk-ay小鼠腎小球E-selectin表達,發現與對照組比較,E-selectin表達明顯增加,說明E-selectin可能參與DN的發生發展。同時,Tailor等〔7〕發現在伴有微血管并發癥〔DM視網膜病變(DR)和(或)DN〕的DM患者血清中可溶性E-selectin水平明顯高于無糖尿病微血管并發癥的患者。另外,Shestakora等〔8〕發現在不同階段1型DM患者中,有DR、微量或大量蛋白尿患者的血循環E-selectin水平明顯要比沒有這些病變患者的高,而且增加的水平與患者的性別、血中膽固醇及甘油三酯的水平與明顯關系。由此可見E-selectin是DN發展的重要環節。
本實驗結果表明E-selectin可能在高糖狀態下被激活,E-selectin屬于黏附分子中選擇素家族,主要分布于內皮細胞和系膜細胞,通過識別特異性的碳水化合物基團介導內皮細胞與單核/巨噬細胞和淋巴細胞的黏附,從而有助于這些炎癥細胞游走到腎小球,產生一系列的細胞因子參與DM微血管病變的發生發展〔9,10〕。許多研究表明,內皮功能損傷與DM微血管病變的發生緊密相連,而Bernd等〔11〕發現黏附分子介導的內皮細胞與白細胞的相互作用在內皮損傷的發生發展中占重要地位。本實驗進一步證實了E-selectin在DN發展中的作用。
有研究證實腎素-血管緊張素系統參與了DN的進展,其中AngⅡ起重要作用〔12,13〕。DM時高血糖使腎素-血管緊張素系統活性增高,尤其是腎組織中AngⅡ含量增加,導致血管通透性增加,炎癥細胞浸潤〔14〕。替米沙坦作為半衰期最長的受體拮抗劑,能夠持久平穩地抑制AngⅡ,從而減少炎癥因子的表達、腎小球系膜炎癥細胞的浸潤〔15〕。
替米沙坦是一種高活性高選擇性的AngⅡ受體拮抗劑,AngⅡ通過與血管、腎臟、心臟、腎上腺上的AT1受體結合發揮其作用。本實驗提示替米沙坦可直接或間接通過降低E-selectin表達來改善DM大鼠腎臟病變。但替米沙坦究竟是通過哪些環節影響E-selectin的表達,有待于進一步闡明。
1 王奕麗,劉國良.2型糖尿病患者早期腎臟改變與血清可溶性E-選擇素的相關關系〔J〕.中國糖尿病雜志,2003;11(5):373-4.
2 刑玉波.黏附分子與糖尿病〔J〕.國外醫學·內分泌學分冊,2001;21(1):62.
3 郭志勇,崔若蘭.細胞間黏附分子-1在腎小球炎癥過程中的作用及氯沙坦對其影響〔J〕.第二軍醫大學學報,2000;21(1):42-4.
4 Sviglerova J,Kuncova J,Tonar Z.Streptozotocirrindudced model of type 1 diabetes mellitus〔J〕.Cesk Fysiol,2006;55(3):96-102.
5 Hirata K,Shikata K,Matsuda M,et al.Increased expression of selectins in kidneys of patients with diabetic nephropathy〔J〕.Diabetologia,1998;41(2):185-92.
6 Narumi S,Onozato ML,Tojo A,et al.Tissue-specific induction of E-selectin in glomeruli is augmented following diabetes mellitus〔J〕.Nephron,2001;89(2):161-71.
7 Tailor A,Granger DN.Role of adhesion molecules in vascular regulation and damage〔J〕.Curr Hypertens Rep,2000;2(1):78-83.
8 Shestakova MV,Kochemasova TV,Gorelysheva VA,et al.The role of adhesion molecules(ICAM-1 and E-selectin)in development of diabetic microangiopathies〔J〕.Ter Arkh,2002;74(6):24-7.
9 Blaha V,Andrs C,Smahelova A,et al.Effect of atorvastatin on soluble CD14,CD40 ligand,sE-and sP-selectins and MCP-1 in patients with type 2 diabetes mellitus:relationship to cholesterol turnover〔J〕.Pharmacol Res,2006;54(6):421.
10 Hirata F,Yoshida M,Ogura Y.High glucose exacerbates neutrophil to human retinal endothelial cells〔J〕.Exp Eye Res,2006;82(1):179.
11 Bernd J,Susanne D,Nicde H,et al.Effects of hyerinsulinemia on plasma levels of circulating adhesion molecules〔J〕.J Clin Endocrinol Metab,2000;85(5):1748-51.
12 劉志紅,黎磊石.探索糖尿病腎病防治的新途徑〔J〕.腎臟病與透析移植雜志,2002;11(1):120.
13 段建召,李慧芳,王 霞,等.伊貝沙坦對糖尿病腎病大鼠血漿中AngⅡ濃度及T-PA和 TAI-1活性的影響〔J〕.重慶醫學,2004;33(10):1515.
14 曾龍驛,林可意.伊貝沙坦對糖尿病大鼠腎氧化應激、活性和ICAM-1表達的影響〔J〕.中山大學學報,2008;29(4):402-6.
15 Benson SC,Pershadsingh HA,Ho CI,et al.Identification of temisartan as a unique angiotensinⅡreceptor antagonist with selsctive PPARgammamodulating activity J〔J〕.Hypertension,2004;43(5):993-1002.

