2型糖尿病大血管病變患者血清IL-17水平變化及意義
樓旭丹 汪海東 陳 芳 夏世金 孫 皎 (復旦大學附屬華東醫院內分泌科,上海 200040)
白細胞介素-17(IL-17)是新發現的促炎性細胞因子,由初始CD4+T細胞誘導分化的新型效應性輔助性T細胞(Th17)產生〔1〕。早期基于小鼠的研究指出Th17細胞是自身免疫性疾病發生時的一種病理性細胞,可伴隨IL-17在血清及局部組織中的表達增加。IL-17與特異性受體(IL-17R)結合后通過磷酸肌醇3肌酶/蛋白激酶B/胞外信號調節激酶(PI3K-Akt-ERK)依賴途徑、絲裂原活化蛋白激酶(p38 MAPK)途徑等炎癥信號傳導通路活化多種細胞產生炎性介質〔2〕,因此被認為與組織炎癥反應和自身免疫性疾病密切相關。本文前期工作證實在自身免疫性糖尿病小鼠發病初期,IL-17蛋白和mRNA表達水平顯著升高,而且IL-17可加速自身免疫性非肥胖性糖尿病(NOD)小鼠胰島炎和糖尿病的發生〔3〕,但IL-17在糖尿病大血管病變患者血清中的表達變化尚未可知。本研究旨在探討IL-17與T2DM大血管病變之間的相關性,為臨床診治提供新思路。
1 材料與方法
1.1 研究對象 T2DM組162例(男75例,女87例),均為我院2011~2012年住院及門診患者,符合1999年世界衛生組織WHO糖尿病診斷標準;年齡38~67〔平均(58.84±10.51)〕歲,根據是否合并糖尿病血管病變,分為大血管病變組90例和無血管病變組72例。大血管病變診斷至少應符合以下任1條標準:有心絞痛或心肌梗死病史,經動態心電圖和超聲心動圖或經冠狀動脈造影確診的臨床冠心病;有腦血管意外病史,頭顱CT或MRI掃描明確有缺血病灶;多普勒超聲檢查可見頸或雙下肢動脈血管壁硬化斑塊或血栓形成或動脈廣泛不規則狹窄;下肢缺血性臨床表現(間歇性跛行、缺血性疼痛、壞疽等)。正常對照組68例(男31例,女37例),為同期查體健康者,年齡41~65〔平均(56.19±9.06)〕歲,空腹及餐后2 h血糖均正常。組間年齡、性別差異無統計學意義(P>0.05)。排除糖尿病急性并發癥及其他可導致糖代謝紊亂的內分泌疾病;嚴重心、腦、血管并發癥,包括6個月內有急性心肌梗死、血管成形術及有應激史(外傷、手術、精神刺激等);肝、腎功能不全或合并急、慢性感染者;嚴重原發性疾病,如惡性腫瘤、自身免疫性疾病;近期使用羥甲基戊二酸單酰輔酶A還原酶(HMG-CoA)抑制劑、降糖藥物或胰島素治療者。
1.2 臨床資料 對研究對象測量身高、體重,并計算體質指數〔BMI=體重(kg)/身高(m)2〕,測量坐位,收縮壓(SBP)和舒張壓(DBP),2次取平均值。所有受試者均在基礎狀態下普通飲食,禁食8~12 h后空腹靜脈采血5 ml,測定空腹血糖(FPG)(葡萄糖氧化酶法)、糖化血紅蛋白(HbA1c)(親和層析比色法)、超敏C反應蛋白(hs-CRP)(顆粒增強免疫沉淀法),Olympus AU-400生化分析儀檢測總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C),100 g饅頭餐后2 h采血測定血糖(2 h PG)(葡萄糖氧化酶法)。
1.3 方法
1.3.1 炎癥因子檢測 研究對象在清晨空腹抽取靜脈血時,另留一管5 ml血,常規分離血清(2 500 r/min,15 min)后立即放置于-20℃密封冷凍保存待測。檢測前血清自然融化,期間不曾凍融。采用酶聯免疫吸附試驗(ELISA)檢測血清IL-17表達水平,試劑盒購自武漢華美生物工程有限公司,板內變異系數<10%,板間變異系數<15%,實驗操作及質量控制均嚴格按說明書進行。反應完成后30 min內用美國Bio-Rad公司680酶標儀測定吸光度值,繪制標準曲線求樣本中IL-17濃度。
1.3.2 頸動脈超聲多普勒檢查 采用二維超聲測定頸動脈內膜中層厚度(IMT)。患者取臥位,頸部側伸45°,用美國西門子公司sequoia全身彩超儀4~6 MHz高分辨率探頭,由同一檢查者進行操作,掃描雙側頸動脈起始部至頸總動脈分叉1 cm處最大的IMT,明確有無頸動脈IMT和粥樣斑塊形成等改變。兩側取平均值,以IMT≥0.9 mm者為頸動脈增厚〔4〕。
1.4 統計學方法 應用SPSS12.0統計軟件進行分析,計量資料以±s表示,兩組間均數比較用t檢驗,三組間比較用單因素方差分析。各指標間關系采用Pearson相關分析,多因素分析采用多元逐步回歸法,非正態分布資料比較時取對數。P<0.05為差異有統計學意義。
2 結果
2.1 各組相關指標比較 大血管病變組和無血管病變組SBP、FPG、2 h PG、HbA1c、hs-CRP、TC、TG、LDL-C 均高于正常對照組(P<0.05,P<0.01),大血管病變組 SBP和 hs-CRP顯著高于無血管病變組(P<0.01);BMI和HDL-C僅在大血管病變組和正常對照組比較時有統計學意義;年齡、病程和DBP組間差異無統計學意義(P>0.05)。血清IL-17表達水平在正常對照組、無血管病變組和大血管病變組中依次逐漸升高,組間比較差異均有統計學意義(P<0.01)。見表1。
2.2 以有無頸動脈增厚分組比較 對T2DM大血管病變患者進行IMT測定,以有無頸動脈增厚對IL-17水平變化進行比較,IMT在兩組間的差異有統計學意義(P<0.01),頸動脈增厚組IL-17水平明顯高于無頸動脈增厚組(P<0.05),組間性別、年齡構成無差異(P>0.05)。見表2。
表1 各組指標比較(±s)
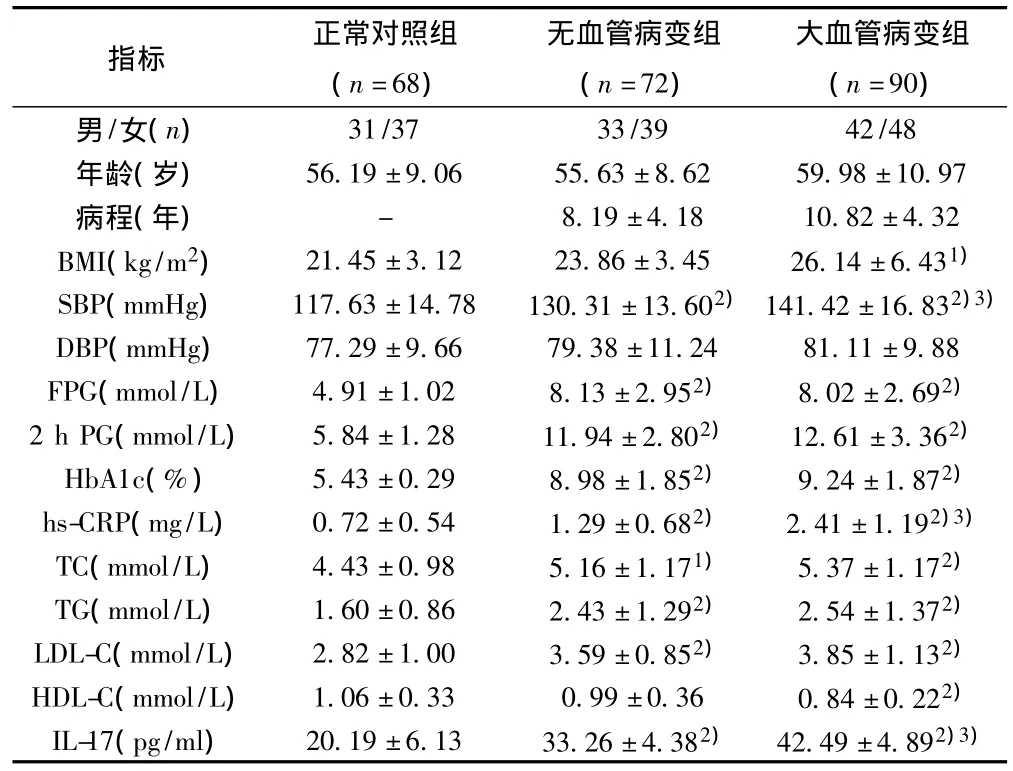
表1 各組指標比較(±s)
與正常對照組比較:1)P<0.05,2)P<0.01;與無血管病變組比較:3)P<0.01
指標 正常對照組(n=68)無血管病變組(n=72)大血管病變組(n=90)男/女(n)31/37 33/39 42/48年齡(歲) 56.19±9.06 55.63±8.62 59.98±10.97病程(年) - 8.19±4.18 10.82±4.32 BMI(kg/m2) 21.45±3.12 23.86±3.45 26.14±6.431)SBP(mmHg) 117.63±14.78 130.31±13.602)141.42±16.832)3)DBP(mmHg) 77.29±9.66 79.38±11.24 81.11±9.88 FPG(mmol/L) 4.91±1.02 8.13±2.952) 8.02±2.692)2 h PG(mmol/L) 5.84±1.28 11.94±2.802) 12.61±3.362)HbA1c(%) 5.43±0.29 8.98±1.852) 9.24±1.872)hs-CRP(mg/L) 0.72±0.54 1.29±0.682) 2.41±1.192)3)TC(mmol/L) 4.43±0.98 5.16±1.171) 5.37±1.172)TG(mmol/L) 1.60±0.86 2.43±1.292) 2.54±1.372)LDL-C(mmol/L) 2.82±1.00 3.59±0.852) 3.85±1.132)HDL-C(mmol/L) 1.06±0.33 0.99±0.36 0.84±0.222)IL-17(pg/ml) 20.19±6.13 33.26±4.382) 42.49±4.892)3)
表2 無頸動脈增厚組與有頸動脈增厚組參數比較(±s)
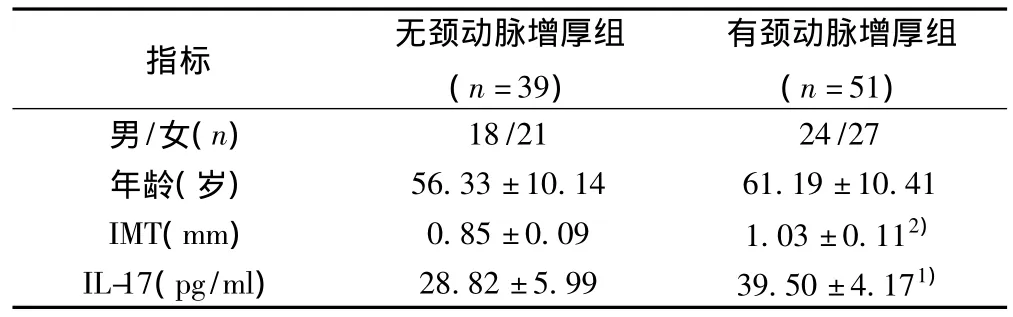
表2 無頸動脈增厚組與有頸動脈增厚組參數比較(±s)
與無頸動脈增厚組比較:1)P<0.05,2)P<0.01
指標 無頸動脈增厚組(n=39)有頸動脈增厚組(n=51)男/女(n)18/21 24/27年齡(歲) 56.33±10.14 61.19±10.41 IMT(mm) 0.85±0.09 1.03±0.112)IL-17(pg/ml) 28.82±5.99 39.50±4.171)
2.3 IL-17與其他指標相關性分析 大血管病變組IL-17水平與 BMI(r=0.389,P <0.05)、2 h PG(r=0.306,P <0.05)、hs-CRP(r=0.525,P <0.05)、TG(r=0.496,P <0.01)、LDL-C(r=0.617,P <0.01)呈正相關,與 HDL-C(r=-0.517,P <0.01)呈負相關,而與年齡、病程、血壓、FPG、HbA1c和TC無明顯相關性。無血管病變組IL-17與hs-CRP(r=0.431,P<0.05)、LDLC(r=0.679,P <0.01)呈正相關,與 HDL(r=-0.470,P <0.05)呈負相關,而與其他指標無相關性。正常對照組IL-17與各指標均無相關關系。
2.4 多因素逐步回歸分析 以有無大血管病變(設有大血管病變為1,無大血管病變為0)為應變量,IL-17、年齡、病程、SBP、DBP、BMI、FPG、2 h PG、HbA1c、hs-CRP、TC、TG、LDL-C、HDL-C為自變量,用多元逐步回歸篩選變量,按α=0.05的水平,IL-17(偏回歸系數0.261,P=0.028)、hs-CRP(偏回歸系數0.475,P=0.007)和 LDL-C(偏回歸系數 0.156,P=0.011)依次進入方程。根據逐步回歸結果,可以認為影響T2DM大血管病變的主要因素為IL-17、hs-CRP和HDL-C。
3 討論
糖尿病是一種以糖、脂代謝紊亂為主要特征的臨床綜合征。循證醫學已經證實,無論是1型糖尿病(T1DM)或是T2DM,高血糖均可顯著促發微血管并發癥如糖尿病腎病、神經病變和視網膜病變的發生,以及大血管并發癥如動脈粥樣硬化、高血壓和中風的發生〔5〕。氧化應激、脂質異常、糖基化終產物生成及高糖毒性被認為是糖尿病血管并發癥發生發展的高危因素,而通過調節因子增強炎癥信號表達觸發的血管炎癥則是涉及其中的主要事件〔6〕。已有研究表明,單核/巨噬細胞、T細胞等多種炎癥細胞及其分泌的細胞因子如腫瘤壞死因子-α(TNF-α)、干擾素-γ(IFN-γ)、CRP、IL-6 等均與炎癥信號傳導通路激活、不穩定斑塊形成致血管功能障礙有關,尤其T細胞免疫參與了糖尿病致動脈粥樣硬化的病理過程〔7〕。Th17是一種新的效應性CD4+T細胞亞群,主要分泌IL-17A、IL-17F等細胞因子。在動物模型實驗中,Th17細胞參與了自身免疫性糖尿病的發生,減少胰島局部Th17細胞的數量可以使胰島β細胞的破壞減少〔8〕。同時,有研究證明在T1DM胰島炎發生的病理過程中,IL-17和相關細胞因子的表達明顯增加〔9〕。T2DM在本質上有類似于T1DM的發生機制,是一種免疫相關慢性炎癥性疾病。已有研究表明,在初診T2DM患者胰島素強化治療前后血清IL-17持續處于高水平,提示IL-17可能參與T2DM的發生發展〔10〕。
IL-17能上調或協同基質金屬蛋白酶-9(MMP-9)、IFN-γ及CRP表達,進而導致動脈粥樣硬化性疾病〔11〕。本課題組曾以高脂飲食喂養SD大鼠聯合鏈脲佐菌素(STZ)腹腔注射建立T2DM模型,通過免疫組化發現IL-17表達于主動脈內膜,以糖尿病組內膜染色最為顯著,病變范圍更加廣泛;進一步檢測各組大鼠主動脈IL-17蛋白及mRNA表達水平,均提示IL-17參與T2DM大血管病變的炎癥反應過程。本實驗在此基礎上檢測T2DM患者血清IL-17水平,結果與動物實驗結果基本一致。2003年的歐洲高血壓治療指南將頸動脈IMT≥0.9 mm確定為內膜中層增厚,國內有學者亦以IMT≥0.9 mm為增厚標準,并認為頸動脈IMT可以作為預測糖尿病患者心血管疾病的“標志”〔12〕。本實驗也表明IL-17與糖尿病大血管病變密切相關。通過相關性分析發現,IL-17 與 BMI、2 h PG、hs-CRP、TG、LDL-C呈正相關,與HDL-C呈負相關。可見,在自身免疫性糖尿病患者體內,IL-17等促炎性指標活性明顯高于保護性因子,或者前者為致病始動因素,后者為機體代償性反應。根據多元逐步回歸分析,可以認為IL-17是T2DM大血管病變的一個獨立危險因素,可能在糖尿病大血管病變發生、發展中發揮重要作用。
1 Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages〔J〕.Nat Immunol,2005;6(11):1123-32.
2 Venkatachalam K,Mummidi S,Cortez DM,et al.Resveratrol inhibits high glucose-induced PI3K/Akt/ERK-dependent interleukin-17 expression in primary mouse cardiac fibroblasts〔J〕.Am J Physiol Heart Circ Physiol,2008;294(5):H2078-87.
3 汪海東,孫 皎,夏世金.IL-17和siRNA IL-17基因逆轉錄病毒載體的構建及其轉染致糖尿病性T細胞中IL-17的表達〔J〕.中國老年學雜志,2009;29(22):2873-6.
4 Vasan RS,Kannel WB.Recent US and European blood pressure guidelines:implications for developing countries〔J〕.Natl Med J India,2003;16(5):241-4.
5 Villeneuve LM,Natarajan R.The role of epigenetics in the pathology of diabetic complications〔J〕.Am J Physiol Renal Physiol,2010;299(1):F14-25.
6 Averill MM,Bornfeldt KE.Lipids versus glucose in inflammation and the pathogenesis of macrovascular disease in diabetes〔J〕.Curr Diab Rep,2009;9(1):18-25.
7 Castoldi G,Galimberti S,Riva C,et al.Association between serum values of C-reactive protein and cytokine production in whole blood of patients with type 2 diabetes〔J〕.Clin Sci(Lond),2007;113(2):103-8.
8 Ji Y,Zhang W.Th17 cells:positive or negative role in tumor〔J〕?Cancer Immunol Immunother,2010;59(7):979-87.
9 Vukkadapu SS,Belli JM,Ishii K,et al.Dynamic interaction between T cell-mediated beta-cell damage and beta-cell repair in the run up to autoimmune diabetes of the NOD mouse〔J〕.Physiol Genomics,2005;21(2):201-11.
10 田小平,徐 寧,惠 媛,等.初診2型糖尿病患者血清炎性細胞因子的表達〔J〕.江蘇醫藥,2011;37(13):1576-8.
11 Eid RE,Rao DA,Zhou J,et al.Interleukin-17 and interferon-gamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells〔J〕.Circulation,2009;119(10):1424-32.
12 韓 兵,王新民.糖尿病動脈內膜-中層厚度的研究進展〔J〕.醫學綜述,2007;13(15):1162-4.

