Jagged1過表達促進老齡大鼠來源的內皮祖細胞向成熟內皮細胞分化*
朱光旭, 潘興華, 宋明寶, 余爭平, 龐榮清, 阮光萍, 康華莉
(1成都軍區昆明總醫院檢驗科,云南省干細胞與組織工程中心,云南 昆明 650032; 2第三軍醫大學新橋醫院全軍心血管疾病研究所,重慶 400037; 3第三軍醫大學軍事預防醫學院電磁輻射生物學效應研究所,重慶 400038)
Jagged1過表達促進老齡大鼠來源的內皮祖細胞向成熟內皮細胞分化*
朱光旭1△, 潘興華1△, 宋明寶2, 余爭平3, 龐榮清1, 阮光萍1, 康華莉2
(1成都軍區昆明總醫院檢驗科,云南省干細胞與組織工程中心,云南 昆明 650032;2第三軍醫大學新橋醫院全軍心血管疾病研究所,重慶 400037;3第三軍醫大學軍事預防醫學院電磁輻射生物學效應研究所,重慶 400038)
目的探討上調Jagged1表達對內皮培養條件下老齡大鼠來源的內皮祖細胞(EPC)向內皮細胞分化的影響。方法脫臼處死1~2月齡和19~26月齡SD大鼠,PBS沖洗股骨和脛骨骨髓,Ficoll密度梯度離心分離單個核細胞, 應用含10% FBS的DMEM/F12培養基以差速貼壁法進行體外培養,DiI-ac-LDL與FITC-UEA-1熒光雙染進行EPC特性鑒定。實驗分為4組:對照組、PIRES2-EGFP轉染組、PIRES2-EGFP-Jagged1轉染組和未轉染的年輕大鼠來源EPC組。熒光顯微鏡下計數GFP陽性細胞數并計算轉染效率;免疫熒光、RT-PCR和Western blotting檢測Jagged1 mRNA和蛋白、von Willebrand因子(vWF)及血管內皮生長因子激酶插入區受體(KDR)mRNA表達,體外血管生成實驗檢測EPC的血管形成能力。結果轉染后Jagged1在EGFP-Jagged1組表達較對照組顯著增強(P<0.01);Jagged1過表達顯著促進老齡大鼠EPC vWF與KDR mRNA表達(P<0.01)和體外血管生成能力(P<0.01); vWF與KDR mRNA表達以及體外血管生成能力在Jagged1轉染組與年輕大鼠EPC組間未見有顯著差別。結論Jagged1過表達促進內皮培養條件下老齡大鼠來源EPC向成熟內皮細胞分化。
Jagged1蛋白; 內皮祖細胞; 血管發生; 衰老
內皮祖細胞(endothelial progenitor cell, EPC)具有成體細胞類似的衰老生物學特性已為諸多文獻證實[1-2]。我們前期研究表明,EPC修復損傷血管具有年齡依賴特性,即年輕大鼠來源EPC較老齡大鼠來源者具有更好的增殖遷移和向內皮細胞(endothelial cell,EC)分化能力[3]。Notch信號系統是進化上高度保守,控制著細胞增殖和分化等細胞命運的信號系統,該信號系統可通過Jagged1和Delta-like(Dll)家族配體識別Notch跨膜蛋白受體得以激活[4]。Conboy等[5]證實,在衰老骨骼肌細胞Notch信號活化顯著減弱,通過增強Notch1信號活化可促進衰老的骨骼肌細胞再生能力。新近研究發現Jagged1缺乏會導致EPC遷移、增殖等能力減弱,并且缺血組織血管再生能力也明顯降低[6],但是目前尚不清楚Jagged1對EPC的年齡依賴性分化活性有何調節功能。本研究在老齡大鼠來源的EPC中過表達Jagged1,探討其在EPC年齡依賴性分化中的調節作用,為臨床應用EPC防治血管損傷性疾病提供部分理論和實驗依據。
材 料 和 方 法
1主要材料
Sprague-Dawley(SD)大鼠(1~2月齡和19~26月齡,雌雄不限,無既往病史,均喂養于環境濕度、溫度適中,飲食良好的環境)由第三軍醫大學實驗動物中心提供,所有動物實驗均經第三軍醫大學及成都軍區昆明總醫院倫理委員會批準。質粒PIRES2-Jagged1-EGFP由第三軍醫大學全軍心血管研究所宋明寶博士惠贈(包含全長的大鼠Jagged1 cDNA序列,PIRES2-EGFP載體購自BD)。LipofectamineTM2000(Invitrogen),DMEM/F12干粉培養基(HyClone),內皮細胞生長添加劑(BD),優質胎牛血清(PAA),DiI標記乙酰化低密度脂蛋白(DiI-labeled acetylated low-density lipoprotein, DiI-ac-LDL;Molecular Probe),FITC標記荊豆凝集素I(FITC-labeledUlexeuropaeusagglutinin, FITC-UEA-I;Vector),Ficoll 液(Histo-paque 21083),抗大鼠Jagged1、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)和von Willebrand因子(von Willebrand factor,vWF)抗體(Santa Cruz), 熒光標記山羊抗小鼠及兔抗山羊IgG(北京中杉公司),纖維連接蛋白(FN,Sigma), 體外血管生成試劑盒(Invitrovasculogenesis kit;Chemicon), 逆轉錄聚合酶鏈式反應試劑盒(Promega),Hot-start taq酶(TaKaRa),倒置熒光相差顯微鏡 (Leica),CO2培養箱(Harris), PCR儀(MJ)。
2方法
2.1EPC分離培養及鑒定 參照課題組前期研究,采用二次貼壁法EPC進行培養,文獻報道該方法可減少循環EC及單個核細胞污染[7-8]。脫臼處死SD大鼠,無菌取出股骨和脛骨, PBS沖洗骨髓, Ficoll 液密度梯度離心 (2 000 r/ min ,30 min) 分離單個核細胞, PBS洗滌后,以含15%FBS的DMEM/F12(含內皮細胞生長添加劑100 mg/L,肝素100 mg/L,青霉素1×105U/L,鏈霉素100 mg/L)重懸, 1.5×106/cm2接種于75 cm2培養皿,37 ℃、5 % CO2條件培養,細胞貼壁24 h (棄早期貼壁細胞) 后轉移未貼壁細胞懸液到新的經纖維連接蛋白包被的無菌培養瓶或培養板繼續培養,使細胞再次貼壁生長,4 d后棄未貼壁細胞,以后每2 d換液1次。二次貼壁細胞培養12 d后,DiI-ac-LDL (10 mg/L)及FITC-UEA-I (10 mg/L)避光孵育,置熒光顯微鏡下觀察;另取24孔板培養細胞行vWF熒光免疫細胞化學染色。
2.2脂質體介導的基因轉染 當二次貼壁的老齡大鼠來源EPC培養達到70%~80%融合時,按照LipofectamineTM2000說明對細胞進行轉染,簡言之,用100 μL Opti-MEM稀釋LipofectamineTM2000(6 μL)和DNA(1.5 μg),混勻,室溫放置5~10 min,將脂質體-DNA復合體加入到24孔板培養的EPC后孵育6 h, PBS清洗后重新用含15% FBS的DMEM/F12培養基進行培養。轉染實驗分為4組:未轉染(對照)組、PIRES2-EGFP轉染組、PIRES2-EGFP-Jagged1轉染和未轉染的年輕大鼠來源EPC(YE)組。轉染18 h后,200倍倒置熒光顯微鏡下計數細胞數,并在同一視野視野在激發波長為488 nm的熒光下檢測GFP的表達,計數5個視野表達綠色熒光的細胞數和總細胞數計算獲得轉染細胞效率。
2.3Western blotting及熒光免疫細胞化學檢測Jagged1表達 轉染后72 h,用4 ℃預冷的PBS 洗細胞3 次,加入預制的含PMSF 裂解液,冰上裂解30 min,裂解后,將細胞碎片和裂解液移至離心管。4 ℃、16 000 r/min 離心20 min,收集上清,取其中少量測蛋白濃度(BCA 法) ,取等量預處理的蛋白樣品上樣,恒壓81V 進行SDS-PAGE 電泳,電轉至PVDF 膜,5%脫脂奶粉-PBST 室溫封閉1 h 后,加入羊抗大鼠Jagged1 抗體(1∶1 000) 、小鼠抗大鼠GAPDH(1∶1 000) 4 ℃孵育過夜,再與HRP 標記的兔抗羊IgG和抗鼠IgG 37 ℃孵育1 h,化學發光顯色后用凝膠成像系統掃描, 半定量分析顯影帶,目的蛋白量以GAPDH 相對量表示;取部分培養的轉染細胞進行Jagged1免疫細胞化學染色,同型IgG抗體染色作為陰性對照。
2.4RT-PCR檢測vWF和血管內皮生長因子激酶插入區受體(kinase insert domain receptor,KDR)mRNA表達 轉染后96 h按Tripure 說明書提取總RNA,在A260/A280條件下進行RNA 純度鑒定和定量,并用甲醛變性瓊脂糖凝膠電泳進一步確認RNA 質量。取總RNA 3.2 μg 逆轉錄合成cDNA 后進行半定量PCR反應,以GAPDH作內參照。反應條件為95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min ,35個循環后,72 ℃ 7 min。vWF(XM_342759) 上游引物為5’-ctg tgc tgc cca gag tat ga-3’,下游引物為5’-ccc ctt cgt gga gaa cat aa-3’,目標片段514 bp;KDR(NM_013062)上游引物為5’-gct ccg gaa aca att ttt ga-3’,下游引物為5’- tct gtc tgg ctg tca tct gg-3’,目標片段560 bp;GAPDH(NM_017008)上游引物為5’-tcc cat tct tcc acc ttt ga-3’,下游引物為5’-tgt gag gga gat gct cag tg-3’,目標片段253 bp,29 個循環;退火溫度55 ℃。反應結束后各取PCR 產物4 μL 進行1.7%瓊脂糖電泳,并用Gel Doc 2000 凝膠圖像分析儀掃描,PCR 產物量以吸光度值×面積表示,目的片段與GAPDH吸光度比值作為目的片段mRNA 的相對含量,并以年輕大鼠來源的EPC及腹主動脈EC作為陽性對照。
2.5體外血管生成實驗檢測EPC的血管生成能力 轉染后96 h, 采用體外血管生成試劑盒檢測血管生成能力。將ECMatrixTM膠液和ECM 10×稀釋液置于4 ℃冰箱過夜,使之凍融。每900 μL ECMatrixTM加入100 μL ECM 10×稀釋液,混勻。將上述溶液加入96孔板,每孔50 μL,37℃孵育1 h成膠,0.25%胰蛋白酶消化培養的轉染EPC,重新懸于DMEM/F12培養基,以5×103cells/well接種于ECMatrixTM膠上37 ℃孵育12 h,倒置顯微鏡下觀察血管生成情況。體外血管生成實驗的形態學評分標準參照我們前期實驗進行[9],具體標準是:0分,細胞呈單個存在;1分,細胞開始遷移并自我排列;2分,可以見到毛細管,但是尚無出芽;3分,可見到新毛細管出芽;4分,開始閉合形成多邊形;5分,形成網狀結構。
3統計學處理
數據以均數±標準差(mean±SD)表示, 使用SPSS 10.0軟件進行組間單因素方差分析,以P< 0.05為差異有統計學意義。
結 果
1體外培養骨髓EPC的特征
二次貼壁培養的骨髓EPC大多呈梭形或卵圓形,2周后細胞逐漸呈融合生長狀態,見圖1A、B。形態上年輕組EPC較老年大鼠來源更為均一,貼壁細胞數及增殖速度均明顯高于老年組,與課題組前期研究結果一致。EPC培養12 d后進行DiI-ac-LDL(圖1E)及FITC-UEA-I(圖1F)染色,隨機挑選5個視野計數雙染陽性細胞百分率,結果顯示雙染陽性率為(80.40±6.95)%。培養12 d,免疫細胞化學顯示未染色培養細胞及同型對照均未見有明顯熒光(照片未顯示),而EPC 行vWF染色后可見部分vWF表達,見圖1G。
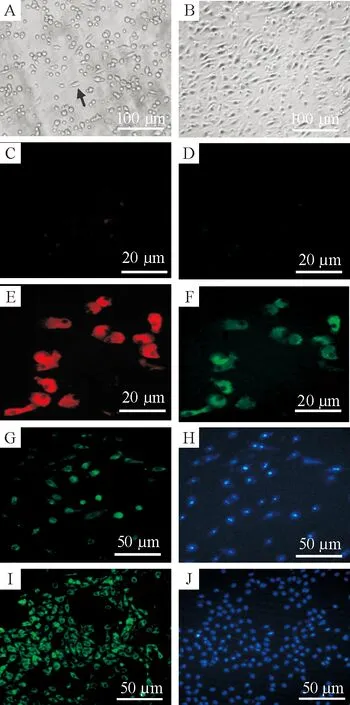
Figure 1. Characteristics of bone marrow-derived endothelial progenitor cells (EPC). A: secondary attached cells, the arrow showing the network of EPC; B: EPC after 14 d of culture; C: DiI-ac-LDL negative control; D: FITC-UEA-I negative control; E: DiI-ac-LDL positive cells; F: FITC-UEA-I positive cells; G: vWF immunostaining for EPC after 12 d of culture; I: vWF immunostaining for cultured abdominal aorta endothelial cells; H and J: DAPI-labeled cell nuclei corresponding to G and I, respectively.
圖1培養骨髓EPC的生長特征
2轉染后Jagged1在老齡大鼠來源EPC中的表達
轉染后18 h,實驗觀察到EGFP和EGFP-Jagged1組均可見EGFP表達(圖2Ab), 兩者未見明顯差異,對照組未見表達(圖2Aa),轉染效率約40%。轉染后72 h, 免疫細胞化學顯示EGFP-Jagged1組Jagged1表達顯著增強(圖2Ae),而EGFP組(圖2Ac)和對照組(圖2Ad)僅見微弱Jagged1表達。Western blotting顯示,Jagged1在EGFP-Jagged1組(0.374±0.024)和YE組(0.381±0.030)表達同樣顯著高于EGFP組(0.139±0.021)和對照組(0.141±0.012;P<0.01),見圖2B。
3Jagged1表達上調促進老齡大鼠EPC中vWF及KDRmRNA表達
轉染后96 h, EGFP-Jagged1組見vWF(2.01±0.17)及KDR(2.21±0.13)表達較對照組(分別為1.21±0.12和1.36±0.17)顯著增高(P<0.01),而對照組與EGFP組間未見顯著差別;YE組vWF(2.24±0.15)和KDR(2.69±0.19)以及EC組 vWF(2.26±0.21)和KDR(2.82±0.29)與EGEP-Jagged1組之間未檢測到顯著差異,但均顯著高于對照及EGFP組,見圖3。
4上調Jagged1表達促進老齡大鼠EPC血管形成能力
EGFP-Jagged1轉染組評分(3.36±0.57)顯著高于對照及EGFP轉染組(2.46±0.52)(P<0.05),對照組與EGFP轉染組之間未見顯著差別。YE組血管形成能力(3.86±0.49)與EGFP-Jagged1轉染組相比無顯著差別,這2組評分仍然顯著低于EC組(4.98±0.19;P<0.01),見圖4。這表明Jagged1過表達顯著促進老齡大鼠來源EPC的血管新生能力,同時也提示在檢測時限內,Jagged1過表達的老齡大鼠EPC以及年輕大鼠來源的EPC均未完全呈現成熟EC所具備的生物學特性。
討 論
干、祖細胞反應性減弱是衰老引發退變的重要特征之一,主要表現在隨著年齡的增長,干細胞和祖細胞在細胞增殖、遷移等能力下降,導致組織再生能力減弱[1-2]。然而由衰老引起的干、祖細胞反應性減弱具有潛在可逆性。課題組前期研究證實EPC具有類似成體細胞衰老的生物學特性,即老年大鼠來源的EPC在增殖遷移和向EC分化方面能力弱于年輕大鼠EPC,但是當置入年輕環境,老年大鼠來源EPC的活性可被部分恢復[3]。針對其它組織的干細胞也有類似報道。Conboy等[10]證實年輕環境可顯著促進骨骼肌干細胞活性恢復,有效增強其參與骨骼肌組織再生能力。Notch信號是在進化上高度保守、控制細胞增殖和遷移等細胞命運的信號轉導系統,Jagged1是該信號途徑配體之一,可激活細胞膜Notch信號受體引起受體構象改變后裂解,產生細胞內結構域釋放后轉位到細胞核,在核內與轉錄抑制子CBF1結合,啟動Notch/CBF1調節的下游基因轉錄,從而調控增殖和分化等細胞活性[4],文獻已報道通過增強Notch1信號活化可以恢復和促進衰老骨骼肌細胞的再生能力[5],新近研究揭示Jagged1缺乏會導致EPC在遷移增殖等方面能力顯著減弱,且參與缺血組織血管再生能力也明顯降低[6],然而Notch1信號在EPC年齡依賴性分化活性調節上有何功能迄今尚未明確。
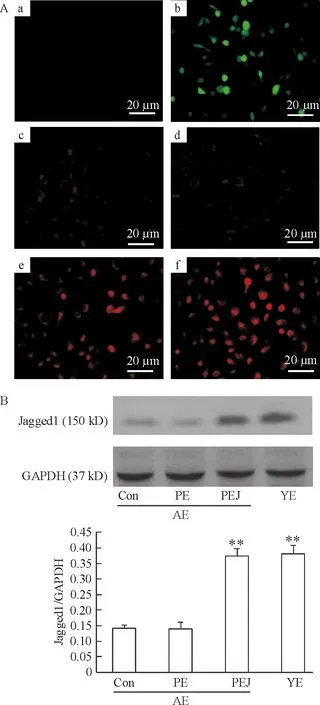
Figure 2. EGFP and Jagged1 expression in aged rat-derived EPC after transfection. A: EGFP observation and Jagged1 immunocytochemical staining.a:EGFP negative control; b: EGFP expression in EGFP and EGFP-Jagged1 transfection groups; c: Jagged1 expression in control group; d: Jagged1 expression in EGFP transfection group; e: Jagged1 expression in EGFP-Jagged1 transfection group; f: Jagged1 expression in cultured young rat-derived EPC. B: Jagged1 protein expression in different groups detected by Western blotting. Con: control; PE: PIRES2-EGFP transfection; PEJ: PIRES2-EGFP-Jagged1 transfection; AE: aged rat-derived EPC; YE: young rat-derived EPC.Mean±SD.n=4.**P<0.01vsCon or PE.
圖2EGFP及Jagged1在老齡大鼠EPC轉染后表達
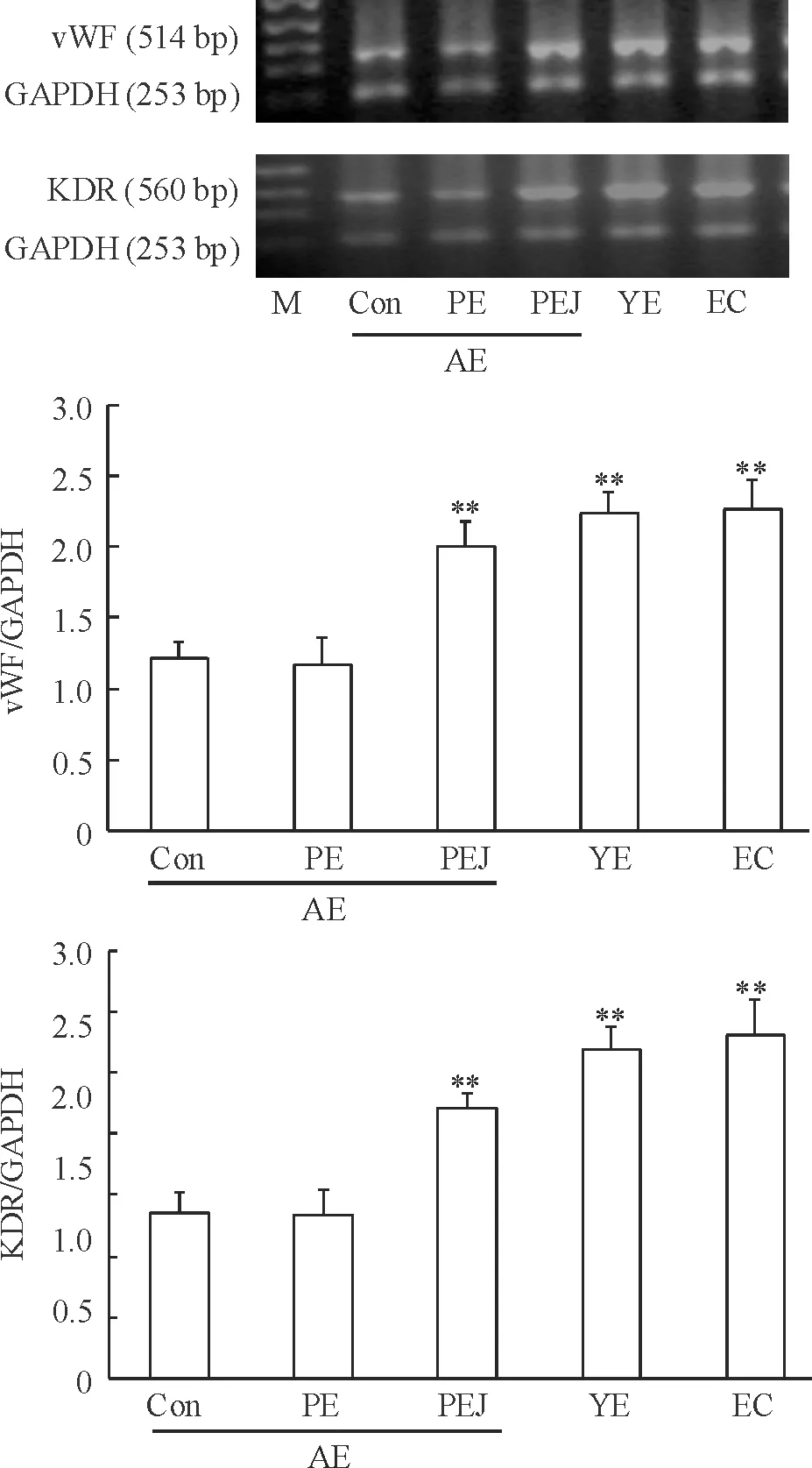
Figure 3. Jagged1 overexpression promoted vWF and KDR mRNA expression in aged rat-derived EPC. Con: control; PE: PIRES2-EGFP transfection; PEJ: PIRES2-EGFP-Jagged1 transfection; AE: aged rat-derived EPC; YE: young rat-derived EPC; EC: cultured abdominal aorta endothelial cells.Mean±SD.n=4.**P<0.01vsCon or PE.
圖3Jagged1過表達促進老年大鼠來源EPC中vWF及KDRmRNA表達
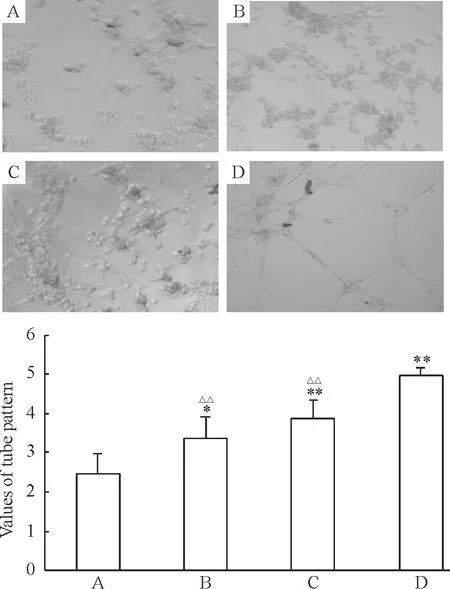
Figure 4. Up-regulated Jagged1 improved the tube formation ability of EPCinvitro. A: control and EGFP transfection group; B: EGFP-Jagged1 transfection group; C: young rat-derived EPC group; D: cultured abdominal aorta endothelial cell group.Mean±SD.n=6.*P<0.05,**P<0.01vsA;△△P<0.01vsD.
圖4Jagged1過表達促進老齡大鼠來源EPC的體外血管形成能力
本研究應用基因轉染技術,以年輕大鼠來源EPC為對照,通過增強老齡大鼠來源EPC內Jagged1表達來探討在內皮培養條件下Jagged1對EPC分化年齡相關性的調節作用。免疫熒光顯示年輕大鼠EPC Jagged1表達強于老齡組,這與近期研究顯示Jagged1在EC中的表達有相似特點,即老年大鼠EC 表達Jagged1顯著低于年輕大鼠EC[11]。實驗觀察到轉染后EGFP和EGFP-Jagged1組均有EGFP表達,EGFP-Jagged1組Jagged1表達顯著增強,表明轉染Jagged1已成功表達于老齡大鼠來源EPC。vWF和KDR廣泛表達于成熟EC,是成熟EC的重要特征性標志。RT-PCR揭示Jagged1轉染組vWF 及KDR mRNA表達較對照組顯著增高。vWF是EC特異性分泌的糖蛋白;體外實驗顯示KDR可結合基質金屬蛋白酶,促進管狀結構形成,與EC參與血管損傷修復和再生能力密切相關[12]。Jagged1過表達顯著促進老齡大鼠來源EPC內vWF和KDR表達,表明Jagged1過表達可以顯著促進老齡大鼠EPC內皮分化能力。進一步的體外血管生成實驗觀察到Jagged1轉染組評分顯著高于對照組及EGFP轉染組,表明上調Jagged1表達顯著促進了老齡大鼠來源EPC的血管形成能力,提示既往研究發現的老齡大鼠EPC修復血管損傷內膜能力較年輕大鼠EPC弱可能與Jagged1表達不足導致老齡大鼠來源EPC向EC分化能力減弱有關。
已有研究證實Notch信號在細胞分化調節上發揮了重要調節功能,新近文獻報道Jagged1可調節血管瘤干細胞向血管平滑肌細胞分化[13]。Jagged1/Notch1途徑還可以通過細胞間作用調節細胞增殖和分化生物學特性。通過共培養內皮和平滑肌細胞,Xia等[14]研究表明Jagged1可通過Notch3途徑調節平滑肌分化。武曉靜等[15]證實內皮細胞Jagged1下調顯著促進PDGF誘導的大鼠平滑肌細胞增殖和遷移。然而Jagged1如何調控EPC向EC分化的詳細機制尚不清楚。孟曉等[16]在EPC向EC分化過程中觀察到Notch信號活化,提示該信號途徑與EPC內皮分化緊密相關;Kamei等[17]證實Jagged1在調節EPC相關的血管發育過程中起重要作用,Jagged1+/+EPC較Jagged1-/-EPC不僅顯示較強的促血管再生效應,且能促進形態正常血管的穩定性。目前僅有的研究遠不足以闡明Notch1調控EPC內皮分化的機制。本實驗揭示內皮培養條件下上調Jagged1表達可以促進老齡大鼠EPC向EC分化,為老齡個體來源EPC應用于臨床提供了部分實驗依據,但是詳細機制尚需進一步探索,另一方面,EPC修復血管損傷內膜是一極其復雜的生理過程,本次實驗也僅局限于部分離體研究,尚需在體研究加以驗證。
[1] He T, Joyner MJ, Katusic ZS. Aging decreases expression and activity of glutathione peroxidase-1 in human endothelial progenitor cells [J]. Microvasc Res, 2009, 78(3):447-452.
[2] Sanada F, Taniyama Y, Azuma J, et al. Hepatocyte growth factor, but not vascular endothelial growth factor, attenuates angiotensin II-induced endothelial progenitor cell senescence [J]. Hypertension, 2009, 53(1):77-82.
[3] Zhu G, Song M, Wang H, et al.Young environment reverses the declined activity of aged rat-derived endothelial progenitor cells: involvement of the phosphatidylinositol 3-kinase/Akt signaling pathway[J].Ann Vasc Surg, 2009, 23(4):519-534.
[4] Rodilla V, Villanueva A, Obrador-Hevia A, et al. Jagged1 is the pathological link between Wnt and Notch pathways in colorectal cancer[J]. Proc Natl Acad Sci U S A, 2009, 106(15):6315-6320.
[5] Conboy IM, Conboy MJ, Smythe GM, et al. Notch-mediated restoration of regenerative potential to aged muscle [J]. Science, 2003, 302(5650):1575-1577.
[6] Kwon SM, Eguchi M, Wada M,et al. Specific Jagged-1 signal from bone marrow microenvironment is required for endothelial progenitor cell development for neovascularization[J]. Circulation, 2008, 118(2):157-165.
[7] 朱光旭,黃 嵐,武曉靜, 等. 不同年齡段大鼠血清對大鼠骨髓內皮祖細胞活力的影響[J]. 中國病理生理雜志,2008,42(1):132-138.
[8] Thum T, Fraccarollo D,Galuppo P, et al. Bone marrow molecular alterations after myocardial infarction: Impact on endothelial progenitor cells [J]. Cardiovasc Res, 2006, 70(1):50-60.
[9] Song MB, Yu XJ, Zhu GX, et al. Transfection of HGF gene enhances endothelial progenitor cell (EPC) function and improves EPC transplant efficiency for balloon-induced arterial injury in hypercholesterolemic rats[J]. Vascul Pharmacol, 2009, 51(2-3):205-213.
[10] Conboy IM, Conboy MJ, Wagers AJ, et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment [J]. Nature, 2005, 433(7027):760-764.
[11] Wu X, Zhou Q, Huang L, et al. Ageing-exaggerated proliferation of vascular smooth muscle cells is related to attenuation of Jagged1 expression in endothelial cells[J]. Cardiovasc Res, 2008, 77(4):800-808.
[12] Oswald J, Boxberger S, Jrgensen B, et al. Mesenchymal stem cells can be differentiated into endothelial cellsinvitro[J]. Stem Cells, 2004, 22(3):377-384.
[13] Boscolo E, Stewart CL, Greenberger S, et al. JAGGED1 signaling regulates hemangioma stem cell-to-pericyte/vascular smooth muscle cell differentiation[J]. Arterioscler Thromb Vasc Biol, 2011, 31(10):2181-2192.
[14] Xia Y, Bhattacharyya A, Roszell EE, et al. The role of endothelial cell-bound Jagged1 in Notch3-induced human coronary artery smooth muscle cell differentiation [J]. Biomaterials, 2012, 33(8):2462-2472.
[15] 武曉靜,黃 嵐,周 騏,等.內皮細胞Jagged1下調促進PDGF誘導的大鼠平滑肌細胞增殖遷移[J].中國病理生理雜志,2009, 25 (10):1873-1877.
[16] 孟 曉,宋 穎,劉云鵬,等. 大鼠骨髓源內皮祖細胞分化過程Notch信號通路活化及欖香烯干預機制的探討[J].腫瘤防治雜志,2012,19(7):489-493.
[17] Kamei N, Kwon SM, Ishikawa M,et al. Endothelial progenitor cells promote astrogliosis following spinal cord injury through Jagged1-dependent Notch signaling[J]. J Neurotrauma, 2012, 29(9):1758-1763.
OverexpressionofJagged1promotesagedrat-derivedendothelialproge-nitorcellsdifferentiatingintomatureendothelialcells
ZHU Guang-xu1, PAN Xing-hua1, SONG Ming-bao2, YU Zheng-ping3, PANG Rong-qing1, RUAN Guang-ping1, KANG Hua-li2
(1DepartmentofClinicalLaboratory,StemCellandTissueEngineeringCenterofYunnanProvince,PLAKunmingGeneralHospital,ChengduMilitaryAreaCommand,Kunming650032,China;2CardiovascularInstituteofXinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;3InstituteofBiologicalEffectofElectromagneticRadiation,SchoolofMilitaryPreventiveMedicine,ThirdMilitaryMedicalUniversity,Chongqing400038,China.E-mail:zhguxu2001@aliyun.com;xinghuapan@yahoo.com.cn)
AIM: To investigate the effect of Jagged1 overexpression on endothelial cell-directional differentiation of aged rat-derived endothelial progenitor cells (EPC).METHODSMononuclear cells were obtained from bone marrow of young (1 to 2 months old) or aged (19 to 26 months old) Sprague-Dawley rats and cultured in DMEM/F12 medium supplemented with 10% FBS. EPC were characterized as double positive for DiI-ac-LDL uptake and lectin binding. The experiments were divided into control group, PIRES2-EGFP transfection group, PIRES2-EGFP-Jagged1 transfection group and young rat-derived EPC group in which transfection was not performed. The GFP expression positive cell number was acquired by fluorescence microscopy and the transfection efficiency was calculated. Immunofluorescence, RT-PCR and Western blotting were used to detect the mRNA and protein expression.Invitrovasculogenesis kit was used to test the tube formation ability of EPC.RESULTSEGFP-Jagged1 transfection induced a significant increase in the expression of Jagged1 in aged rat-derived EPC (P<0.01). Compared with the control, Jagged1 overexpression markedly enhanced the mRNA expression of von Willebrand factor (vWF) and kinase insert domain receptor (KDR) of vascular endothelial grouth factor vWF in aged rat-derived EPC (P<0.01) and improved the EPC-related tube formation (P<0.01). No significant difference between Jagged1 transfection and young rat-derived EPC groups in vWF and KDR mRNA expression and the ability of tube formation was found.CONCLUSIONIn endothelial cell-conditioning medium, Jagged1 overexpression significantly promotes aged rat-derived EPC differentiation into mature endothelial cells.
Jagged1 protein; Endothelial progenitor cells; Vasculogenesis; Aging
R363
A
10.3969/j.issn.1000- 4718.2013.06.002
1000- 4718(2013)06- 0969- 06
2012- 12- 14
2013- 04- 18
“973”基礎研究規劃項目(No.2012CB518100);國家自然科學基金資助項目(No.81170316)
△通訊作者 朱光旭 Tel: 0871-64774920; E-mail: zhguxu2001@aliyun.com; 潘興華 Tel: 0871-64774920; E-mail: xinghuapan@aliyun.com

