抑制小鼠HL-1心肌細胞橋粒斑蛋白基因表達對縫隙連接蛋白 43結構和功能的影響*
張黔桓, 鄧春玉, 饒 芳, 劉曉穎, 麥麗萍, 朱杰寧, 譚虹虹, 吳書林
(廣東省人民醫院心內科, 廣東省心血管病研究所,廣東 廣州 510080)
抑制小鼠HL-1心肌細胞橋粒斑蛋白基因表達對縫隙連接蛋白 43結構和功能的影響*
張黔桓, 鄧春玉, 饒 芳, 劉曉穎, 麥麗萍, 朱杰寧, 譚虹虹, 吳書林△
(廣東省人民醫院心內科, 廣東省心血管病研究所,廣東 廣州 510080)
目的采用基因沉默技術抑制小鼠HL-1心肌細胞橋粒斑蛋白(DSP)基因表達以明確DSP與縫隙連接蛋白43(Cx43)的結構和功能關系。方法用基因沉默技術抑制DSP基因的表達,Western blotting和流式細胞術檢測HL-1細胞DSP和Cx43蛋白的表達,用雙免疫熒光方法檢測DSP與Cx43蛋白的表達與定位情況,并用劃痕標記染料示蹤技術檢測細胞縫隙連接通訊狀況。結果與空白組和對照組相比,siRNA-DSP組的DSP和Cx43蛋白表達量降低(P<0.05)。免疫熒光檢測發現空白組和對照組DSP與Cx43蛋白存在共定位情況,而siRNA-DSP組DSP和Cx43蛋白共定位遭到破壞,Cx43蛋白出現再分布,在細胞內檢測到Cx43蛋白,并且劃痕標記染料示蹤技術檢測發現siRNA-DSP組Lucifer yellow通過HL-1細胞縫隙連接的傳輸功能降低。結論DSP表達抑制不僅使Cx43出現再分布,而且影響縫隙連接傳導功能。
縫隙連接蛋白 43; 橋粒斑蛋白; 基因沉默; HL-1細胞
橋粒是心肌閏盤的主要成份,與中間絲共同維持著心肌細胞之間的結構穩定性。橋粒斑蛋白(desmoplakin,DSP)是最大的橋粒蛋白,其N末端與其它橋粒蛋白如plakophilin-2(PKP2)和plakoglobin(PG)相連,C末端則與中間絲相連,在維持心肌細胞之間的結構和功能完整性方面發揮重要的作用。致心律失常性右室心肌病(arrhythmogenic right ventri-cular cardiomyopathy,ARVC)是一種遺傳性心肌病,其主要的特征是起源于右室的致命性室性心律失常。約有40%的ARVC患者有一個或多個編碼橋粒蛋白的基因發生突變,且橋粒突變的患者室性心律失常的發生率較高[1-2],但橋粒基因突變導致患者發生室性心率失常的確切機制并不清楚。縫隙連接蛋白43(connexin 43,Cx43)是人類心臟縫隙連接的主要亞型,在一些橋粒基因突變的患者中Cx43信號出現減弱[3]。Cx43是否參與和介導了橋粒基因突變致心律失常的分子機制并不清楚,需要進一步的研究來闡明。本研究采用基因沉默技術抑制HL-1心肌細胞DSP基因表達以明確DSP與Cx43的結構和功能關系。
材 料 和 方 法
1細胞
HL-1 細胞來源于小鼠的心肌細胞系AT-1,傳5代以上,由王志國教授惠贈(加拿大Mcgill大學)。
2主要試劑
Claycomb培養基和新鮮牛血清購自Biosciences;0.05%typsin-EDTA購自Gibco;LipofectamineTM2000和熒光標記的Ⅱ抗(Alexa Flour? 488,羊抗兔)購自Invitrogen; Hoechst 33258和Lucifer yellow 熒光染料購自Sigma;ALL-in-OneTMQ-PCR Primer購自廣州復能公司;PrimeScriptTMRT reagent Kit購自大連TaKaRa ;GoTaq? Green Master Mix試劑盒購自Promega;desmoplakinⅠ/Ⅱ多克隆抗體(兔來源)和GAPDH多克隆抗體(兔來源)購自Santa Cruz,desmoplakinⅠ/Ⅱ單克隆抗體(鼠來源)購自Abcam;HRP標記的Ⅱ抗(羊抗兔) 和HRP標記的Ⅱ抗(羊抗鼠)購自KPL;PE標記的Ⅱ抗(羊抗鼠)IgG購自杭州聯科生物;熒光標記的Ⅱ抗(Alexa Flour? 647,羊抗鼠)和RIPA購自Cell Signaling Technology。DAPI購自Roche。
3主要方法
3.1HL-1細胞培養 向T25培養瓶中加入Claycomb培養基,每24~48 h更換。細胞長至完全融合后分瓶,0.05% trypsin-EDTA(37 ℃)沖洗,然后將液體去除。每個培養瓶另加1.3 mL trypsin-EDTA液,37 ℃孵化,加相同量的大豆胰蛋白酶抑制劑中和消化酶,將細胞轉移到離心管中。用5 mL沖洗培養基(Claycomb培養基含5%胎牛血清和青/鏈霉素)沖洗空培養瓶,然后加到上述15 mL離心管中,500×g離心5 min,同時去除培養瓶中的凝膠/纖維結合素液,加入4 mL Claycomb培養基到每個瓶中。取出離心管,去上清,加入3ml Claycomb培養基,混勻。
3.2siRNA轉染
3.2.1siRNA的合成 由上海吉瑪公司合成針對小鼠DSP mRNA的siRNA 寡核苷酸,共有3對陽性序列,1對陰性對照,序列見表1。為檢測siRNA 的轉染效率,同時合成1對帶熒光標記的陰性對照(FAM-siRNA)。
3.2.2siRNA轉染 裝有siRNA oligo的EP管離心(10 000 r/min、4 ℃)1 min,加入DEPC水配置成20 μmol/L的溶液,振蕩溶解,4 ℃保存。轉染前1 d,胰酶消化細胞并計數,細胞鋪在24孔板上,使其在轉染日密度為50%~70%。每孔細胞加入500 μL不含抗生素但含有血清的培養基。對于每孔細胞,使用50 μL Opti-MEMTM培養基稀釋不同濃度梯度的siRNA溶液,再用50 μL Opti-MEMTM培養基稀1 μL LipofectamineTM2000試劑,分別裝入2個EP管,室溫下孵育5分鐘后混合,孵育20 min。更換細胞培養基,加入無血清培養基500 μL,再加入上述siRNA和LipofectamineTM2000混合物,搖動混勻,在37 ℃、5% CO2的培養箱中孵育,6 h后更換含血清的生長培養基。以上操作均在超凈工作臺上完成,所有EP管和槍頭均是RNase-free。轉染FAM-siRNA時需要避光。
3.2.3Real-time PCR檢測siRNA轉染效率 HL-1細胞接種于6孔板,將實驗分為6組:siRNA-DSP-Ⅰ組、siRNA-DSP-Ⅱ組、siRNA-DSP-Ⅲ組、空白組、脂質體組和siRNA-DSP-control組,轉染48 h后提取細胞總RNA,real-time RT-PCR法檢測各組細胞中 DSP mRNA的表達情況,方法如下:Trizol法提取細胞總RNA,配置逆轉錄反應液,反應條件為37 ℃ 15 min,85 ℃ 5 s,-20 ℃保存。PCR擴增的反應體系為:正義引物 (20 μmol/L) 1 μL,反義引物 (20 μmol/L) 1 μL,模板 DNA 2 μL,RNase-free dH2O 6 μL,ALL-in-OneTMQ-PCR Primer 10 μL。擴增條件為:預變性95 ℃ 10 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s。
3.2.4引物設計 從PubMed GenBank中獲取小鼠DSP基因(NM_0238422)全序列,Primer Primier 5.0軟件設計引物,廣州復能公司合成引物,GAPDH作為內參照,各引物序列見表2。

表2 引物序列
3.3Western blotting檢測DSP和Cx43蛋白的表達 HL-1細胞接種于6孔板,細胞轉染120 h棄去培養基,預冷的PBS沖洗,每孔加入100 μL RIPA裂解液,同時加入蛋白酶抑制劑,冰上裂解30 min,收集裂解液,12 000 r/min離心20 min,去上清,分裝后儲存于-80 ℃。采用BCA蛋白定量中的標準液制定標準曲線,分光光度計測定細胞蛋白樣本吸光度值,與標準曲線比較計算總蛋白含量。按照分子克隆第2版配方分別配制相應的濃縮膠和5%分離膠;取30 μg蛋白樣本,加入4×SDS 上樣緩沖液,總體積40 μL, 煮沸5 min變性后上樣(35 μL),于Tris-甘氨酸電泳緩沖液中以120 V積層膠、180 V分離膠電泳至分離膠底端。然后將蛋白質從SDS聚丙烯酰胺凝膠轉移至硝酸纖維膜,洗膜,封閉后,將硝酸纖維膜放入雜交袋中,加入以封閉液稀釋至適當濃度的Ⅰ抗工作液(抗體以1∶200稀釋),4 ℃過夜。TBST漂洗,加以TBST-M至適當濃度的辣根酶標記的相應Ⅱ抗工作液(1∶2 000),室溫平緩搖動孵育2~3 h;漂洗后ECL Plus 檢測。Western blotting結果掃描后用Quantity One軟件分析,與內參照GAPDH相比較。
3.4雙免疫熒光檢測DSP和Cx43蛋白的定位和表達 多聚賴氨酸處理過的玻片,烘干后,高溫消毒,放于6孔板中,HL-1細胞種植于6孔板的玻片上。細胞轉染后120 h棄去培養基,用雙免疫熒光方法檢測DSP與Cx43的蛋白表達與定位情況。用冷PBS沖洗,甲醇-20 ℃固定,用0.5%Triton X-100透化;5%BSA室溫封閉;PBS沖洗后先后加鼠DSP單克隆抗體(Ⅰ抗)和兔多克隆Cx43抗體(第2種Ⅰ抗),室溫2 h或4 ℃過夜;然后沖洗后先后加熒光Ⅱ抗Alexa Flour? 647(羊抗鼠)和熒光Ⅱ抗Alexa Flour? 488(羊抗兔),37 ℃、60 min孵育;PBS沖洗,DAPI染核5 min,抗熒光衰減劑封片,在激光共聚焦顯微鏡下觀察。
3.5劃痕熒光實驗檢測縫隙連接功能 用劃痕標記染料示蹤技術(scrape loading and dye transfer,SLDT)檢測細胞縫隙連接通訊狀況。HL-1細胞接種于6孔板,轉染后120 h棄培養基,用無血清培養基洗滌細胞,用手術刀輕輕劃痕2~3 條,迅速滴加含0.05% Lucifer yellow的0.33 mol/L的Licl溶液2 mL,標記細胞3 min,用無血清培養基洗滌細胞3次,立即在熒光顯微鏡下觀察細胞間熒光傳輸情況。有縫隙連通訊功能的細胞其標記染料可沿劃痕區向外擴散,通過觀察熒光染料擴散的距離或劃痕區的熒光強度,即可直接反映細胞的縫隙連接功能狀況。
4統計學處理
數據用均數±標準差(mean±SD)表示,多組間比較用One-way ANOVA方法檢驗。用SPSS 11.0統計軟件分析,檢驗為雙側,以P<0.05為差異有統計學意義。
結 果
1FAM-siRNA轉染效率的檢測
不同濃度siRNA轉染HL-1細胞,在激光共聚焦顯微鏡下觀察,出現的綠色熒光強度不一,其中以FAM-siRNA終濃度為50 nmol/L時細胞中出現的綠色熒光最強,轉染效率最高,因此選擇50 nmol/L為本實驗進行siRNA轉染的終濃度。
2篩選最佳干擾效能的siRNA-DSP
HL-1細胞轉染siRNA-DSP后24 h進行real-time PCR分析顯示,siRNA-DSP-I組、siRNA-DSP-II組和siRNA-DSP-III組DSP mRNA表達抑制率分別為26%、24%和76%,表明siRNA-DSP-III具有明顯的干擾作用,故選擇siRNA-DSP-III進行后續實驗。
3轉染siRNA-DSP對HL-1細胞DSP蛋白表達的影響
HL-1細胞轉染siRNA-DSP 48、72、96和120 h,siRNA-DSP組的DSP蛋白表達量降低,而空白組和siRNA-DSP-control組DSP蛋白表達量無明顯改變,見圖1。

Figure 1. Western blotting assay for DSP and APDH (internal control) expression in HL-1 cells.
圖1Westernblotting檢測各組DSP蛋白的表達
4DSP基因沉默影響Cx43蛋白表達和定位
HL-1細胞轉染siRNA-DSP 120 h后采用免疫熒光技術在激光共聚焦顯微鏡下觀察DSP與Cx43蛋白的定位和表達,結果發現未處理組和對照組DSP與Cx43蛋白存在共定位情況,而siRNA-DSP組DSP和Cx43蛋白共定位則遭到破壞,Cx43蛋白出現再分布,并在細胞內檢測到Cx43蛋白,見圖2。
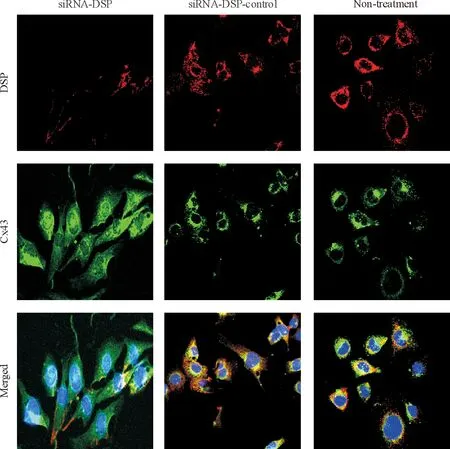
Figure 2. Immunofluorescence microscopy (×400) of HL-1 cells treated for 120 h with siRNA-DSP, non-targeting siRNA (siRNA-DSP-control), or without any siRNA(non-treatment).
圖2HL-1轉染siRNA-DSP120h后激光共聚焦顯微鏡下觀察沉默DSP基因對Cx43蛋白分布的影響
HL-1細胞轉染siRNA-DSP 120 h后用Western blotting檢測DSP和Cx43蛋白的表達,與空白組和siRNA-DSP-control組相比,siRNA-DSP組的DSP和Cx43蛋白表達量降低,見圖3。
5轉染siRNA-DSP后HL-1細胞縫隙連接通訊功能的降低
HL-1細胞轉染siRNA-DSP 120 h后發現與對照組和未處理組相比,Lucifer yellow通過HL-1細胞縫隙連接的傳輸功能降低,提示沉默DSP基因不僅使Cx43蛋白再分布,而且影響其組成的縫隙連接的功能。
討 論
縫隙連接通過調節細胞間離子轉運實現電偶聯和機械信號的傳遞,而黏附連接和橋粒則為縫隙連接提供機械穩定性,它們三者位于心肌細胞閏盤中[4]。縫隙連接由2個半通道或連接子(connexons)組成,位于鄰近細胞的胞質膜,該連接子是由6個亞基組成,其中Cx43是人類心臟的主要亞型,但是Cx40和Cx45也有較低水平的表達。
橋粒結構完整性遭到破壞會影響縫隙連接的結構和功能。最初在Naxos病和Carvajal綜合征患者中發現Cx43在縫隙連接處的表達減少[5-6],而這些患者除了心臟結構改變外,還伴有皮膚和毛發的改變。最近,Filder等[7]在PKP2突變(R635W)患者的心肌組織中發現Cx43信號減弱,而Oxford等[8]則在體外培養的心肌細胞中證實PKP2表達的抑制可以減少Cx43蛋白的表達。
目前研究表明Cx43直接或間接地與β-catenin、p120-catenin和位于心肌閏盤的鈉通道復合物等之間有關聯[9],雖然這些蛋白之間的相互作用不清楚,但Cx43可能在細胞間的信號傳遞中起作用。Ai等[10]研究發現經典信號通道上的Wnt-1蛋白可調節Cx43 的表達,縫隙連接的重塑可使Wnt-1和Cx43表達下調,而在Cx43表達缺陷的小鼠易發生室性心律失常,Cx43表達完全喪失的小鼠則可導致右室流出道梗阻和圍產期死亡。此外,Cx43與HSP90(與心肌細胞凋亡有關)之間有交互作用[11]。由于心肌細胞的傳導速度部分是由縫隙連接的功能完整性決定的,Cx43的分布不均衡可能會導致傳導速度的異質性,這有利于折返形成從而導致心律失常。本實驗發現沉默HL-1細胞的DSP基因,不僅使Cx43蛋白出現再分布,而且影響其組成的縫隙連接功能。本研究首次證明了DSP蛋白的表達抑制與Cx43的再分布及細胞間通訊傳導功能異常有關。
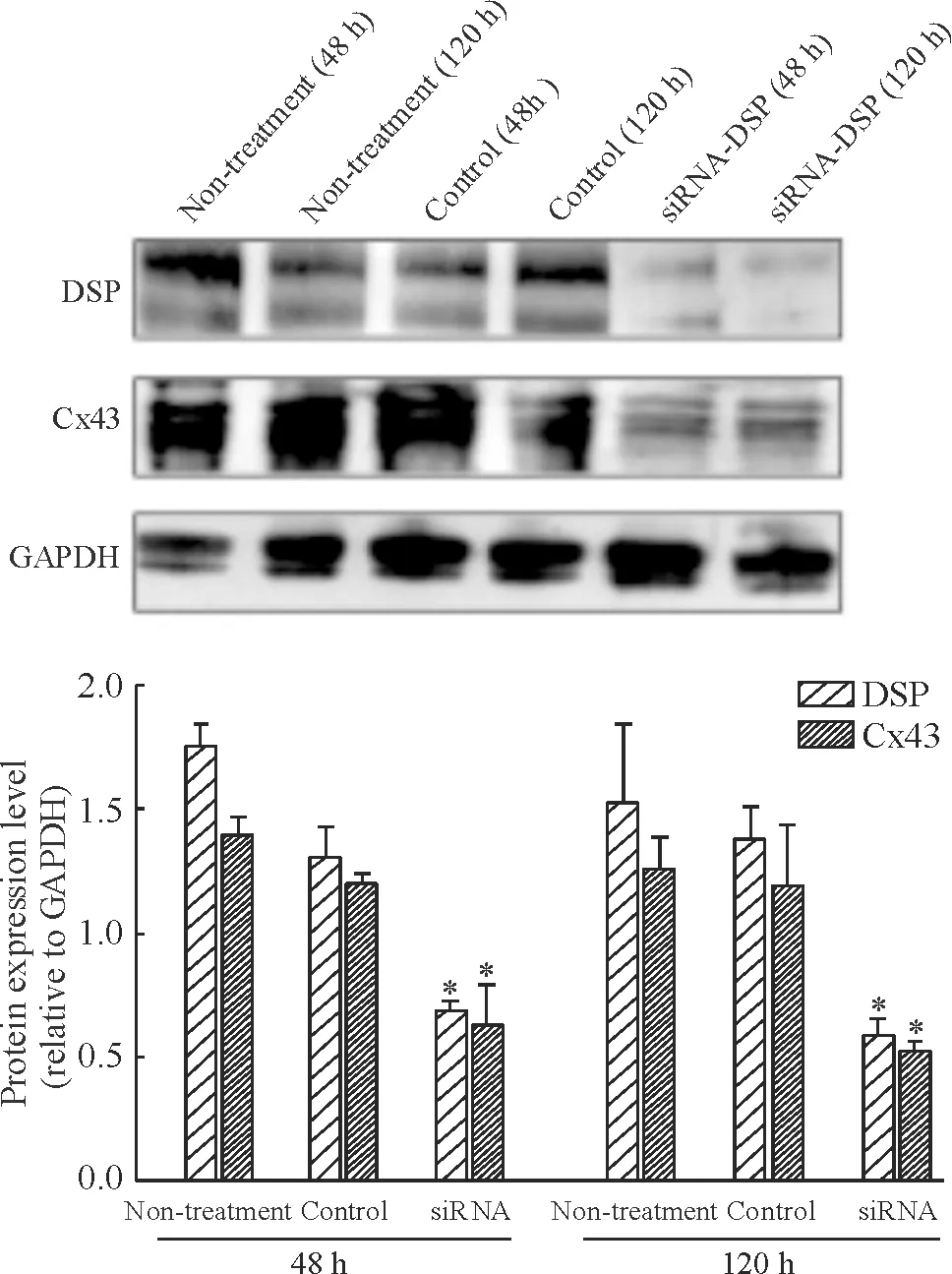
Figure 3. Western blotting for DSP and Cx43 expression in HL-1 cells treated for 48 and 120 h with siRNA-DSP, non-targeting siRNA (control), or without any siRNA (non-treatment).Mean±SD.n=3.*P<0.05vscontrol group.
圖3Westernblotting檢測各組細胞DSP和Cx43蛋白的表達
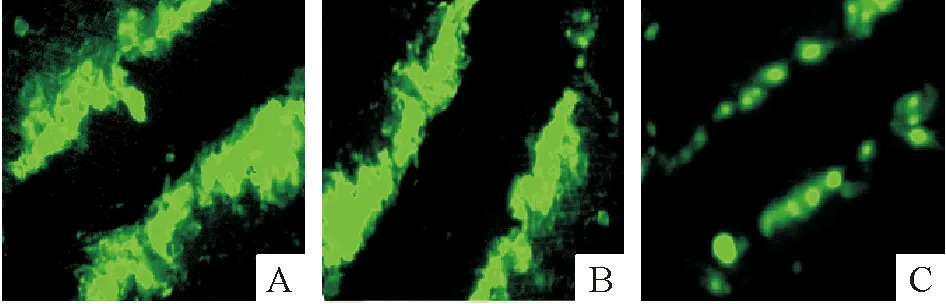
Figure 4. Scrape loading and dye transfer analysis of the coupling between cultured HL-1 cells(×400).A:non-treatment;B:siNA-DSP-control;C:siRNA-DSP.
圖4熒光顯微鏡下觀察LuciferYellow通過HL-1細胞縫隙連接的傳輸情況(5min)
DSP在維持橋粒結構的穩定性中起著重要作用,其由3部分組成:球狀頭部、螺旋狀的中間部分和尾部。球狀頭部與其它橋粒蛋白如PKP2和PG相連,在蛋白之間相互作用方面起著關鍵作用。在敲除DSP蛋白球狀頭部的轉基因小鼠中發現心肌細胞凋亡、纖維化和脂肪累積,同時心室腔擴大[12],這與人類ARVC的表現一致。目前有關DSP與Cx43相互作用的研究很少,Czyz等[11]發現 Cx43與PKP2共同存在一個大分子的復合物中,而在Carvajal綜合征的患者中證實DSP基因突變可能會導致DSP與其它蛋白如PKP2和PG之間的相互作用發生改變,盡管需要進一步的研究來證實,但由此可以推論PKP2是連接DSP與Cx43的關鍵結構,DSP與Cx43也可能存在于一個大分子復合物中,它們共同維持著心肌閏盤結構和功能的穩定。
本實驗用免疫熒光技術證實在HL-1細胞中DSP和Cx43能共定位,但如果DSP表達下調,這種共定位特征就會喪失,Cx43出現再分布,并在HL-1細胞內檢測到Cx43信號。目前尚不清楚在細胞內的Cx43其成分是否與位于縫隙連接的成分一致,細胞內的Cx43與其它閏盤結構成分的關系如何并不得而知,而且在心肌細胞中Cx43有磷酸化和非磷酸化結構,兩者與DSP的關系如何也尚不明確,因此這需要進一步的研究來闡明DSP與Cx43兩者的關系。
本實驗采用劃痕標記染料示蹤技術檢測細胞縫隙連接通訊狀況,結果發現沉默HL-1細胞DSP基因,Lucifer Yellow通過縫隙連接的傳輸功能降低,提示DSP表達抑制不僅使Cx43出現再分布,而且影響其傳導功能。雖然目前尚不能明確縫隙連接傳導功能的破壞就一定會導致心律失常,但既往的研究表明Cx43的結構受損會導致傳導速度減慢,如在缺血情況下就會導致心律失常[13]。縫隙連接不僅是電傳導的主要結構,而且還具有分子信號轉導功能[14],其結構和功能的完整性在維持心肌細胞整體平衡方面起著重要作用,如遭到破壞可能會導致心肌細胞凋亡和纖維化。動物模型的研究證實室壁心肌復極時間和不應期離散度與心律失常發生有關[15]。本研究只是對縫隙連接功能的初步探索,而位于心肌細胞閏盤結構的離子通道是否也有改變則需要進一步研究證實。
Cx43可能參與了ARVC發病機制的多個環節:縫隙連接的結構破壞、電偶聯機制的喪失和影響Wnt/β-caternin信號轉導通路。本研究證實了DSP的表達抑制使Cx43再分布,縫隙連接的轉導功能受損,因此對Cx43在ARVC中致病作用的研究需要進一步的探索。
[1] Watkins DA, Hendricks N, Shaboodien G, et al. Clinical features, survival experience, and profile of plakophylin-2 gene mutations in participants of the Arrhythmogenic Right Ventricular Cardiomyopathy Registry of South Africa[J]. Heart Rhythm, 2009,6(11 Suppl):S10-S17.
[2] Xu T, Yang Z, Vatta M, et al. Compound and digenic heterozygosity contributes to arrhythmogenic right ventricular cardiomyopathy[J]. J Am Coll Cardiol, 2010,55 (6):587-597.
[3] Asimaki A, Tandri H, Huang H, et al. A new diagnostic test for arrhythmogenic right ventricular cardiomyopathy[J]. N Engl J Med, 2009,360(11):1075-1084.
[4] Li K, Chi Y, Gao K, et al. Connexin43 hemichannel-mediated regulation of connexin43[J]. PLoS One, 2013,8 (2):e58057.
[5] Norgett EE, Hatsell SJ, Carvajal-Huerta L, et al. Recessive mutation in desmoplakin disrupts desmoplakin-intermediate filament interactions and causes dilated cardiomyopathy, woolly hair and keratoderma[J]. Hum Mol Genet, 2000,9(18):2761-2766.
[6] Kaplan SR, Gard JJ, Protonotarios N, et al. Remodeling of myocyte gap junctions in arrhythmogenic right ventricular cardiomyopathy due to a deletion in plakoglobin (Naxos disease)[J]. Heart Rhythm, 2004,1(1):3-11.
[7] Fidler LM, Wilson GJ, Liu F, et al. Abnormal conne-xin43 in arrhythmogenic right ventricular cardiomyopathy caused by plakophilin-2 mutations[J]. J Cell Mol Med, 2009,13(10):4219-4228.
[8] Oxford EM, Everitt M, Coombs W, et al. Molecular composition of the intercalated disc in a spontaneous canine animal model of arrhythmogenic right ventricular dyspla-sia/cardiomyopathy[J]. Heart Rhythm, 2007,4(9):1196-1205.
[9] Noorman M, Hakim S, Kessler E, et al. Remodeling of the cardiac sodium channel, connexin43, and plakoglobin at the intercalated disk in patients with arrhythmogenic cardiomyopathy[J]. Heart Rhythm, 2013,10(3):412-419.
[10] Ai Z, Fischer A, Spray DC, et al. Wnt-1 regulation of connexin43 in cardiac myocytes[J]. J Clin Invest, 2000,105(2):161-171.
[11] Czyz J, Guan K, Zeng Q, et al. Loss of beta 1 integrin function results in upregulation of connexin expression in embryonic stem cell-derived cardiomyocytes[J]. Int J Dev Biol, 2005,49(1):33-41.
[12] Noorman M, van der Heyden MA, van Veen TA, et al. Cardiac cell-cell junctions in health and disease: Electrical versus mechanical coupling[J]. J Mol Cell Cardiol, 2009,47(1):23-31.
[13] Thomas SP, Kucera JP, Bircher-Lehmann L, et al. Impulse propagation in synthetic strands of neonatal cardiac myocytes with genetically reduced levels of connexin43[J]. Circ Res, 2003,92(11):1209-1216.
[14] Goldberg GS, Valiunas V, Brink PR. Selective permeability of gap junction channels[J]. Biochim Biophys Acta, 2004,1662(1-2):96-101.
[15] 譚含旋,初紅霞,樊靜靜,等. 心力衰竭犬跨室壁心肌復極時間和不應期離散度的致心律失常機制研究[J]. 中國病理生理雜志,2011,27(3):417-424.
Inhibitionofdesmoplakinexpressioninducesconnexin43remodelinginmouseHL-1myocardialcells
ZHANG Qian-huan, DENG Chun-yu, RAO Fang, LIU Xiao-ying, MAI Li-ping, ZHU Jie-ning, TAN Hong-hong, WU shu-lin
(DepartmentofCardiology,GuangdongGeneralHospital,GuangdongCardiovascularInstitute,Guangzhou510100,China.E-mail:wushulind@gmail.com)
AIM: To evaluate the content, distribution, and function of connexin 43 (Cx43) gap junctions in mouse HL-1 myocardial cells under the condition of desmoplakin (DSP) silencing.METHODSThe technique of RNA interference was used to inhibit the protein expression of DSP in HL-1 cells. The protein expression of DSP and Cx43 was analyzed by Western blotting and flow cytometry. The immunofluorescence staining was used to detect the distribution and co-localization of DSP and Cx43. The techniques of scrape loading and dye transfer were also used to determine the function of Cx43 gap junctions.RESULTSCompared with non-treatment group and negative control group, the protein expression of DSP and Cx43 was reduced (P<0.05). Co-localization to the site of cell-cell contact was apparent in untreated and control conditions, but loss of DSP expression induced by siRNA-DSP correlated with a drastic redistribution of Cx43. Instead, Cx43 was found mostly within the intracellular space. The results of dye transfer assay indicated a significant decrease in the function of Cx43 gap junctions of the cells treated with siRNA-DSP.CONCLUSIONInhibition of DSP expression induces redistribution of Cx43 and decrease in dye coupling between cells.
Connexin 43; Desmoplakin; Gene silencing; HL-1 cells
R542.2
A
10.3969/j.issn.1000- 4718.2013.06.004
1000- 4718(2013)06- 0982- 06
2013- 03- 22
2013- 05- 15
廣東省自然科學基金資助項目(No. 10151008002000011)
△通訊作者 Tel: 020-83827812; E-mail: wushulind@gmail.com

