2型糖尿病患者鐵蛋白濃度與胰島素抵抗的相關性研究
須 靜, 胡曉波
(上海交通大學醫學院附屬第三人民醫院檢驗科,上海201900)
世界衛生組織(WHO)預測,糖尿病患者的人數將從1995年的1.35億增加至2025年的3億,其中亞洲的增長幅度最大。糖尿病的年發病率已經達到0.5%~1.0%。鐵蛋白是調控鐵代謝的關鍵蛋白,是鐵營養狀況的一種臨床生物標志物。研究表明,鐵蛋白濃度增高與高血壓、血脂異常和葡萄糖耐受不良有關[1]。在動物模型中,鐵過量可導致β細胞的氧化應激,降低胰島素分泌能力。因此,鐵過量可降低胰島素的敏感性,加速早期糖尿病并發癥[2]。鐵過量在糖尿病發病中的確切分子機制尚未完全確定。據推測,鐵過量可能通過減少肝臟對胰島素提取能力,或通過降低胰島素的胰島β細胞合成和分泌,從而會引起周邊高胰島素血癥。鐵介導氧化的游離脂肪酸增加也可能促使肌肉減少對葡萄糖的攝取,導致胰島素抵抗(insulin resistance,IR)的增強。此外,鐵是一個潛在的親氧化劑,已顯示出在細胞水平受胰島素信號干擾的影響,這種效應也成為促進胰島素抵抗的主要機制之一。
對體內鐵儲存和糖代謝異常之間關系研究主要集中在西方國家,在亞洲人群中相對較少[3-5]。鐵蛋白濃度反是映機體鐵貯存狀況的標志,是判斷體內鐵缺乏及鐵超負荷的有效標志。我們旨在探討2型糖尿病(type 2 diabetes mellitus,T2DM)患者血清鐵蛋白(serum ferritin,SF)和IR之間的相關性。
材料和方法
一、研究對象
1.T2DM組 選擇2009年7月至2013年4月上海交通大學醫學院附屬第三人民醫院住院的T2DM患者100例,其中男58例、女42例,年齡27~79歲。T2DM的診斷依據1999年WHO的診斷標準,即空腹血糖≥7.0 mmol/L及(或)口服葡萄糖耐量試驗(OGTT)2 h血糖≥11.1 mmol/L。所有入選對象均排除感染、惡性腫瘤、肝病及貧血。
2.高SF非T2DM組(簡稱高SF組) 選擇同期100例高SF的非T2DM患者,其中男54例、女46例,年齡26~78歲。選擇依據為SF>400 ng/mL,排除糖尿病史且無感染、高血壓、高脂血癥、腦血管病家族史、冠心病等。
3.正常對照組 選擇同期上海交通大學醫學院附屬第三人民醫院健康體檢者100名,男57名,女43名,年齡21~74歲,無糖尿病、感染、高血壓、高脂血癥、腦血管病家族史和冠心病等。3組之間年齡和性別差異均無統計學意義(P>0.05),具有可比性。
二、儀器與試劑
采用BECKMAN Dxc 800型全自動生化分析儀及原裝試劑(美國Beckman公司)檢測空腹血糖(FBG)。采用ROCHE E601型全自動化學發光分析儀及原裝試劑(瑞士Roche公司)檢測SF和空腹胰島素(FINS)。采用BIO-RAD D-10全自動糖化血紅蛋白分析儀(美國Bio-Rad公司)檢測全血糖化血紅蛋白(HbA1c)。采用SYSMEX XE-2100全自動血液分析儀及原裝試劑(日本Sysmex公司)檢測血紅蛋白(Hb)、血細胞壓積(Hct)、紅細胞平均體積(MCV)和紅細胞平均血紅蛋白量(MCH)。
三、方法
所有對象均按要求禁食至少8 h,于清晨采用分離膠負壓采血管采集空腹肘靜脈血3 mL,以1 400×g離心10 min分離血清,用于測定FBG、SF和FINS。同時抽取2 mL靜脈血置EDTA-K2抗凝管中,用于測定HbA1c及進行全血細胞計數。IR采用穩態模型(HOMR-IR)評估,HOMR-IR=FBG(mmol/L)×FINS(μU/mL)/22.5[6]。
四、統計學方法
結 果
一、T2DM組、高SF組及正常對照組各項指標的檢測結果比較
與正常對照組比較,T2DM組 SF、FBG、HbA1c、FINS、HOMR-IR 明顯升高(P<0.05),其余指標無明顯變化(P>0.05);高SF組SF、MCV明顯升高(P<0.05),Hb、Hct明顯降低(P<0.05),其余指標無明顯變化(P>0.05)。與高SF 組比較,T2DM 組 Hb、FBG、HbA1c、FINS、HOMA-IR明顯升高(P<0.05),SF無明顯差異(P>0.05)。見表1。
二、T2DM組、高SF組SF與其他指標的相關性分析
將T2DM組、高SF組的SF與其他指標進行Person相關分析。結果表明T2DM組SF與FBG、HbA1c、FINS、HOMR-IR 呈明顯正相關,與Hb、Hct、MCV和MCH無相關性。高SF組SF與Hb、Hct呈明顯負相關,與MCV、MCH、FBG、HbA1c、FINS、HOMR-IR無相關性。見表2。
表1 3組間各項目檢測結果之間的比較(±s)
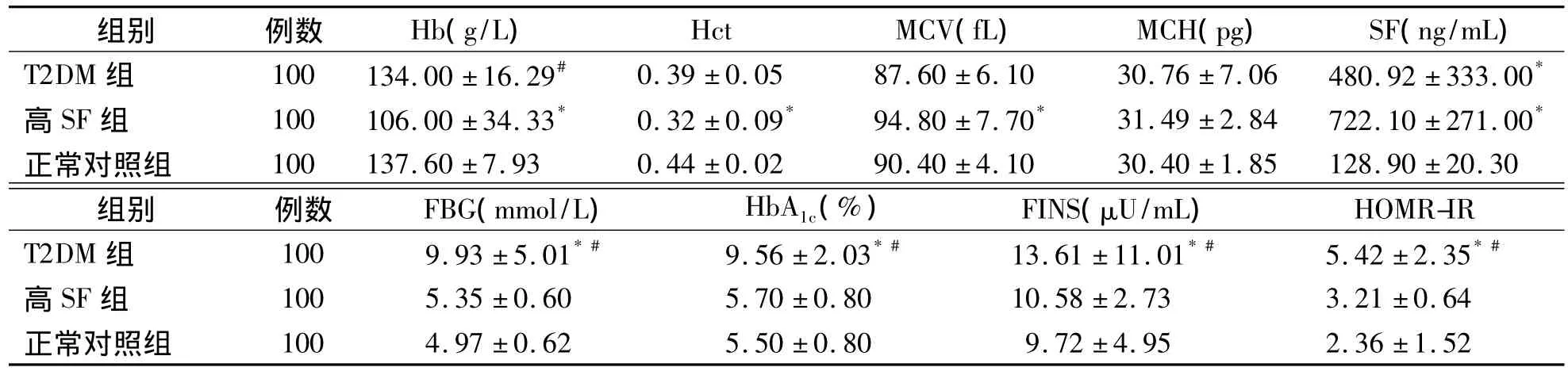
表1 3組間各項目檢測結果之間的比較(±s)
注:與正常對照組比較,*P<0.05;與高 SF組比較,#P<0.05
高 SF 組 100 5.35±0.60 5.70±0.80 10.58±2.73 3.21±0.64正常對照組100 4.97±0.62 5.50±0.80 9.72±4.95 2.36±1.52
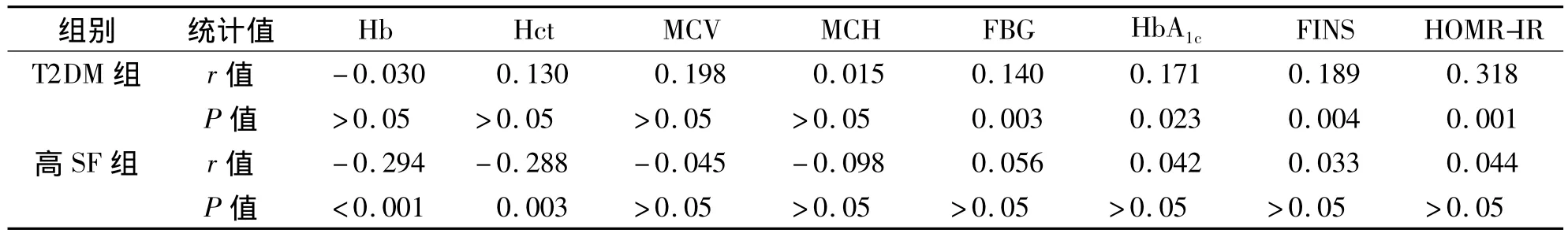
表2 T2DM組、高SF組SF與其他項目的Person相關分析
討 論
鐵是人體內含量最大的微量元素,廣泛參與了人體各種生理功能及生化反應。眾所周知,缺鐵可引起貧血等疾病。但近年來,越來越多的流行病學調查和試驗研究提示,鐵超負荷也可以對人體健康造成危害。IR和胰島β細胞缺陷被普遍認為是T2DM發病機制中的主要環節,IR在T2DM發生、發展的過程中更是占據舉足輕重的作用。正常人群中IR可達20%,T2DM更是高達80%[7]。盡管體內鐵超負荷引起IR的確切機制尚不明確。但有研究表明,鐵超負荷可影響肝臟及肌肉組織對胰島素的攝取,導致外周高胰島素血癥[3]。還有研究認為,鐵促進羥自由基的形成,促進IR的發生與發展。在整個人群中,IR與鐵儲備量有關。如果鐵儲備量超過正常上限10%,胰島素水平則明顯增高;如低于此值,鐵負荷對葡萄糖代謝的影響可忽略不計。有學者提出,SF是胰島素綜合征(IRS)的一個組分,同時也可能是T2DM患者病程控制好壞的一個標志[8]。鐵儲備可能就是通過IR途徑來參與糖尿病的發生與發展。本研究結果顯示,T2DM組SF、FINS水平明顯高于正常對照組,且與HOMA-IR呈明顯正相關;高SF組SF水平明顯高于正常對照組,并與Hb、Hct呈明顯負相關,但與FBG、HbA1c、FINS、HOMR-IR無相關性,說明若T2DM存在IR的情況,與鐵儲存量的多少有一定關系。
多項研究顯示鐵蛋白和葡萄糖動態平衡有關聯。首先,T2DM患者伴血色素沉著癥(一種伴有鐵過量的遺傳性疾病)是非常普遍的。其次,據文獻[9-12]報道,部分代謝綜合征、T2DM、妊娠糖尿病及地中海貧血患者其鐵蛋白增加與葡萄糖平衡破壞的風險有一定相關性。而且,2項基于美國護士群體[13]的前瞻性研究發現鐵蛋白水平升高可預測T2DM的發病率。Jehn等[13]發現,非糖尿病白人男性的鐵蛋白濃度為109~198 ng/mL,女性為72~107 ng/mL;而糖尿病患者的平均SF水平分別為262和159 ng/mL。這些結果與臺灣地區男性(224 ng/mL)和女性(108 ng/mL)的結果類似,但均高于 Lin等[14]的研究結果(男性為132 ng/mL、女性為71 ng/mL)。這種情況可能是鐵蛋白存在性別、種族和血糖控制狀況的差異。但在這些研究中大多沒有考慮膳食鐵攝入量和遺傳因素。這些因素也可能會導致鐵蛋白濃度發生變化。高SF水平可能在代謝綜合征的發展過程中發揮重要的因果作用[15]。在氧化應激狀態下,SF的升高可能有助于細胞或組織損傷,通過鐵中毒途徑導致胰島素功能障礙,如IR和胰島β細胞功能異常。從分子水平看,鐵是一種過渡金屬元素,通過催化自由基的形成,可能導致氧化器官損傷。通過對壓力敏感的信號轉導通路的激活,氧化應激狀態增加了NADPH氧化酶的活性,同時降低其抗氧化活性。另一個可能的解釋是那些慢性氧化應激與胰腺中的線粒體氧化功能障礙相關。現有研究認為,長期高血糖可導致機體處于氧化應激狀態,并通過上述機制在糖尿病的發展及并發癥形成上起重要作用[16]。因此,胰島素抵抗主要是由于氧化應激和慢性炎癥在代謝綜合征的發展過程中發揮重要的作用。而T2DM作為代謝綜合征中的一種受到越來越多研究者的關注。本研究發現,T2DM患者的鐵蛋白濃度(480 ng/mL)明顯高于健康體檢者(128 ng/mL),且與HOMR-IR呈正相關。因此,我們或可認為:(1)SF與血糖之間的關系可能與IR密切相關;(2)SF水平可作為臨床評價IR的一項指標;(3)鐵儲備量增高可輔助預測T2DM的發生和發展。
炎癥作為調節鐵蛋白mRNA和蛋白水平的機制,同時也是其產物。因此,鐵蛋白水平升高可能反映了機體內鐵儲存升高的全身性炎癥。本研究中專門設置了高SF組,以排除非糖尿病的高SF患者對結果的影響。本研究發現,高SF組Hb濃度(106.0 g/L)明顯低于健康體檢者(137.6 g/L)。由于高SF組患者多為慢性炎癥所致的慢性貧血者,其鐵蛋白濃度(722 ng/mL)明顯高于健康體檢者(128 ng/mL),甚至高于T2DM患者(480 ng/mL),但其濃度與HOMR-IR無關。可見炎癥狀態也是一個非常重要的混雜因素,且其影響不可小覷,需在未來的模型中做調整。事實上,最近有研究調查了炎癥對鐵含量和代謝綜合征或糖尿病風險之間關聯的影響,發現鐵過量、鐵蛋白水平增高與代謝改變相關,即使調整各種炎癥因子后亦如此[17]。
綜上所述,T2DM患者普遍存在鐵超負荷,與IR有一定的相關性。解釋SF水平和IR之間關聯的具體機制還需要進一步研究。
[1]H?m?l?inen,Saltevo J,Kautiainen H,etal.Erythropoietin,ferritin,haptoglobin,hemoglobin and transferrin receptor in metabolic syndrome:a case control study[J].Cardiovasc Diabetol,2012,11:116.
[2]Wlazlo N,van Greevenbroek M,Ferreira I,etal.Iron metabolism is associated with adipocyte insulin resistance and plasma adiponectin:the cohort on diabetes and atherosclerosis maastricht(CODAM)study[J].Diabetes Care,2013,36(2):309-315.
[3]Ferrannini E.Insulin resistance,iron,and the liver[J].Lancet,2000,355(9222):2181-2182.
[4]Luan de C,Li H,Li SJ,etal.Body iron stores and dietary iron intake in relation to diabetes in adults in North China[J].Diabetes Care,2008,31(2):285-286.
[5]Shi Z,Hu X,Yuan B,etal.Association between serum ferritin,hemoglobin,iron intake,and diabetes in adults in Jiangsu,China[J].Diabetes Care,2006,29(8):1878-1883.
[6]Liu Q,Sun L,Tan Y,etal.Role of iron deficiency and overload in the pathogenesis of diabetes and diabetic complications[J].Curr Med Chem,2009,16(1):113-129.
[7]Fernández-Real JM,Pe?arroja G,Castro A,etal.Blood letting in high-ferritin type 2 diabetes:effects on insulin sensitivity and beta-cell function[J].Diabetes,2002,51(4):1000-1004.
[8]Kundu D,Roy A ,Mandal T,etal.Relation of iron stores to oxidative stress in type 2 diabetes[J].Niger J Clin Pract,2013,16(1):100-103.
[9]Tuomainen TP,Nyyss?nen K,Salonen R,etal.Body iron stores are associated with serum insulin and blood glucose concentrations.Population study in 1 013 eastern Finnish men[J].Diabetes Care,1997,20(3):426-428.
[10]Jiang R,Manson JE,Meigs JB,etal.Body iron stores in relation to risk of type 2 diabetes in apparently healthy women[J].JAMA,2004,291(6):711-717.
[11]Lao TT,Chan PL,Tam KF.Gestational diabetes mellitus in the last trimester-a feature of maternal iron excess[J].Diabet Med,2001,18(3):218-223.
[12]Cario H,Holl RW,Debatin KM,etal.Disproportionately elevated fasting proinsulin levels in normoglycemic patients with thalassemia major are correlated to the degree of iron overload[J].Horm Res,2003,59(2):73-78.
[13]Jehn ML,Guallar E,Clark J,etal.A prospective study of plasma ferritin level and incident diabetes:the atherosclerosis risk in communities(ARIC)study[J].Am J Epidemiol,2007,165(9):1047-1054.
[14]Liu Q,Sun L,Tan Y,etal.Role of iron deficiency and overload in the pathogenesis of diabetes and diabetic complications[J].Curr Med Chem,2009,16(1):113-129.
[15]Park SK,Ryoo JH,Kim MG,etal.Association of serum ferritin and the development of metabolic syndrome in middle-aged Korean men:a 5-year follow-up study[J].Diabetes Care,2012,35(12):2521-2526.
[16]Cooksey R,Jouihan H,Ajioka R,etal.Oxidative stress,beta-cell apoptosis,and decreased insulin secretory capacity in mouse models of hemochromatosis[J].Endocrinolgy,2004,145(11):5305-5312.
[17]Sun L,Franco OH,Hu FB,etal.Ferritin concentrations,metabolic syndrome,and type 2 diabetes in middleaged and elderly Chinese[J].J Clin Endocrinol Metab,2008,93(12):4690-4696.

