中藥及雷氏大疣蛛毒干預小鼠皮下移植肝腫瘤細胞后RhoA/ROCK信號通路蛋白表達的變化
陳繼新,劉天云,羅赤苗,張國華,陳嘉勤,鄭 核,賀小平(.南華大學,湖南 衡陽 00;.邵陽市第一人民醫院外科;.邵陽市中心醫院;.湖南師范大學體育學院)
肝癌是由遺傳和表觀遺傳改變而發生的惡性腫瘤[1]。目前,臨床上一般采取手術、放療、化療、生物治療、中藥治療以及綜合治療等療法。手術切除和肝移植仍是肝癌治療最佳方法,但由于肝臟腫瘤惡性程度高,進展快,故臨床上就診患者約半數以上患者已為中晚期,且接受手術治療患者術后易轉移、復發。對于可手術的肝癌患者,術后復發、轉移是影響治療效果及預后的主要因素,對于不能手術的中晚期肝癌患者尚缺乏有效的治療方法。因此,深入了解肝癌的發生發展機制,尋找新的治療手段對肝癌患者臨床治療有極為重要的意義。
雷氏大疣蛛毒素已被研究證實是由神經毒性肽、蛋白質和低分子量物質所構成的復雜混合物,具有多種活性[2-3]。有研究發現,雷氏大疣蛛毒可以抑制人肝癌BEL-7402、HepG2細胞、宮頸癌Hela細胞的生長及增殖[4-6]。其對多種癌細胞株增殖抑制作用的機制仍未明確。中醫藥在抗擊肝癌的過程中發揮了重要的作用,從中藥中尋找有效的抗癌藥物是當前的研究熱點之一。本實驗用的抗癌中藥由白花蛇舌草和半邊蓮等中草藥組成,具有清熱解毒、活血化瘀、提高機體免疫力等功效;對治療腫瘤則正虛邪實,扶正固本與驅邪[7],其機制有待于進一步的研究。
RhoA(Ras homolog gene family,member A)是小分子Rho家族的一員,它在參與維持細胞形態、細胞的粘附作用及細胞周期調控中起重要作用。研究表明,RhoA在許多腫瘤中異常表達,且促進了腫瘤細胞的惡性化程度。Rho激酶(Rho associated kinase,ROCK)屬于絲氨酸/蘇氨酸蛋白激酶,約有1300個氨基酸殘基。ROCK是RhoA重要的效應蛋白之一,通過對肌球蛋白輕鏈的磷酸化而參與細胞聚集、黏附和纖維收縮,轉染ROCK的癌細胞可不依賴于血清而產生侵襲特性。本研究采用雷氏大疣蛛毒和抗癌中藥干預的手段,通過HE染色觀察腫瘤組織細胞形態觀察、免疫組織化學方法法檢測小鼠皮下移植的H22肝腫瘤組織中RhoA和ROCK等蛋白的表達,探討其在H22肝腫瘤組織中的表達和理論意義,為肝癌患者預后判斷及臨床治療提供新的實驗依據。
1 材料與方法
1.1 動物及分組
成年健康雄性昆明(KM)小鼠,體重18~22 g,由湖南斯萊克景達實驗動物中心(許可證號:湘scxk2003-003)提供,適應性喂養一周。將30只KM小鼠隨機均分為3組:模型組,雷氏大疣蛛毒素組和中藥組,每組10只。各組小鼠分籠飼養,室溫23~25 ℃,相對濕度40~60%;自由進食、飲水,采用國家標準嚙齒類動物飼料(湖南斯萊克景達實驗動物中心提供)飼養。
1.2 方法
1.2.1 動物模型構建 模型組,雷氏大疣蛛毒素組和中藥組小鼠均參照皮下注射法[8]構建皮下移植瘤模型。具體操作:將濃度為1×106個/mL小鼠H22肝癌腫瘤培養細胞懸液,接種于8只KM小鼠后頸部皮下,接種體積為0.5 mL/只。待瘤體長至1~1.5 cm3時(15天左右),處死小鼠,選擇生長良好的瘤組織,無菌條件下制成瘤細胞懸液(約每毫升含瘤細胞2×106個),每只小鼠后頸部皮下接種0.2 mL。
1.2.2 給藥方案 雷氏大疣蜘蛛毒素由湖南師范大學生命科學學院蛋白質化學與分子生物學實驗室提供。臨用前取無菌生理鹽水按1∶10的比例稀釋,制成雷氏大疣蜘蛛毒素輸注液。建模成功后第三天開始尾靜脈雷氏大疣蛛毒素,雷氏大疣蛛毒素組尾靜脈注射0.3 mL,連續給藥20天。中藥方劑組成:三棱6 g、莪術6 g、赤芍6 g、鱉甲5 g、當歸6 g、川芎6 g、豬苓6 g、玄胡7 g、丹參7 g、紫草根6 g、白花蛇舌草12 g、半枝蓮12 g、蒲公英12 g、大黃3 g。藥液制備:用400 mL水浸泡,加熱煮沸,文火煎煮1 h,趁熱過濾;同法再煮2次,合并3次濾液,經恒溫水浴濃縮至100 mL,4 ℃保存備用。按人與小鼠體表面積折算等效劑量經口灌胃。中藥灌胃劑量0.4 mL/次,共6周。中藥組和雷氏大疣蜘蛛毒素組小鼠于術后3天開始每天(下午6時)干預。
1.2.3 試劑 RhoA、ROCK、P21、Bad、bcl-2一抗由武漢博士德生物工程有限公司提供,即用型二抗二抗即用型SABC小鼠/兔IgG、抗體稀釋液、DAB、DAB Kit、Poly-L-Lysine、快捷免疫組化、Tween20由福州邁新生物有限公司提供。0.9%氯化鈉注射液、甲醇、無水乙醇、多聚甲醛等常用分析純試劑均購于上海化學試劑公司;10%水合氯醛購自邵陽市中心醫院。
1.2.4 樣品采集與處理 6周后各組小鼠禁食過夜,用10%的水合氯醛麻醉,頸椎脫臼處死。取出腫瘤組織并稱重,取部分新鮮腫瘤組織保存于液氮中,進行總RNA提取;另一部分置于10%多聚甲醛溶液(0.1M,pH=7.4)中固定12小時以上,石蠟包埋、組織切片,HE染色觀察及免疫組化染色分析。
1.2.5 小鼠腫瘤體積測量 H22肝癌腫瘤細胞懸液接種后,每天觀察小鼠腫瘤生長情況,自可見皮下醬黑色腫塊突起(平均第3天)起,每4天測量1次腫瘤體積。用游標卡尺測量瘤體的最長徑(L)和最短徑(W),按公式(V=0.5236×L×W)計算各瘤體體積,繪制腫瘤生長曲線。
1.2.6 病理學觀察 取厚3 μm石蠟切片,脫蠟、脫水,蘇木素和伊紅HE染色,脫水,透明、中性樹膠封片,光學顯微鏡下觀察腫瘤組織形態學。
1.2.7 免疫組織化學染色 采用SABC法免疫組織化學染色檢測腫瘤組織RhoA/ROCK信號通路及相關細胞因子蛋白水平的差異表達:多聚賴氨酸涂片,厚3 μm石蠟切片,高壓鍋沸騰檸檬酸熱抗原修復,一抗(1∶500),室溫孵育1 h,PBS沖洗干凈,二抗(即用型SABC小鼠/兔IgG),室溫孵育30 min,PBS沖洗干凈,DAB顯色5~10 min,蘇木素復染1~3 min,Olympus(日本)顯微拍照。PBS代替一抗作陰性對照。用Leica Qwin V3圖像分析系統(Leica公司,德國)分析免疫組化陽性產物面積,每張切片在200倍鏡下選取不相重疊的3個代表性視野,計算每個樣本的陽性面積百分比(陽性反應面積/測量面積)。
1.2.8 質量控制 動物采用固定的飼養人員,實驗取材、指標檢測人員固定,以消除人員異動引起的誤差。小鼠灌胃動作要輕柔,從口角進入,防止損傷食道。尾靜脈注射前要用酒精擦拭尾巴,擴充血管;選擇進針部位,遵循先遠后近原則,以抽回血方式作為針進入血管的標志。
1.3 統計學分析
應用SPSS19.0軟件包進行統計學分析,用Excel軟件作圖。數據以平均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用雙側t檢驗,P<0.05為差異具有顯著統計學意義。
2 結 果
2.1 動物一般行為學觀察
模型構建過程中,各組未發生意外死亡情況。模型構建成功后,小鼠食欲較正常,精神狀態尚可。隨腫瘤生長,小鼠食欲下降、精神狀態逐漸變差。雷氏大疣蛛毒素組和中藥組小鼠上述癥狀均輕于模型非干預組。
2.2 小鼠腫瘤生長狀況
如表1顯示,小鼠測量數目為每組10只,腫瘤測量次數為10次,每4天測量一次。由表可見:模型對照組腫瘤體積生長速度最快,雷氏大疣蛛毒素干預組最慢,中藥干預組居間。自第2次測量開始雷氏大疣蛛毒組與模型組體積出現差異(P<0.05),第3、第4次測量顯示中藥組、雷氏大疣蛛毒組與模型對照組相比有非常顯著性差異(P<0.01),且雷氏大疣蛛毒組與中藥組相比出現差異(P<0.05)及(P<0.01)。第5次測量結果顯示:與模型對照組相比中藥組、雷氏大疣蛛毒組均有顯著性差異(P<0.05),雷氏大疣蛛毒組與中藥組相比存在顯著性差異(P<0.05)。第6、7、8、9、10次測量結果均顯示中藥組、雷氏大疣蛛毒組與模型對照組相比存在非常顯著性差異(P<0.01),且雷氏大疣蛛毒組與中藥組相比存在非常顯著性差異(P<0.01)。
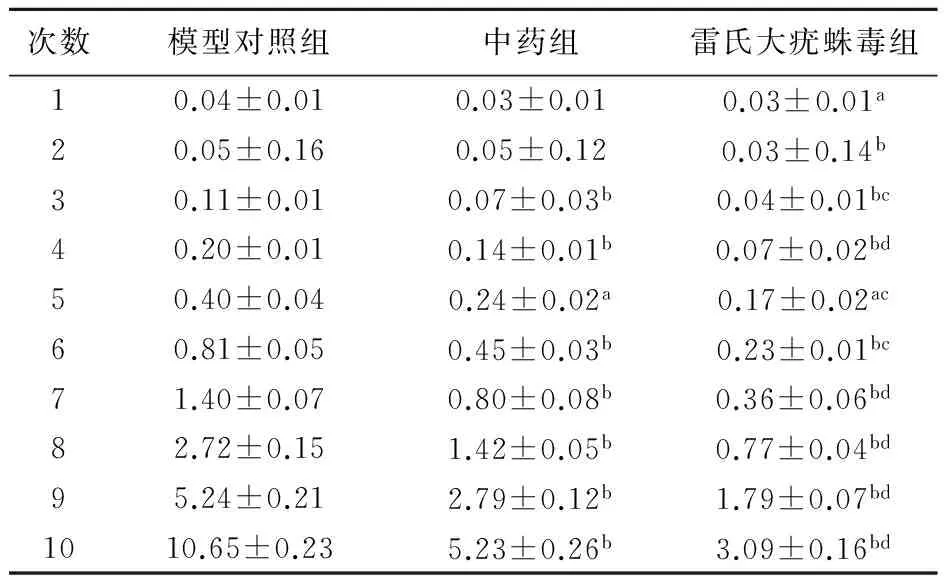
表1 三組小鼠腫瘤體積10次測量結果
2.3 三組小鼠腫瘤組織HE染色形態學觀察
HE染色結果(圖1)顯示:模型非干預組小鼠腫瘤細胞排列緊密、規整,核質比較大,核染色深且異型性明顯。雷氏大疣蛛毒素組小鼠:細胞排列稀疏、欠規則,可見異型細胞。腫瘤細胞核固縮,片狀空泡樣變性、壞死。壞死區面積大于低劑量組。中藥組:腫瘤細胞排列松散、無序,出現壞死區,胞核較小、破壞不明顯,可見少量空泡樣變性。
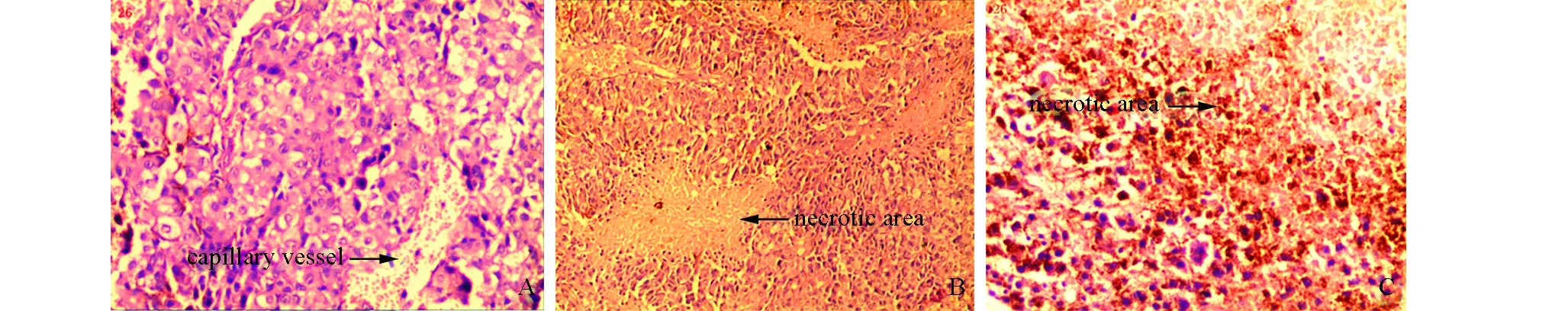
圖1 三組小鼠腫瘤組織病理切片HE染色圖(×200)
2.4 三組小鼠腫瘤組織RhoA、ROCK、p21免疫組化檢測
從圖2可以看出:RhoA、ROCK表達定位于細胞漿,偶見細胞膜。p21表達定位于細胞核。RhoA、ROCK表達的強弱(棕黃色陽性顆粒的散布程度)依次為模型組、抗癌中藥、雷氏大疣蛛毒素干預組。p21表達的強弱(棕黃色陽性顆粒的散布程度)依次為雷氏大疣蛛毒素干預組、抗癌中藥組、模型組。
表2顯示,與模型非干預組相比較,雷氏大疣蛛毒素組p21表達最高,(P<0.01)。模型組RhoA、ROCK表達均最高,抗癌中藥組、雷氏大疣蛛毒素組表達與模型組相比較顯著降低(P<0.01)。且抗癌中藥組與雷氏大疣蛛毒素組比較差異有顯著性差異(P<0.01)。
3 討 論
腫瘤細胞轉移,首先要黏附于宿主細胞表面,再通過血液循環系統轉移到遠處。這個過程涉及多種基因產物之間的相互協調作用,其中重要的是調節細胞形態、移動、粘附的細胞骨架肌動蛋白[9]。RhoA是小分子G蛋白Rho家族的一員,被認為與細胞形態、運動、細胞骨架的組裝和遷移有關[10-12]。在肝癌組織中,RhoA表達量增高,并且其過量表達與肝癌的分化程度、結節數目、有無靜脈浸潤以及有無肝外轉移灶有關[13-14]。ROCK屬于絲氨酸/蘇氨酸蛋白激酶,約有1300個氨基酸殘基。RhoA蛋白激活后,與ROCK的RBD結合將ROCK激活,同時發生定向轉位與肌球蛋白輕鏈(MLC)靠近。ROCK的激活本身可以將MLC磷酸化而發生肌絲收縮作用,同時MLCP是活化ROCK的底物,在接受RhoA/ROCK的活化信號后磷酸化,從而失活,阻止了磷酸化的MLC脫磷酸失活,使得胞漿內磷酸化MLC水平提高,肌球-肌動蛋白交聯增加,促進MLC磷酸化而促進肌絲收縮在癌細胞的遷移中起主要作用[15]。此外,有研究顯示RhoA/ROCK蛋白調節細胞周期主要涉及在G1/S轉化過程[9]。
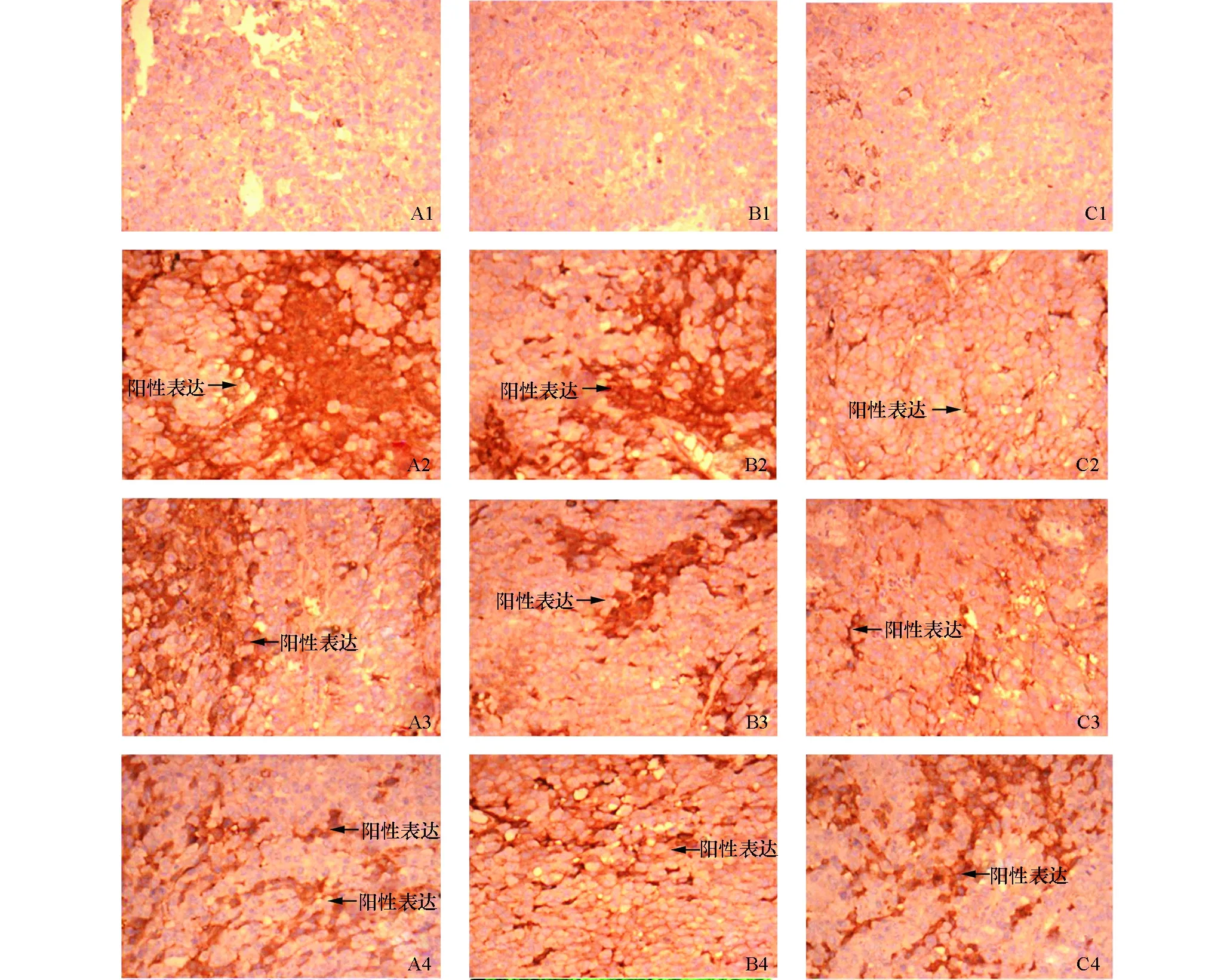
圖2 三組小鼠腫瘤組織中RhoA、ROCK、p21免疫組織化學染色結果(×200)
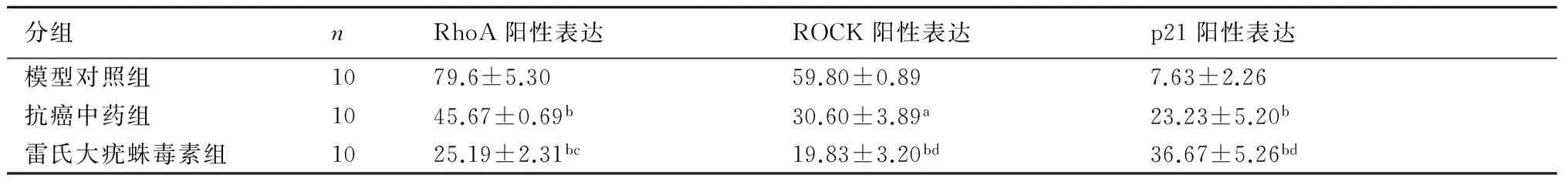
表2 三組小鼠免疫組織化學染色陽性表達比較(%)
本實驗中,抗癌中藥組和雷氏大疣蛛毒素組的RhoA、ROCK蛋白水平表達比模型非干預組明顯減少,提示中藥和雷氏大疣蛛毒素下調了RhoA、ROCK的含量,從而影響了RhoA/ROCK信號通路開放,從而減緩了腫瘤的增殖和轉移。
細胞周期進展涉及多種細胞周期蛋白依賴性激酶(CDK)的連續激活。p21蛋白是目前已知的具有最廣泛激酶抑制活性的細胞周期抑制蛋白。p21可與幾乎每一個Cyclin-CDK復合物結合,廣泛的抑制各種Cyclin-CDK復合物,使細胞停滯在G1期而抑制細胞增殖,還能結合并抑制細胞質中的ROCK活性。p21不同區域對應于不同的靶位,其N端結合并抑制Cyclin-CDK,而C段則結合PCNA,從而覆蓋PCNA的某些功能區,使PCNA不能與DNA聚合酶D形成復合物,或使DNA全酶復合物不能在DNA單鏈上滑動,影響DNA復制。已有研究證明,p21的過表達可使細胞周期阻滯于G1期、G2期或S期[16]。p21與腫瘤的分化、浸潤深度、增生和轉移有關,具有判斷預后的價值[17]。
抗癌中藥與雷氏大疣蛛毒素干預后,p21蛋白表達量較高,尤以雷氏大疣蛛毒素組表達最高。其作用機制可能是抗癌中藥和雷氏大疣蛛毒素提高了p21蛋白的含量,從而抑制了H22腫瘤的增殖。有研究顯示[18]雷氏大疣蛛毒素能抑制人肝癌細胞HepG2增殖的可能機制之一是使p21基因和蛋白表達增加,G2/M細胞周期被阻滯,從而誘導細胞凋亡。本實驗結果表明,抗癌中藥、雷氏大疣蛛毒能有效的抑制小鼠H22肝癌組織的增殖,其中雷氏大疣蛛毒素的抑制作用更為顯著。雷氏大疣蛛毒素中的活性物質可能通過間接維持細胞內p21的含量,從而增強了對腫瘤增殖的抑制作用。
綜上所述,抗癌中藥及雷氏大疣蛛毒素,對小鼠皮下移植的H22肝腫瘤生長和增殖有明顯的抑制作用,尤以后者效果更為顯著。其機制可能是雷氏大疣蛛毒素可能通過調節RhoA/ROCK信號通路中RhoA、ROCK和p21等相關細胞因子的表達,從而抑制了腫瘤的增殖。
[1]Tsai WL,Chung RT.Viral hepatocarcinogenesis[J].Oncogene,2010,29(16):2309-2324.
[2]費瑞,楊洋,張麗嬌,等.蜘蛛毒素的研究概況及應用[J].吉林大學學報:醫學版,2004,30(6):994-996.
[3]張鵬飛,陳平,肖順勇,等.大疣蛛毒素-VI的分離純化及部分生物學活性鑒定[J].生命科學研究,2003,2(6):129-133.
[4]高莉,封巍,單保恩,等.雷氏大疣蛛蛛毒對人肝癌BEL-7402細胞增殖的抑制作用及其機制的研究[J].癌癥,2005,24(7):812-816.
[5]Zeng XZ,Xiao QB,Liang SP.Purification and characterization of raventoxin-I and raventoxin-III,two neurotoxic peptides from the venom of the spider Macrothele raveni[J].Toxicon,2003,41(6):651-656.
[6]胡增祥,杜昱蕾,劉全喜,等.雷氏大疣蛛蜘蛛毒素對人肺癌細胞A549增殖的影響[J].中國肺癌雜志,2010,13(10):933-936.
[7]張麗梅.中藥抗癌作用機制研究概況[J].中國醫藥指南,2009,7(6):73-74.
[8]李彬彬,王瑩,趙金茹,等.小柴胡湯聯合環磷酰胺對腹水瘤細胞株肝癌小鼠腫瘤間質血管生成影響隨機平行對照研究[J].實用中醫內科雜志,2012(5):34-36.
[9]于月成,辛曉燕,吳維光,等.Rho和ROCK蛋白在上皮性卵巢癌中的表達及臨床意義[J].現代腫瘤醫學,2006,14(4):461-464.
[10]王德勝,何勇,孫偉.等.RNAi對肝癌細胞RhoA基因表達和侵襲轉移影響的研究[J].中華腫瘤防治雜志,2011,18(14):1061-1064.
[11]顧穎,韓素萍.RhoA與腫瘤的研究進展[J].國誤診學雜志,2007,7(18):4210-4212.
[13]張曉梅,王波,陳孝平,等.RhoA在肝癌組織中的表達及其臨床意義[J].臨床內科雜志,2006,10(10):674-676.
[14]王德盛,竇科峰,項紅軍,等.RhoA基因在肝細胞肝癌中的表達及其意義[J].中華現代外科學雜志,2005,2(22):1450-1453.
[15]徐艷群,康俊生.Rho/ROCK蛋白與惡性腫瘤發病機制及靶點治療的研究近況[J].實用醫藥雜志,2009,26(4):68-70.
[16]Radhakrishnan SK,Feliciano CS,Najmabadi F,et al.Constitutive expression ofE2F-1 leads to p21-dependent cell cycle arrest in S phase of the cell cycle [J].Oncogene,2004,23 (23):4173-4176.
[17]李作生,李保慶.p21和p27基因多態性與腫瘤的相關性[J].國際遺傳學雜志,2006,29(4):317-320.
[18]高莉,沈金寶,孫捷,等.雷氏大疣蛛毒液對人肝癌HepG2細胞p21基因表達的影響[J].生理學報,2007,59(1):58-62.

