胸部腫瘤調強放療后動態心電圖異常的研究
陳曉婕 覃曉波 張 琴 楊蘇萍 吳 潔
廣西壯族自治區人民醫院心電診斷科,廣西南寧 530021
放射治療是胸部腫瘤患者綜合治療的重要組成部分,由于解剖位置的特殊性,胸部腫瘤放療時,心臟不可避免受到照射, 容易引起放射性心臟損傷(radia tion-induced heart damage,RIHD),而急性RIHD 以心電圖異常最為常見[1],胸部腫瘤患者常規放射治療后出現心電圖異常的報道較多[2-3]。 調強放射治療(intensity modulated radiation therapy,IMRT)是現代放療技術的主流方向,作為三維適形放射治療的高級模式,其目的是最大限度提高靶區劑量的同時減少正常組織受量[4],IMRT 后是否出現動態心電圖(dynamic electrocardiogram,DCG)改變卻鮮有報道,因此本研究通過分析不同時間段、 不同類型腫瘤、 不同治療方法IMRT 前后DCG 異常例數,評估IMRT 對胸部腫瘤患者DCG 的影響, 以期為減少RIHD 的發生及合理制定放射治療計劃提供參考依據。
1 資料與方法
1.1 一般資料
研究對象為2008 年5 月~2013 年8 月在廣西壯族自治區人民醫院(以下簡稱“我院”)臨床腫瘤中心住院的胸部腫瘤患者126 例,其中男69例,女57 例,年齡20~85 歲,平均(53.25±15.89)歲,所有患者均經手術或穿刺病理學檢查證實為惡性腫瘤。按照腫瘤類型分為左肺癌組43 例, 左乳癌組39 例, 食管癌組44例,三組間比較年齡、性別、治療方法差異均無統計學意義 (P > 0.05); 按照治療方法分為單純放療組36例,同步放化組46 例,序貫放化組44 例,三組間比較年齡、 性別、 腫瘤類型差異均無統計學意義 (P >0.05)。 本研究得到患者本人知情同意和醫院倫理委員會批準,并簽署知情同意書。
1.2 方法
患者入院均行胸部CT 平掃加增強掃描檢查,按照AJCC Sixth Eition 2002 分期標準給予胸部腫瘤分期,然后按照NCCN 指南不同分期不同類型腫瘤分別接受單純放療或同步放化療或序貫放療。
1.2.1 單純放療方案 放療給予IMRT。 患者放療前經西門子螺旋CT(sensation open)全胸部4 mm 層厚連續掃描定位,行圖像重建。采用Synergy 型直線加速器及CMS 放射治療計劃系統(XIO)進行計劃設計與治療,按照ICRU50 號和62 號報告規定進行靶區勾畫,腫瘤體積(GTV)為臨床和影像檢查所能確定的腫瘤范圍,包括原發腫瘤(GTV-P)和局部淋巴結(GTV-N,在定位CT 下大于或等于10 mm 判斷為陽性淋巴結)。GTV-P 在腫瘤窗勾畫,GTV-N 在縱膈窗勾畫。臨床靶體積(CTV)為GTV 外放5~8 mm(原發灶鱗癌GTV 外放6 mm,腺癌GTV 外放8 mm 以及縱膈轉移淋巴結GTV 外放5 mm)。 計劃靶體積(PTV)根據擺位誤差和患者呼吸動度決定。 放療劑量50~60 Gy。
1.2.2 同步放化方案 放療同單純放療方案,放療的第1 天同步給予化療(化療方案一般為紫杉醇+鉑類或多西他賽+鉑類,21 d 為1 個周期)。 放療期間完成2 個周期的同步化療。
1.2.3 序貫放化方案 先給予化療 (方案多為紫杉醇+鉑類或多西他賽+鉑類,21 d 為1 個周期),4 個周期后再接受IMRT。
1.3 DCG 檢查
采用美國世紀3000 十二導同步全息24 h DCG記錄儀,分別于治療前、治療結束時、治療結束半年后進行DCG 監測,DCG 診斷標準為黃宛主編的《臨床心電圖學》第6 版。
1.4 統計學方法
采用統計軟件SPSS 15.0 對實驗數據進行分析,計量資料數據以均數±標準差(±s)表示,采用方差分析,行t 檢驗。計數資料以率表示,采用χ2檢驗。以P< 0.05 為差異有統計學意義。
2 結果
2.1 胸部腫瘤治療前、后、治療結束半年后DCG 異常發生率比較
三組間比較偶發房(室)性心律失常、ST-T 改變差異有統計學意義(P < 0.05),兩兩比較治療后組較治療前組偶發房(室)性心律失常、ST-T 改變發生率明顯增加,差異有統計學意義(χ2=6.21,P=0.013;χ2=15.14,P=0.000), 而治療前組與治療結束半年后偶發房(室)性心律失常、ST-T 改變均差異無統計學意義(P > 0.05)。 見表1。
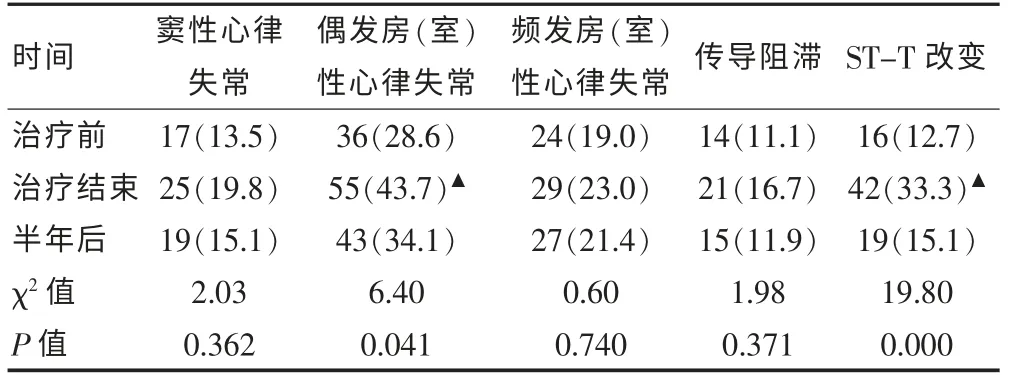
表1 胸部腫瘤治療前、后、半年后DCG 異常發生率[n(%),n=126]
2.2 胸部腫瘤治療前后三種類型腫瘤患者DCG 異常發生例數比較
將三組患者治療前DCG 各項指標比較均差異無統計學意義(P > 0.05),治療后各項指標比較差異亦無統計學意義(P > 0.05)。 見表2。
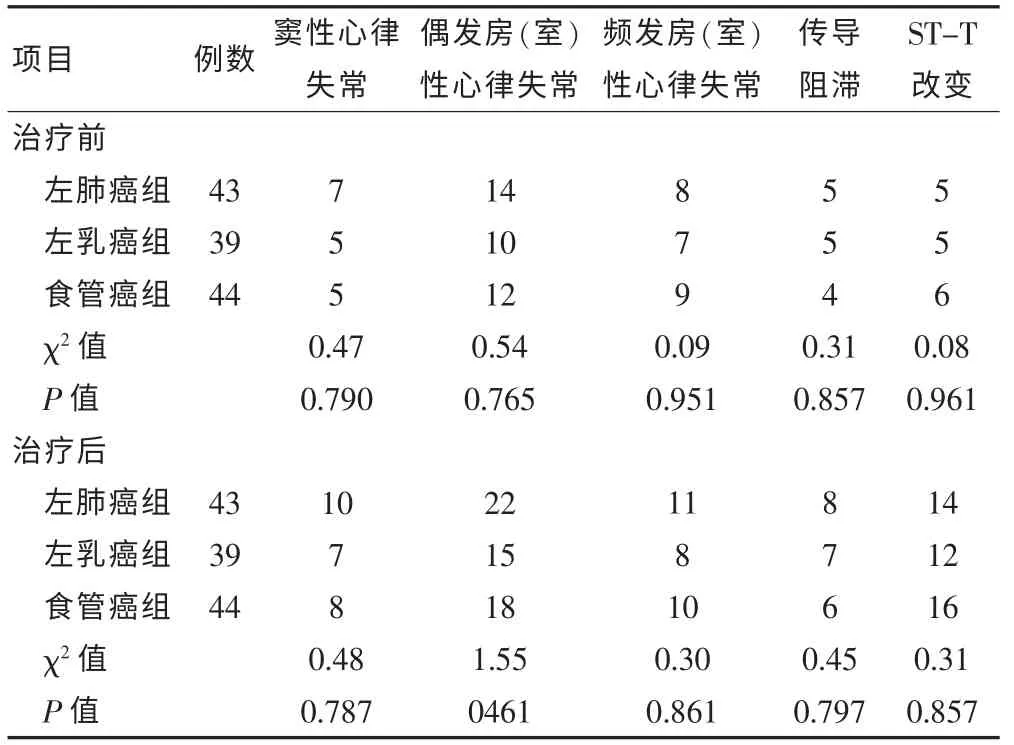
表2 胸部腫瘤治療前后三種類型腫瘤患者DCG 異常發生例數比較(例)
2.3 胸部腫瘤治療前后三種療法患者DCG 異常發生例數比較
將三組患者治療前DCG 各項指標比較差異均無統計學意義(P > 0.05),治療后各項指標比較差異亦無統計學意義(P > 0.05),見表3。
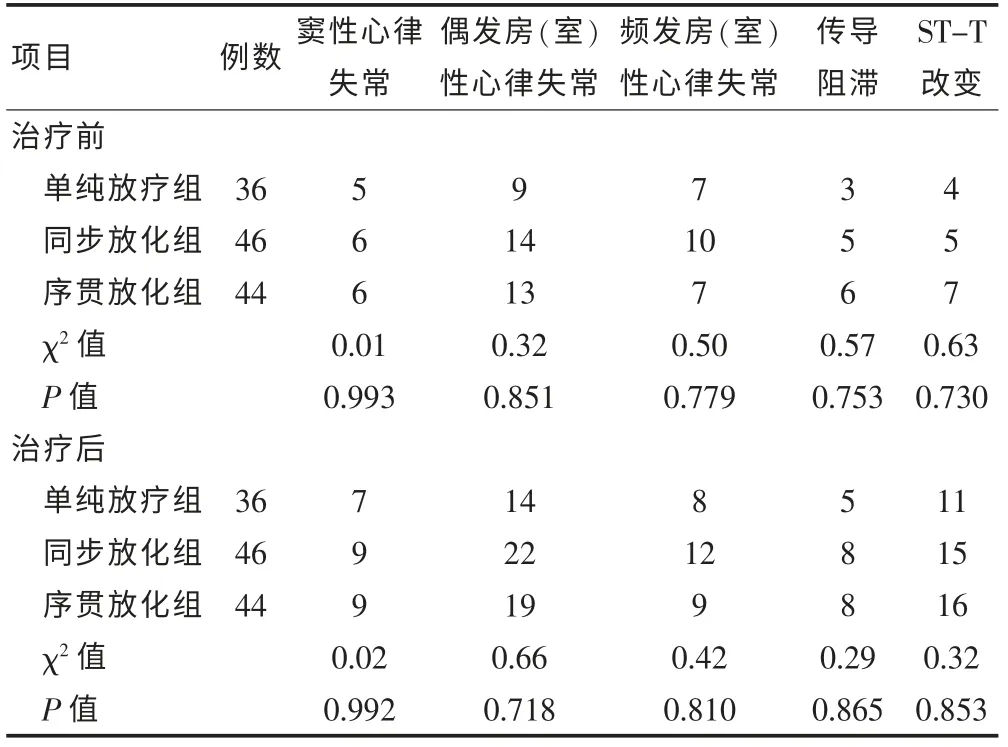
表3 胸部腫瘤治療前后三種療法患者異常發生例數比較(例)
3 討論
心電圖是早期發現心臟傳導系統異常和心肌缺血的敏感方法之一,因此急性RIHD 以心電圖異常最為常見。 RIHD 發生機制是心臟心肌細胞對放射線耐受最強,而微循環系統較弱,因此放射線首先引起心臟毛細血管內皮細胞和冠狀動脈內皮細胞發生損傷、壞死,毛細血管發生破裂和阻塞,導致微循環障礙造成心肌缺血,最終形成心肌纖維化,心臟功能受損[5];其次放射線損傷局部纖溶活性, 纖維蛋白降解受阻,膜通透性增大,導致細胞內環境改變,進而誘導細胞水腫,線粒體腫脹,膜損傷引起離子泵異常,使細胞內鈣離子超載,因而導致心肌損傷。Giraud 等[2]研究表明放療引起的心電圖異常多在2 個月內出現,放療結束半年后,70%的心電圖異常可恢復正常。 梅審之等[6]對接受放療的86 例胸部腫瘤患者進行常規心電圖監測, 發現放療結束后5 個月左右,74%的心電圖異常可恢復正常,其可能原因是:因放療而引發的RIHD,在受照組織細胞“潛在致死損傷”得已修復后,仍可保持其原有的生物特性功能。本研究顯示胸部腫瘤患者偶發房(室)性早搏、ST-T 改變在治療后較治療前明顯增加,差異有統計學意義(P < 0.05),兩者在治療前與治療結束半年后比較, 差異無統計學意義 (P >0.05),說明IMRT 可在治療早期引起DCG 改變,以偶發房(室)性心律失常、ST-T 改變為主,與本課題的前期研究結果相一致[7],但治療結束半年后DCG 改變可基本恢復正常, 提示IMRT 引起的DCG 改變是可逆性的,其對心臟損傷程度相對較輕,與已有研究結果相一致。
本研究將胸部腫瘤患者分為左肺癌,左乳癌和食管癌三組, 將三組患者治療前DCG 各項指標比較均無統計學差異(P > 0.05),治療后各項指標比較亦無統計學差異(P > 0.05),提示不同類型胸部腫瘤患者接受IMRT 后,引起DCG 改變相似,其可能原因是:多數學者認為心臟屬于“串并聯”器官,心臟損傷與受照劑量-體積有關[8-10],IMRT 作為一種精確的放射治療,在使腫瘤靶區接受最大劑量照射的同時,靶區周圍的正常組織受量減少,應用于胸部腫瘤治療后降低了心臟受照體積及劑量,因此左肺癌、左乳癌、食管癌雖然照射部位有所不同,但通過嚴格制定的IMRT 方案,使三組胸部腫瘤心臟受量相當,且多在閾值范圍內,故心臟損傷程度相似,所以DCG 改變相似。
紫杉類化療藥作為目前唯一具有獨特抗微管作用的抗癌新藥,與鉑類聯合起協作增效作用。 Trimble等[11]對1000 例使用紫杉醇患者進行研究,發現心臟毒性發生率14%,多為無癥狀的心動過緩,少數為室性心律失常和傳導阻滯;國內報道[12]紫杉醇心臟毒性作用比較少見,心律失常發生率為2.7%,主要表現為無癥狀性心動過緩,多數發生于用藥期間。 本研究將治療方法分為單純放療、同步放化、序貫放化三組,進行治療后三組患者新增DCG 異常發生率比較, 發現三組間DCG 各項指標比較均無統計學差異 (P >0.05),提示單純放療及放化結合治療對DCG 影響相似,說明本研究采用紫杉醇+鉑類或多西他賽+鉑類化療方案對DCG 影響較小,其心臟毒性相對較低,是較為安全的一線抗癌藥物[13]。
胸部腫瘤患者IMRT 后DCG 多在治療早期出現異常改變,是可逆性的,其對心臟損傷程度較輕[14];不同類型胸部腫瘤, 由于IMRT 的精確性, 其放療后DCG 異常改變相似; 紫杉類+鉑類化療方案對DCG影響較小,其心臟毒性相對較低,是較為安全的抗癌一線藥物。
[1] 王軍,王稀,劉青,等.三維放療急性放射性心臟損傷類型及影響因素分析[J].中華放射腫瘤學雜志,2013,22(3):213-216.
[2] Giraud P,Cosset JM. Radiation toxicity to the heart:physiopathology and clinical data[J].Bull Cancer,2004,91(2):147-153.
[3] Emami B,Lyman J,Brown A,et al.Tolerance of normal tissue to therapeutic irradiation[J].J Radiat Oncol Boil Phys,2009,3(7):1195-1199.
[4] Stewart FA,Seemann I,Hoving S,et al.Understanding Radiation-induced Cardiovascular Damage and Strategies for Intervention[J].Clinical Oncology,2013,25(10):617-624.
[5] FA Stewart.Mechanisms and dose-response relationships for radiation-induced cardiovascular disease[J]. Annals of the ICRP, 2012, 41(3-4):72-79.
[6] 梅審之,劉秋芳,譚麗,等.86 例胸部腫瘤放射治療心電圖改變[J].現代腫瘤醫學,2005,13(3):410-411.
[7] 楊蘇萍,張琴,蒿艷蓉,等.胸部腫瘤放化療致心電學指標改變的研究[J].重慶醫學,2012,41(3):233-237.
[8] Adams M,Lipshultz SE,Schwartz C,et al. Radiation associated cardiovascular disease:Manifestatons and management [J]. Sem in Radiat Oncol,2003,13(3):346-356.
[9] Lauren MT,Joshua EM,Erin McSpadden,et al.Women at increased risk for cardiac toxicity following chemoradiation therapy for esophageal carcinoma[J].Practical Radiation Oncology,2013,3(4):149-155.
[10] Stewart FA,Seemann I,Hoving S,et al.Understanding Radiation- induced Cardiovascular Damage and Strategies for Intervention[J].Clinical Oncology,2013,25(10):617-624.
[11] Trimble EL,Adams JD,Vena D,et al. Paclitaxel for platinum refractory ovarian cancer:results from the first 1,000 patients registered to National Cancer Institute Treatment Referral Center 9103[J].J Clin Oncol,1993,11(12):2405.
[12] 楊興艷,薛月珍.紫杉醇心臟毒性研究進展[J].醫藥導報,2009,28(8):1064-1067.
[13] 朱琳琳,陳紹良,張娟,等.雷帕霉素和紫杉醇對骨髓內皮祖細胞數量及功能的影響[J].中國臨床醫學,2012,19(5):459-461.
[14] 田雅文,余德美,劉政,等.無痛纖支鏡治療空洞型肺結核的臨床護理[J].西部中醫藥,2012,25(10):112-114.

