微波處理淀粉 自由基的生長和衰減
劉意驍,范大明,*,王麗云,連惠章,趙建新,張 灝,陳 衛
(1.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.無錫華順民生食品有限公司,江蘇 無錫 214218)
微波處理淀粉 自由基的生長和衰減
劉意驍1,范大明1,*,王麗云1,連惠章2,趙建新1,張 灝1,陳 衛1
(1.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇 無錫 214122;2.無錫華順民生食品有限公司,江蘇 無錫 214218)
研究在微波加熱方式下大米淀粉自由基的生長以及儲存過程中的衰減。運用電子順磁共振的檢測手段和圖譜擬合軟件,對微波處理淀粉的自由基相對數量和結構進行分析。結果表明:微波處理淀粉產生在室溫下能夠較長時間存在的自由基;淀粉在微波處理后會產生以碳為中心的自由基;在1 600 W(160 W/g)功率下自由基數量的增長速率大于800 W(80 W/g)功率下的增長;在停止微波處理后,自由基信號在衰減之前有一段短時間的增長期;實驗從微波處理淀粉中分離出3 種自由基成分,主要成分為以葡萄糖環C1為中心的自由基。
微波;淀粉;自由基;電子順磁共振
微波作為一種新型加熱技術,已經普及至日常家用和工業應用的方方面面。由于其操作簡便快速,微波在食品加工處理上的應用十分廣泛,例如食品解凍、干燥、焙烤、滅酶及殺菌等。淀粉是大部分加工食品的主要成分之一。研究發現,在一定強度的能量場中,淀粉受激發會產生自由基,接受能量的大小和時間長短會影響自由基的生成。例如高溫加熱[1-4]、X射線[5]、γ射線[6]、紫外輻射[7]等,均能夠引發淀粉自由基。眾所周知,微波通過電磁場傳遞能量對受加工的食品產生作用,據以往的研究[8]得知微波照射處理也能引發淀粉中的自由基反應。
自由基反應可能會產生一類半衰期極短的自由基和一類長半衰期的自由基,半衰期短的自由基對生物細胞會造成損傷,導致疾病的發生,而大分子碳水化合物中半衰期長的自由基可以作為自由基捕獲物而中和有害的高反應活性的自由基[9-10]。自由基與淀粉化學反應具有一定的關聯,例如淀粉熱降解導致分子內或分子間脫水造成的自由基反應,會產生呋喃、小分子醛酮物質以及CO2、CO、H2O氣體等[11]。因而解讀微波處理對淀粉產生自由基的作用和以及自由基在儲藏過程中的衰減特性對微波食品的安全性研究具有一定意義,對控制微波食品品質和風味等具有重要影響。
目前已經有不少關于微波淀粉的研究,例如淀粉顆粒性質、流變和溶脹特性[8-9]以及淀粉的熱力學和介電物理學特性[10]等。這些證據都表明微波輻射會不可避免地對淀粉顆粒甚至分子結構造成改變。然而,國內外有關微波場中大米淀粉產生自由基的生長及衰減變化的研究還鮮有報道。
本研究主要探究在民用微波頻率(2 450 MHz)下,低水分活度大米淀粉的自由基生成規律以及淀粉自由基在室溫儲存時的衰減變化規律。本實驗使用電子順磁共振儀來檢測自由基的種類、組成成分和相對數量;通過軟件擬合分析,得到淀粉自由基的分子結構信息,從而推測出淀粉自由基在生長和衰減過程中的成分變化規律。
1 材料與方法
1.1 材料與試劑
大米淀粉 江西金農生物科技有限公司。
K2SO4國藥集團化學試劑有限公司。
1.2 儀器與設備
XO-SM400超聲微波組合反應系統 南京先歐儀器制造有限公司;EMX-8/2.7型電子順磁共振儀 德國Bruker公司;FA-st lab水分活度儀 法國GBX公司。
1.3 方法
1.3.1 大米淀粉水分調節
為調節淀粉的水分活度,將大米淀粉裝入敞口燒杯中,置于下方裝有K2SO4飽和溶液的帶孔陶瓷隔板上密閉平衡2 周。淀粉水分活度采用GBX FA-st lab水分活度儀測定。
1.3.2 微波處理大米淀粉的制備
將大米淀粉2.0 g均勻鋪于內徑6 mm的敞口玻璃培養皿內,平均厚度為1.5 mm。微波處理時將5個培養皿圍圈放置在微波腔體中間,在頻率2 450 MHz下,分別用功率1 600 W(160 W/g)和800 W(80 W/g)條件下處理1~5 min。微波結束,將5 個培養皿中淀粉樣品混合均勻,立即測定或儲存一定時間測定自由基信號。樣品的儲存條件為室溫(20 ℃左右)避光保存。
1.3.3 自由基的順磁共振測定
準確稱取(60.0±0.5)mg樣品于內徑3 mm的核磁樣品管內,樣品管置于諧振腔。儀器的微波頻率為9.85 GHz,調試頻率為100 kHz。圖譜在室溫20 ℃條件下測定,中心磁場為351 mT,掃場寬度為10 mT,調制幅度(MA)為0.6 T,增益為3.17×105,微波功率設定為20 mW。g值采用比較法測定。將已知g值的標準樣品(Bruker公司的Mark,g=1.980 0)與待測樣品分別置于諧振腔中,記錄圖譜,通過與Mark比較得到樣品g值。則待測樣品的g值可由下式求得。
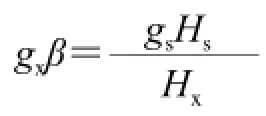
式中:下標s、x分別表示標準樣品和待測樣品;β為玻爾磁子。
信號強度大小為電子順磁共振(electron paramagnetic resonance,EPR)譜線一次導數的峰高差。EPR信號模擬使用的是基于Matlab R2013a(The MathWorks,Inc.)平臺的EasySpin 4.5.3自由基處理軟件[15-18]。軟件所得的g值誤差為±0.005,超精細常數A誤差為±0.1 mT。
2 結果與分析
2.1 微波加熱淀粉自由基成分分析

圖1 大米淀粉的EPR譜線(Exp)和信號擬合譜線(Sim)Fig.1 EPR spectrum (Exp) and simulated spectrum (Sim) of rice starch
大米淀粉的EPR圖譜不出現明顯的信號峰。微波處理后產生的淀粉自由基信號見圖1B。將本實驗中得到的淀粉自由基圖譜與?abanowska等[9-10]得到的熱致自由基圖譜比較,譜線峰型相似,而通過比較法與順磁共振儀中所帶的標準樣品Mark的g值計算得到的樣品自由基信號g值是典型的淀粉碳自由基的g值,因此可以判定本研究中微波處理淀粉產生的自由基是碳為中心的自由基,這與Dyrek等[8]采用微波處理馬鈴薯淀粉及玉米淀粉的實驗結果也相符。

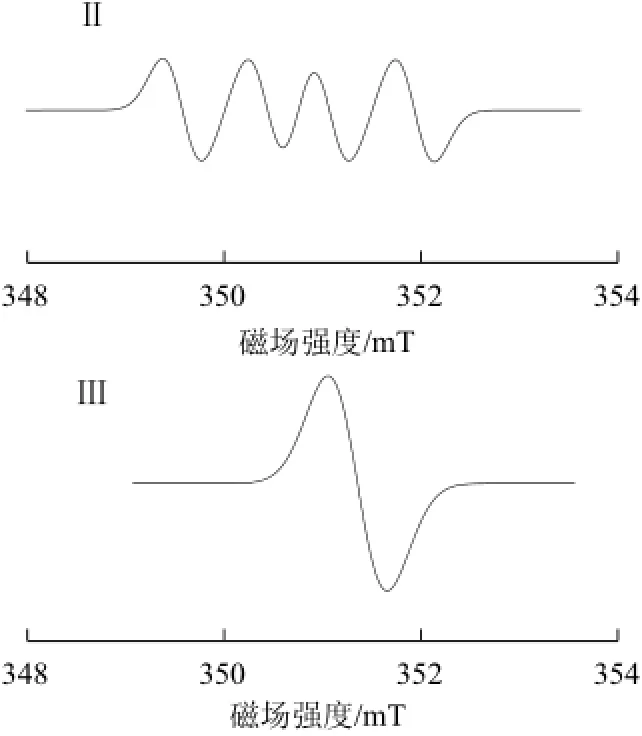
圖2 大米淀粉自由基信號主要成分Fig.2 Main components of rice starch radical signals
從微波處理后大米淀粉的EPR圖譜(圖1)中可以看出,淀粉中的自由基顯然不是單一組分,而是多種成分疊加而成的組合譜。通過信號模擬處理,分析出其中存在的3 種主要成分。由圖2可知,信號Ⅰ是葡萄糖環C1位置上的α氫脫去后形成的自由基。位于C2上β氫原子對于C1上的自由電子產生了裂分作用,形成二重峰形態的信號Ⅰ。然而由于裂分常數小,表觀上信號Ⅰ仍然呈現一重峰形態。信號Ⅱ表現為具有四重峰形態的超精細結構(hyperfine structure,HFS)譜線,該成分是由葡萄糖環側鏈C6位的自由基構成的。C6脫去一個α氫之后形成自由基,由另一個α氫和C5上的β氫分別對C6上的自由電子產生作用,導致HFS結構的產生。信號Ⅲ形成的原因為C2位置上的H原子和C3位置上的OH基團發生分子內脫水,形成的雙鍵使得成分Ⅰ中的電子能夠離域到π鍵上。因此成分Ⅲ的增加一般是伴隨著成分Ⅰ的減少[9-10]。
2.2 微波加熱時間對淀粉自由基增長的影響

圖3 微波加熱時間對淀粉自由基增長的影響Fig.3 Influence of microwave heating time on the growth of starch radicals
以水分活度0.7的大米淀粉樣品分別在微波1 600、800 W功率下處理1~5 min的順磁共振信號變化情況為例,說明自由基在電磁場中隨時間演變的趨勢。由圖 3可知,在淀粉接受微波輻射1~2 min時,信號幾乎無增長,表明淀粉中沒有穩定的自由基產生。這有可能是源于體系還未能將電磁能量轉化為足夠的熱能和化學能激發自由基反應,或者是因為體系中的水分將產生的自由基淬滅了。在輻射的起始階段,考慮到水分的存在,樣品具有較大的介電常數,能夠有效地將電磁場的能量轉換為熱量[14],因而樣品迅速升溫。微波處理3 min后,該樣品的自由基信號中僅存在信號Ⅰ和Ⅱ,分別為87%和13%,證明此時自由基的成分以淀粉分子內葡萄糖環C1位置脫氫產物為主,另外還有一部分為側鏈C6位置脫氫產生的自由基。在微波輻射的第2~4分鐘,自由基增長迅速,可能是多重因素導致的鏈式效應。隨著溫度升高,分子活躍度提高,更容易被熱和其他來源的能量所激發。在處理至4 min時,信號中出現了第3種成分,這是由于淀粉分子吸收能量后,葡萄糖環C2上的氫與C3上的羥基發生脫水,形成C=C鍵,因而C1上未成對電子不再受到C2上H原子的裂分作用,而分子中氧原子的減少和雙鍵形成使其自由基的g值相對于成分Ⅰ來說降低了。在微波輻射處理的第5分鐘,水分活度降至0.05,此時信號Ⅲ的比例顯著提高,從2%升至4%,而此時C6自由基的比例降至9%左右,說明C1位置的脫氫速度略大于C6的脫氫速度,并且信號Ⅰ中有一部分向信號Ⅲ轉化,暗示了C2~C3之間雙鍵的產生。與此同時,在淀粉基質中已經存在大量的自由基,使自由基電子之間的偶極-偶極相互作用增強,導致部分信號展寬,可能導致在第4~5 分鐘時自由基表觀增長減緩。

表1 微波淀粉EPR自由基信號參數的擬合結果Table1 EPR simulation results of starch radicals after microwave treattmmeenntt
而對于800 W功率下處理的大米淀粉,在起始階段的2 min內幾乎檢測不到自由基的增長。而在2 min之后,自由基的增長趨勢大致與1 600 W相似,但是增速明顯慢于1 600 W功率下的自由基增速。4 min后在800 W條件下處理的淀粉自由基數量與1 600 W條件下處理的淀粉自由基數量之差趨于恒定。由表1可知,800 W功率處理的自由基其擬合結果幾乎差別,其組成成分含量相同,分別為92%的C1自由基和8%的C6自由基。
2.3 儲存時間對微波處理淀粉自由基衰減的影響
為了研究微波處理得到的淀粉自由基在儲藏過程中的衰減特性,將微波1 600 W和800 W處理5 min后的淀粉樣品室溫避光保存0~120 d后,分別進行順磁共振檢測。隨著儲藏時間延長,在淀粉基質中大量存在的自由基之間的偶極-偶極相互作用逐漸減弱,使得原先未被檢測到的自由基信號出現,表現為在最初的1 d內,自由基的信號強度逐漸增大,由于本身1 600 W處理后的淀粉中自由基含量明顯多于800 W處理后的淀粉,因此這種自由基延遲增長的效應在1 600 W處理后的淀粉中表現得更為顯著(圖4)。而在第1~5天后,自由基增長趨勢消失并開始緩慢衰減,1 600 W條件下處理的自由基數量在3 周內降至與微波處理結束時的數量;800 W條件下處理的自由基數量則在9 d左右時降至與微波處理結束時的數量。在第16周時測定的1 600 W處理樣品儲存后的自由基含量仍然大于800 W處理后樣品自由基最大值。

圖4 儲存時間對微波處理淀粉自由基的影響Fig.4 Influence of storage time on microwave-treated starch radicals
進一步對衰減過程中自由基組成的分析發現,1 600 W處理后的大米淀粉在保存過程中成分Ⅲ在5 d內逐漸減少至消失。這與微波處理過程中成分Ⅲ的生成過程正好相反。推測這種現象產生的原因是,在儲存過程中,原本葡萄糖分子內部脫水形成的C2=C3鍵逐漸吸收了環境中的水分,雙鍵被還原,成分Ⅲ逐漸轉化為成分Ⅰ的自由基形式。說明含有雙鍵的自由基成分在儲存時較不穩定,而葡萄糖環的C1自由基以及側鏈的C6自由基相對較穩定。800 W處理后的大米淀粉無論在自由基增長階段還是衰減階段,其組成成分均沒有大的變化,依然是以成分Ⅰ為主,占到自由基總量的90%以上,同時含有部分側鏈的自由基成分Ⅱ。
3 結 論
本研究通過對微波處理大米淀粉的自由基檢測研究,驗證了微波處理淀粉能產生長時間存在室溫下存在的穩定自由基。確定了大米淀粉自由基是以碳為中心的自由基。大米淀粉自由基的3 種組成成分結構。得出了不同微波功率下自由基數量隨著時間逐漸增長至差值穩定的趨勢。通過儲存實驗發現,淀粉基質中自由基的偶極-偶極作用減弱會導致在儲存前期信號有增長,儲存中后期信號減弱,自由基成分有變化。在本實驗中討論的自由基均為半衰期相對較長的穩定自由基,未涉及短半衰期的自由基。因其性質活潑,在數秒內即被反應淬滅,所以很難檢測到。在今后的研究中,本課題組可以探索合適的捕集手段,將活性自由基半衰期延長進而檢測其數量及成分,對于完善微波處理淀粉產生自由基的生長和衰減的研究具有重要意義。
[1] CIESIELSKI W, TOMASIK P. Starch radicals. Part I. Thermolysis of plain starch[J]. Carbohydrate Polymers, 1996, 31(4): 205-210.
[2] CIESIELSKI W, ACHREMOWICZ B, TOMASIK P, et al. Starch radicals. Part II: cereals-native starch complexes[J]. Carbohydrate Polymers, 1997, 34(4): 303-308.
[3] CIESIELSKI W, TOMASIK P. Starch radicals Part III: semiartifi cial complexes[J]. Zeitschrift für Lebensmittel-Untersuchung und-Forschung A, 1998, 207(4): 292-298.
[4] CIESIELSKI W, TOMASIK P, BACZKOWICZ M. Starch radicals Part IV: thermoanalytical studies[J]. Zeitschrift für Lebensmittel-Untersuchung und -Forschung A, 1998, 207(4): 299-303.
[5] TOMASIK P, MICHALSKI O, BIDZINSKA E, et al. Radioprotective thermally generated free-radical dextrins[J]. Chinese Science Bulletin, 2008, 53(7): 984-991.
[6] ADAMIC K, ZAGRC B. ESR study of free radical transformation in gamma-irradiated starch[J]. Starch/St?rke, 1968, 20(1): 3-5.
[7] KAMEYA H, NAKAMURA H, UKAI M, et al. Electron spin resonance spectroscopy of gamma-irradiated glucose polymers[J]. Applied Magnetic Resonance, 2011, 40(3): 395-404.
[8] DYREK K, BIDZINSKA E, ?ABANOWSKA M, et al. EPR study of radicals generated in starch by microwaves or by conventional heating[J]. Starch/St?rke, 2007, 59(7): 318-325.
[9] ?ABANOWSKA M, WESE?UCHA-BIRCZYNSKA A, KURDZIEL M, et al. The mechanism of thermal activated radical formation in potato starch studied by electron paramagnetic resonance and Raman spectroscopies[J]. Carbohydrate Polymers, 2013a, 91(1): 339-347.
[10] ?ABANOWSKA M, WESE?UCHA-BIRCZYNSKA A, KURDZIEL M, et al. Thermal effects on the structure[J]. Carbohydrate Polymers, 2013b, 92(1): 842-848.
[11] 劉興訓. 淀粉及淀粉基材料的熱降解性能研究[D]. 廣州: 華南理工大學, 2011.
[12] MUZIMBARANDA C, TOMASIK P. Microwaves in physical and chemical modifications of starch[J]. Starch/St?rke, 1994, 46(12): 469-474.
[13] ZYLEMA B J, GRIDER J A, GORDON J, et al. Model wheat starch systems heated by microwave irradiation and conduction with equalized heating times[J]. Cereal Chemistry, 1985, 62(6): 447-453.
[14] NDIFE M K, SUMNU G, BAYINDIRLI L. Dielectric properties of six different species of starch at 2450 MHz[J]. Food Research International, 1998, 31(1): 43-52.
[15] STOLL S, SCHWEIGER A. Easyspin, a comprehensive software package for spectral simulation and analysis in EPR[J]. Journal of Magnetic Resonance, 2006, 178(1): 42-55.
[16] STOLL S, SCHWEIGER A. EasySpin: simulating cw ESR spectra[J]. Biological Magnetic Resonance, 2007, 27: 299-321.
[17] STOLL S, BRITT R D. General and efficient simulation of pulse EPR spectra[J]. Physical Chemistry Chemical Physics, 2009, 11: 6614-6625.
[18] STOLL S. EPR simulations with EasySpin[R]. Rehovot: University of Washington, 2013.
Growth and Annihilation of Microwave-Induced Free Radicals in Rice Starch
LIU Yi-xiao1, FAN Da-ming1,*, WANG Li-yun1, LIAN Hui-zhang2, ZHAO Jian-xin1, ZHANG Hao1, CHEN Wei1
(1. State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 2. Wuxi Huashun Minsheng Food Co. Ltd., Wuxi 214218, China)
In this article, the growth of microwave-induced free radicals in rice starch and their annihilation process during storage were investigated. Electron paramagnetic resonance (EPR) and signal simulation software were applied to investigate the relative quantity and structure of micr owave-treated starch radicals. The results showed that microwave treatment could induce starch radicals which could exist for a long time at room temperature. The starch radicals were carbon-centered radicals. The growth of radicals was much faster when rice starch was treated at 1 600 W (160 W/g) than at 800 W (80 W/g). After microwave treatment, the signal intensity started to drop after a short period of increase. Three components were separated from microwave-induced starch radicals in the experiment. The main component was the radical located at the C1 position of the glucose ring.
microwave; starch; radical; electron paramagnetic resonance (EPR)
TS234
A
1002-6630(2014)13-0114-04
10.7506/spkx1002-6630-201413021
2014-03-26
江蘇省自然科學基金青年科學基金項目(BK20130141);國家自然科學基金青年科學基金項目 (31301504);高等學校博士學科點專項科研基金新教師類項目(20130093120011)
劉意驍(1990—),女,碩士研究生,研究方向為食品加工及生物技術。E-mail:yixiaoliu7@126.com
*通信作者:范大明(1983—),男,副教授,博士,研究方向為食品加工及生物技術。E-mail:fandm@jiangnan.edu.cn

