創(chuàng)新高校電教事業(yè)發(fā)展實(shí)踐
管恩京 鄭海峰
【摘要】高校電教事業(yè)發(fā)展的主要問(wèn)題是“亂”:職能亂、名稱亂、機(jī)構(gòu)設(shè)置亂、人員亂。山東理工大學(xué)在回顧近十年發(fā)展歷史的基礎(chǔ)上,大膽創(chuàng)新,提出了“一個(gè)中心、兩條主線、三個(gè)平臺(tái)、四個(gè)依靠”的改革思路,同時(shí)闡述了在改革實(shí)踐中遇到的問(wèn)題和不足。
【關(guān)鍵詞】電教;高校;發(fā)展
【中圖分類號(hào)】G40-057 【文獻(xiàn)標(biāo)識(shí)碼】A 【論文編號(hào)】1009—8097 (2009) 02—0137—03
從上世紀(jì)末到本世紀(jì)初,以計(jì)算機(jī)、網(wǎng)絡(luò)、教學(xué)軟件等成為主要電教媒體為標(biāo)志,高校電教事業(yè)的發(fā)展就進(jìn)入動(dòng)蕩的年代。總結(jié)近十年來(lái)高校電教事業(yè)發(fā)展特點(diǎn),可以用一個(gè)“亂”字代表:職能亂、名稱亂、機(jī)構(gòu)設(shè)置亂、人員亂。
由新媒體、新技術(shù)、新的教育技術(shù)理念催生的動(dòng)蕩過(guò)程,同時(shí)也掀起了高校電教事業(yè)改革與發(fā)展的浪潮。在這個(gè)浪潮中,進(jìn)行了創(chuàng)新性的改革,且改革得好,事業(yè)就能發(fā)展壯大;沒(méi)有改革或改革得不好,事業(yè)就會(huì)沒(méi)落,沒(méi)落的結(jié)果有兩個(gè),或者被學(xué)校取消,或者被其它部門吞并。山東理工大學(xué)同樣在改革的浪潮中沉浮不定、歷經(jīng)考驗(yàn),作為高校電教事業(yè)的一個(gè)個(gè)案或者是縮影,見(jiàn)證這段發(fā)展的歷史。
一 回顧歷史,總結(jié)近十年電教事業(yè)發(fā)展中的主要問(wèn)題
同諸多高校一樣,山東理工大學(xué)電教事業(yè)起步于上世紀(jì)80年代,電視、錄音、幻燈片等是其主要電教媒體。1998年,以學(xué)校建設(shè)16套多媒體教室為標(biāo)志,電教事業(yè)的改革開始。以下為我校電教事業(yè)的組織機(jī)構(gòu)、名稱、職能等的發(fā)展史。
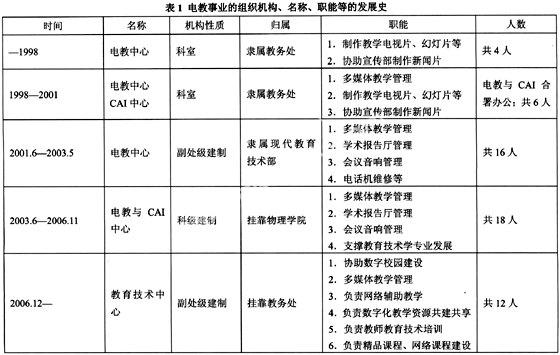
由此表可以看出高校電教事業(yè)近十年的發(fā)展比較混亂。首先,職能亂。電教職能涉及到教學(xué)、教輔、電視廣播、新聞宣傳、會(huì)議報(bào)告,甚至還涉及到電話機(jī)等設(shè)備維修。其次,名稱亂。負(fù)責(zé)電教事業(yè)的部門近幾年衍生了很多名稱,除了保留電教中心名稱的,還有現(xiàn)代教育技術(shù)部、教育技術(shù)中心、CAI中心、電教室、多媒體中心、現(xiàn)代教育中心等名稱。再者,機(jī)構(gòu)設(shè)置亂。電教部門除了獨(dú)立建制外,還有掛靠或者隸屬其它處室的,如教務(wù)處、現(xiàn)教部、實(shí)驗(yàn)設(shè)備處、宣傳部、后勤處等,甚至還有掛靠或者隸屬教學(xué)單位的,如物理學(xué)院、傳播學(xué)院、基礎(chǔ)教學(xué)部等。最后,人員亂。由于沒(méi)有進(jìn)入學(xué)校的主流地位,電教部門往往成為行政裁員、人才家屬的“收容所”,人員多而復(fù)雜,整體學(xué)歷不高,專業(yè)基礎(chǔ)雜。
二 堅(jiān)持創(chuàng)新,開拓電教事業(yè)發(fā)展的新局面
無(wú)數(shù)改革實(shí)踐證明,創(chuàng)新是工作、事業(yè)的靈魂;同樣只有堅(jiān)持創(chuàng)新,高校電教事業(yè)才能達(dá)到更高的境界[1]。2001年至2006年,這5年是我校電教事業(yè)發(fā)展的低谷,隨著2006年教育技術(shù)中心的更名及改制成功,電教事業(yè)才有了起色。近兩年來(lái),教育技術(shù)中心積極開展教育技術(shù)研究,把握信息化發(fā)展趨勢(shì),緊密結(jié)合教學(xué)工作,堅(jiān)持創(chuàng)新,打開了電教事業(yè)發(fā)展的新局面。發(fā)展的思路可以總結(jié)為“一個(gè)中心、兩條主線、三個(gè)平臺(tái)、四個(gè)依靠”。
1 一個(gè)中心:堅(jiān)持以教學(xué)工作為中心
教學(xué)工作是一所高校的核心任務(wù);一個(gè)部門離核心任務(wù)越近,工作性質(zhì)就越重要,對(duì)事業(yè)發(fā)展就越有利。山東理工大學(xué)電教人幾經(jīng)努力,到2006年末,終于把與教學(xué)無(wú)關(guān)或者關(guān)系很小的職能剝離出去,如把電視新聞業(yè)務(wù)交給宣傳部,把學(xué)術(shù)報(bào)告廳和會(huì)議音響交給后勤處,把電話機(jī)維修交給設(shè)備處等,同時(shí)更名為教育技術(shù)中心,副處級(jí)建制,掛靠教務(wù)處,人、財(cái)、物保持相對(duì)獨(dú)立,業(yè)務(wù)上接受教務(wù)處指導(dǎo)。如表1所示,目前教育技術(shù)中心的主要業(yè)務(wù)職能,如改革多媒體教學(xué),使其真正發(fā)揮多媒體教學(xué)的優(yōu)勢(shì);加大網(wǎng)絡(luò)學(xué)堂與網(wǎng)絡(luò)教學(xué)資源投入,形成立體化教學(xué)模式等,都是緊緊圍繞教學(xué)中心開展工作,通過(guò)提高教學(xué)信息化水平,提高教學(xué)質(zhì)量。
2 兩條主線:堅(jiān)持軟件建設(shè)與硬件建設(shè)同步發(fā)展
無(wú)論傳統(tǒng)電教還是現(xiàn)代教育技術(shù),教學(xué)信息化建設(shè)很容易“瘸腿”走路,不是偏硬就是偏軟,當(dāng)然“重硬輕軟”的現(xiàn)象更多一些。近幾年,我們持續(xù)加強(qiáng)多媒體硬件建設(shè),每年更新和增加一定的多媒體和網(wǎng)絡(luò)設(shè)備,為學(xué)生學(xué)習(xí)、教師教學(xué)創(chuàng)造有利的環(huán)境。同時(shí),加大軟件建設(shè)力度,如立足多媒體教學(xué)平臺(tái),建成了教學(xué)質(zhì)量遠(yuǎn)程監(jiān)控系統(tǒng);立足數(shù)字化教學(xué),建成了網(wǎng)絡(luò)學(xué)堂和教學(xué)資源庫(kù),推行學(xué)生自主學(xué)習(xí)模式,拓寬學(xué)生與教師交流的途徑;立足優(yōu)質(zhì)教學(xué)資源,建成精品課程管理系統(tǒng),推進(jìn)優(yōu)質(zhì)教學(xué)資源的共建共享等。
3 三個(gè)平臺(tái):搭建多媒體教學(xué)綜合服務(wù)平臺(tái)、網(wǎng)絡(luò)教學(xué)綜合服務(wù)平臺(tái)與數(shù)字化教學(xué)資源服務(wù)平臺(tái)
(1)搭建多媒體教學(xué)綜合服務(wù)平臺(tái),促進(jìn)教學(xué)手段改革。
山東理工大學(xué)從1998年就開始了多媒體教室的建設(shè),截至目前,我校共有多媒體教室217個(gè),其中,公共教學(xué)樓已全部建成多媒體教室。我校教師對(duì)開展多媒體教學(xué)的積極性非常高,全校95%以上的老師使用過(guò)多媒體設(shè)備,多媒體教室使用率達(dá)到了85%以上。2007年,我校又在傳統(tǒng)、單機(jī)多媒體教室的基礎(chǔ)上,建成了網(wǎng)絡(luò)化中央控制系統(tǒng)。該系統(tǒng)不僅實(shí)現(xiàn)了多媒體設(shè)施遠(yuǎn)程管理與控制,而且具備課程直播、精品課程錄播、微格教學(xué)以及教學(xué)質(zhì)量遠(yuǎn)程監(jiān)控等功能。實(shí)踐證明,多媒體教學(xué)綜合服務(wù)平臺(tái)在教學(xué)條件建設(shè)、教學(xué)手段改革、教學(xué)資源制作、教學(xué)信息反饋和教學(xué)質(zhì)量控制等方面發(fā)揮了重要作用。
(2)搭建網(wǎng)絡(luò)教學(xué)綜合服務(wù)平臺(tái),形成立體化教學(xué)模式。
教學(xué)信息化、學(xué)習(xí)信息化是學(xué)校信息化建設(shè)的重要內(nèi)容。2003年,我們成功搭建了網(wǎng)絡(luò)教學(xué)綜合服務(wù)平臺(tái)。教師可以利用該平臺(tái)發(fā)布教學(xué)大綱、教師信息、課程通知;可以共享教學(xué)講義與個(gè)人教學(xué)資源以及布置作業(yè)、進(jìn)行網(wǎng)上測(cè)驗(yàn)等。同樣,學(xué)生可以通過(guò)該平臺(tái)獲取教師提供的教學(xué)信息,參與網(wǎng)上作業(yè)、測(cè)驗(yàn)以及問(wèn)卷調(diào)查等活動(dòng)。并且,師生可以在平臺(tái)上開展討論、在線輔導(dǎo)與答疑等交流。目前,平臺(tái)上共注冊(cè)教師用戶2100余人,學(xué)生用戶3萬(wàn)余人,本學(xué)期共202門課程在平臺(tái)上開課。實(shí)踐證明,網(wǎng)絡(luò)教學(xué)綜合服務(wù)平臺(tái),對(duì)輔助課堂教學(xué)起到了較好的教學(xué)效果,逐步形成了第一課堂、第二課堂和網(wǎng)絡(luò)課堂相輔相成的立體化教學(xué)模式。
(3)搭建數(shù)字化教學(xué)資源服務(wù)平臺(tái),實(shí)現(xiàn)優(yōu)質(zhì)資源的共建共享。
網(wǎng)絡(luò)教學(xué)平臺(tái)只是信息傳播的載體,信息資源的汲取和共享才是人們使用網(wǎng)絡(luò)的目的所在。要發(fā)揮網(wǎng)絡(luò)教育輔助于傳統(tǒng)課堂教學(xué)的優(yōu)勢(shì),就必須有豐富的教學(xué)信息資源支持。2005年,成功搭建數(shù)字化教學(xué)資源服務(wù)平臺(tái),主要提供以下四個(gè)方面的服務(wù)。
① 精品課程管理:積極響應(yīng)教育部關(guān)于精品課程建設(shè)的舉措,制定了“校—省—國(guó)家”三級(jí)精品課程建設(shè)方案[2]。目前,三級(jí)精品課程的申報(bào)、共享與日常管理都由該平臺(tái)提供技術(shù)服務(wù)與網(wǎng)絡(luò)共享服務(wù)。
② 網(wǎng)絡(luò)課程建設(shè):自2004年開始,累計(jì)投入40萬(wàn)元,采取引進(jìn)與自主開發(fā)相結(jié)合的辦法,加快豐富網(wǎng)絡(luò)課程庫(kù)。截至目前,共引進(jìn)包括麻省理工學(xué)院OPW開放課程在內(nèi)的各種網(wǎng)絡(luò)課程2097門;同時(shí)以教學(xué)研究立項(xiàng)的形式,自主開發(fā)與制作網(wǎng)絡(luò)課程300門。
③ 數(shù)字化教學(xué)素材建設(shè):同樣,通過(guò)購(gòu)買、搜集和自主制作等形式,不斷豐富數(shù)字化教學(xué)素材庫(kù)。目前,資源庫(kù)內(nèi)共收集和整理視頻素材321條,音頻素材1182條,圖形圖像13418幅,動(dòng)畫1014條,文本1255條。
④ 優(yōu)秀教學(xué)軟件建設(shè):自2006年開始,每年舉辦一次優(yōu)秀教學(xué)軟件評(píng)比。一大批應(yīng)用于教學(xué),且由老師自制的優(yōu)秀課件、工具軟件、應(yīng)用軟件、課程網(wǎng)站等脫穎而出,不但豐富了數(shù)字化教學(xué)資源服務(wù)平臺(tái)的內(nèi)容,同時(shí)提高了教師之間信息、技術(shù)等交流與合作的能力。
4 四個(gè)依靠:依靠制度、項(xiàng)目、績(jī)效、市場(chǎng)四個(gè)方面,加強(qiáng)人才與隊(duì)伍建設(shè)
(1)靠制度管理人:隨著職能的變化、事業(yè)的推進(jìn),近兩年配套出臺(tái)了一系列涉及多媒體教學(xué)運(yùn)行與管理、電教從業(yè)技能、儀器設(shè)備維修、教學(xué)研究、科研獎(jiǎng)勵(lì)等方面的管理文件,依靠制度監(jiān)督人、管理人與約束人。同時(shí),構(gòu)建兩級(jí)管理規(guī)章制度體系,管理工作重心下移,倡導(dǎo)一線職工獨(dú)立協(xié)調(diào)與處理問(wèn)題,鼓勵(lì)一線職工創(chuàng)新性開展工作。
(2)靠項(xiàng)目提高人:爭(zhēng)取各級(jí)各類教學(xué)、科研項(xiàng)目,利用項(xiàng)目調(diào)動(dòng)大家學(xué)習(xí)新理論、掌握新技術(shù)的積極性,營(yíng)造學(xué)術(shù)研究氛圍,挖掘教師潛力,努力向?qū)W習(xí)型、研究型團(tuán)隊(duì)目標(biāo)發(fā)展;同時(shí),利用項(xiàng)目出成果,改善電教人員評(píng)職稱難、發(fā)論文難、課題經(jīng)費(fèi)少等方面的缺陷。2007、2008兩年內(nèi),中心共獲得了1項(xiàng)校級(jí)重點(diǎn)教學(xué)研究立項(xiàng),4項(xiàng)校級(jí)一般教學(xué)研究立項(xiàng),5項(xiàng)校級(jí)一般試驗(yàn)教學(xué)研究立項(xiàng),共獲得經(jīng)費(fèi)2.6萬(wàn)元;2007年,我們還參與了由中國(guó)教育技術(shù)協(xié)會(huì)承擔(dān)的國(guó)家“十一五”教育規(guī)劃課題《信息技術(shù)環(huán)境下多元學(xué)與教方式有效融入日常教學(xué)的研究》的子課題立項(xiàng)。目前,由項(xiàng)目催生的成果逐漸呈現(xiàn),如依托《多媒體與課堂適應(yīng)性研究》項(xiàng)目撰寫的論文已經(jīng)在核心期刊發(fā)表。目前,一個(gè)愛(ài)學(xué)習(xí)、愛(ài)思考、人人想做事、人人有事做的良好氛圍正在形成。
(3)靠績(jī)效鼓勵(lì)人:規(guī)范獎(jiǎng)勵(lì)、分配制度,形成工作激勵(lì)機(jī)制,調(diào)動(dòng)老師工作的積極性。對(duì)于中心獲取的一些經(jīng)費(fèi)、補(bǔ)助,采取績(jī)效分配原則。在保證中心團(tuán)結(jié)和諧的基礎(chǔ)上,按照工作性質(zhì)、工作強(qiáng)度、工作時(shí)間等多項(xiàng)因素綜合考慮,實(shí)現(xiàn)多勞多得,保證讓老師付出了就有回報(bào),以此鼓勵(lì)那些承擔(dān)了繁重任務(wù)的老師、想做事的老師和做成了事的老師,如設(shè)置了論文獎(jiǎng)勵(lì)補(bǔ)助、設(shè)備維修補(bǔ)助、值班負(fù)責(zé)人補(bǔ)助等績(jī)效計(jì)算名目。這些獎(jiǎng)勵(lì)活動(dòng)的開展,極大地激發(fā)了教師的工作熱情,促進(jìn)了老師參與管理、發(fā)揮技術(shù)特長(zhǎng)、開展研究的積極性。
(4) 靠市場(chǎng)發(fā)展人:中心要有長(zhǎng)效發(fā)展的機(jī)制,目前最好的方式就是與市場(chǎng)接軌。一個(gè)部門要發(fā)展得很好,首先要有人,要有懂技術(shù)的人;要懂技術(shù),必須通過(guò)做項(xiàng)目、干工程、搞維修等活動(dòng)得到培養(yǎng)和鍛煉;要取得這些項(xiàng)目、工程,就要開展對(duì)內(nèi)對(duì)外服務(wù)。其次要有錢。沒(méi)有錢,就留不住人,也無(wú)法鼓勵(lì)人,無(wú)法調(diào)動(dòng)人的積極性。如何賺到錢?還是要通過(guò)做項(xiàng)目、干工程、搞維修,因此還是要開展對(duì)內(nèi)對(duì)外服務(wù)。目前,我們積極拓寬校外渠道,特別是加強(qiáng)了與當(dāng)?shù)貙W(xué)校的聯(lián)系,牽頭成立了“魯中地區(qū)教育技術(shù)協(xié)會(huì)”,利用協(xié)會(huì)帶動(dòng)學(xué)校之間項(xiàng)目的合作。同時(shí),針對(duì)本校業(yè)務(wù),采取與校外公司“半合作”的形式,把原本由校外公司完成的部分工程和維修項(xiàng)目交給中心來(lái)負(fù)責(zé),一方面能為學(xué)校節(jié)省資金,另一方面提高了工作效率,再者培養(yǎng)了技術(shù)人才,利于中心事業(yè)的長(zhǎng)期發(fā)展。
三 存在問(wèn)題與不足
總結(jié)兩年來(lái)我校電教事業(yè)發(fā)展,雖然取得了一定成績(jī),但還存在著一些問(wèn)題和不足,主要有以下幾個(gè)方面:
(1)高水平人才缺乏,隊(duì)伍建設(shè)任重道遠(yuǎn)。人才隊(duì)伍的數(shù)量、質(zhì)量和結(jié)構(gòu)與電教事業(yè)發(fā)展對(duì)人才的要求仍有很大差距。隨著高校對(duì)“進(jìn)人”條件逐漸嚴(yán)格,使原本高水平人才非常缺乏的電教部門更難要來(lái)高學(xué)歷、高水平的新人。同時(shí),電教事業(yè)沉浮不定,更導(dǎo)致原來(lái)隊(duì)伍中部分年輕教師、有技術(shù)特長(zhǎng)的老師等流失,因此,高水平人才數(shù)量不足、隊(duì)伍結(jié)構(gòu)有待改善與人才質(zhì)量亟待提高是影響目前高校電教事業(yè)發(fā)展的最主要的問(wèn)題。
(2)教育技術(shù)培訓(xùn)的任務(wù)仍然十分艱巨。目前存在學(xué)校重視不夠、經(jīng)費(fèi)投入少、缺乏有效組織、培訓(xùn)內(nèi)容與教師實(shí)際需求差別大、缺乏高水平培訓(xùn)教師等問(wèn)題。
(3)推動(dòng)網(wǎng)絡(luò)教學(xué)和教學(xué)資源共建共享的工作需要進(jìn)一步加強(qiáng)。信息化過(guò)程中,再好的“路、車、貨”如果不能用起來(lái),都是對(duì)資源的極大浪費(fèi)。雖然搭建了網(wǎng)絡(luò)教學(xué)和教學(xué)資源服務(wù)平臺(tái),但是由于缺乏明確的政策支持等原因,部分教師的積極性不足,平臺(tái)整體上的應(yīng)用還非常不夠。
(4)市場(chǎng)化接軌需進(jìn)一步深入,政策需明確,制度需要充實(shí)和細(xì)化。搭上市場(chǎng)這艘船,是高校電教事業(yè)改革的重大嘗試,可以說(shuō)是摸著石頭過(guò)河,需要學(xué)校政策的支持,需要制定并完善規(guī)章制度,及時(shí)解決改革中出現(xiàn)的問(wèn)題。雖然取得了階段性的成果,但離設(shè)想的目標(biāo)仍有不小的差距。
參考文獻(xiàn)
[1] 山東理工大學(xué). 第二次教學(xué)工作會(huì)議報(bào)告[Z].淄博,2005
[2] 山東理工大學(xué). 本科教學(xué)工作水平評(píng)估校長(zhǎng)報(bào)告[Z].淄博,2007

