大白菜游離小孢子培養技術高效體系的研究
李 菲 張淑江 章時蕃 張 慧 孫日飛* 張振賢
(1 中國農業科學院蔬菜花卉研究所,北京 100081;2 中國農業大學農學與生物技術學院,北京 100193)
游離小孢子培養技術(isolated microspore culture,IMC)是近年來興起的單倍體培養方法,具有單細胞、單倍體和較高胚胎發生率等優點,可以迅速獲得大量純合的雙單倍體植株,為植物育種和基礎研究創造了廣闊的應用前景。Lichter (1982)首次報道甘藍型油菜小孢子培養成功獲得了小孢子胚狀體及其再生植株,推動了十字花科蕓薹屬蔬菜作物小孢子培養的興起,蕓薹屬作物游離小孢子培養技術得到了快速發展(付穎 等,2011;Ferrie & Caswell,2011;顧祥昆 等,2013)。
大白菜〔Brassica campestrisL.ssp.pekinensis(Lour)Olsson〕是原產于我國的重要蔬菜作物,在我國蕓薹屬蔬菜中種植面積最大、種類最多,在生產中占據十分重要的經濟地位,圍繞大白菜育種與研究開展的小孢子培養受到了極大重視。近年來,國內外學者針對影響大白菜游離小孢子培養效率的諸多因素進行了廣泛的研究,明確了小孢子的發育時期、前期預處理以及供體植株的生長條件、培養基成分等因素均會影響大白菜小孢子培養的胚胎發生率(張鳳蘭 等,1994;劉凡 等,2001)。目前,通過技術改良,已建立起較為成熟的大白菜小孢子培養體系(李菲 等,2009),成為蕓薹屬蔬菜游離小孢子培養研究的主要作物之一。
大量研究顯示,基因型是決定小孢子胚胎發生能力的主要因素(Ajisaka et al.,1999;Zhang et al.,2003),但與之相關的功能基因的研究還未見新進展。目前,集中進行大群體材料小孢子培養難度較大,缺乏高效、穩定的培養體系。現有的培養體系在小孢子提取環節主要依靠手工擠壓,小孢子胚胎誘導效果受人為因素干擾較大,工作效率低,是開展群體材料小孢子培養研究的主要障礙。因此,提高小孢子培養的機械化操作、降低人為干擾、建立高效培養體系,是推動游離小孢子培養研究深入開展的前提。本試驗嘗試將機械化操作引入大白菜游離小孢子培養體系,利用細胞破碎儀提取小孢子,研究其對小孢子胚胎誘導效果的影響,以期建立高效的大白菜規模化小孢子培養體系,為集中開展大群體小孢子培養、進一步探討小孢子胚胎發生的相關研究奠定基礎。
1 材料與方法
1.1 材料
供試材料為中國農業科學院蔬菜花卉研究所白菜課題組選育的大白菜品種吉紅82 及#534DH 群體材料和#438 群體材料。2012年12月26日催芽播種于中國農業科學院蔬菜花卉研究所育苗室,進行低溫春化處理,2013年3月6日定植于日光溫 室,常規栽培管理直至抽薹開花。
1.2 游離小孢子的機械化提取
以吉紅82為試材,選取長2~3 mm、小孢子主要處于單核靠邊期的花蕾,先用75%酒精浸泡30 s,7%次氯酸鈉溶液洗滌15 min,無菌蒸餾水沖洗3 遍;然后加入B5 改良提取液,進行小孢子提取(李菲 等,2009)。
采用細胞破碎儀(TOMY MS-100R)進行小孢子的機械化提取。取50個適期花蕾于5 mL 離心管內,添加B5 改良提取液至5 mL,以直徑0.8 cm 的鋼珠破碎花蕾。設計破碎轉速分別為2 000、2 500、3 000、4 200 r·min-1,破碎時間均為10 s;以人工研磨擠壓提取小孢子為對照。花蕾破碎后,用30 μm 無菌微孔紗布過濾至10 mL 離心管內,洗滌離心3次,每次1 000 r·min-1離心5 min,以去除體細胞雜質,收集提取小孢子。
1.3 游離小孢子活力的快速檢測
取1 滴大白菜小孢子懸浮液,加入1~2 滴醋酸洋紅溶液染色制片,用顯微鏡進行觀察。小孢子呈現深紅色表明有生活力,淡紅色為無生活力,無色為死亡小孢子(劉絢霞,1998)。每份樣品隨機觀察4個視野,計算小孢子的平均活力。

1.4 游離小孢子培養濃度的快速確定
以#534DH 群體和#438 群體為試材,每份材料分3 組,每組收集40個適期花蕾于5 mL 離心管內,采用細胞破碎儀機械提取小孢子,經過濾、B5改良提取液洗滌,1 500 r·min-1、4 min 離心3次后,分別懸浮于20、25、30 mL NLN-13(蔗糖濃度為13%)培養基,采用血球記數板觀察計算小孢子懸浮液濃度。每份樣品觀察3個視野,計算平均濃度;比較相同花蕾數提取的小孢子懸浮于不同體積培養基的小孢子濃度,從而獲得快速確定小孢子培養濃度的方法。
1.5 小孢子誘導胚胎發生的效果比較
以吉紅82 為試材,比較人工擠壓提取小孢子和采用細胞破碎儀機械提取小孢子培養的胚胎誘導效果。以#534DH 群體和#438 群體為試材,評價機械提取小孢子培養的胚胎誘導效果。
采用NLN-13 培養基懸浮培養分離提取后的小孢子(Sato et al.,1989),小孢子濃度為1×105~3×105個·mL-1,分裝于60 mm×15 mm的培養皿中,每皿3 mL,Parafilm 封口后33℃熱激誘導24 h,轉入25℃暗培養,直至形成不定胚。
2 結果與分析
2.1 不同提取方法對大白菜小孢子提取效率的影響
由圖1可見,細胞破碎儀在轉速2 000 r·min-1和2 500 r·min-1條件下破碎10 s,均無法有效破碎花蕾;在轉速3 000 r·min-1和4 200 r·min-1條件下破碎10 s,破碎效果良好,達到了人工擠壓破碎的程度(圖2)。相對于人工擠壓提取小孢子,利用細胞破碎儀可同時破碎多份材料(圖3),且10 s即可達到良好的破碎效果,而人工擠壓提取1 份材料一般需要3~5 min。
醋酸洋紅檢測結果顯示,細胞破碎儀在轉速3 000 r·min-1和4 200 r·min-1條件下破碎10 s 提取的小孢子活力與人工擠壓提取的小孢子活力差異不顯著(表1);且相同花蕾數提取的小孢子經3次洗滌離心后的提取量與人工擠壓的提取量也基本相同 (圖4)。
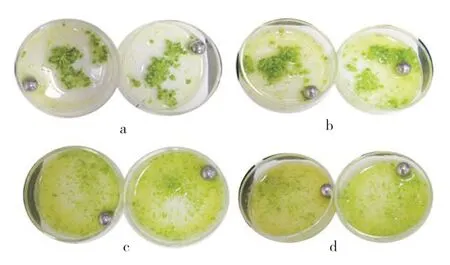
圖1 不同轉速處理破碎大白菜花蕾效果
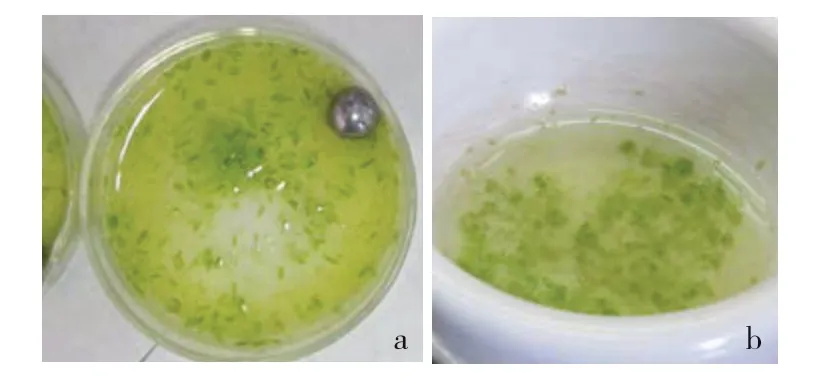
圖2 機械破碎與人工擠壓提取大白菜小孢子的效果比較

圖3 機械破碎同時提取多份材料的小孢子

圖4 機械破碎的大白菜小孢子提取量與人工擠壓的提取量比較
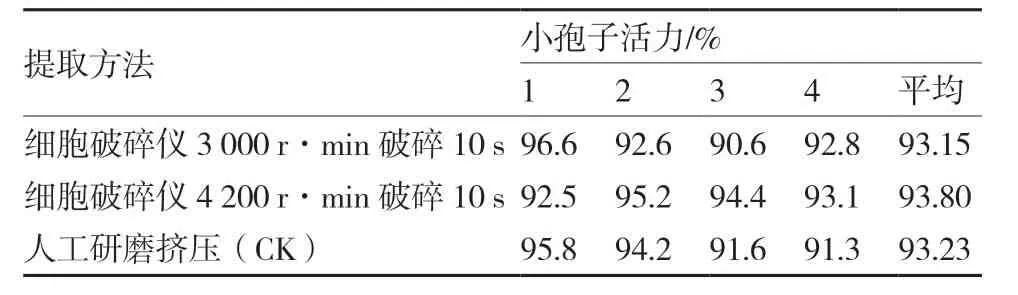
表1 不同提取方法對大白菜吉紅82 小孢子活力的影響
2.2 游離小孢子培養濃度的快速確定
從表2可以看出,定容于25 mL或30 mL NLN-13 培養基的大白菜小孢子懸浮液濃度大多數在1×105~3×105個·mL-1之間,符合小孢子培養的濃度要求;而定容于20 mL NLN-13 培養基的大白菜小孢子懸浮液濃度多數偏高,平均濃度與定容于25 mL 或30 mL NLN-13 培養基的大白菜小孢子懸浮液平均濃度差異達極顯著水平。考慮試驗中在洗滌離心環節存在的操作誤差,認為5 mL 離心管收集40個適期花蕾、利用細胞破碎儀提取小孢子定容于25 mL NLN-13 培養基更能穩定滿足小孢子培養濃度的要求。
從表2還可以看出,#534DH 群體和#438 群體各材料間小孢子懸浮液濃度差異不顯著,說明大白菜小孢子提取機械化操作是可行的。
2.3 小孢子誘導胚胎發生的效果
肉眼觀察結果顯示(圖5),兩種方式提取的小孢子均能成功誘導胚胎發生,胚狀體數量沒有明顯差異,說明細胞破碎儀可以取代人工擠壓用于大白菜游離小孢子培養的小孢子收集提取。
由圖6可見,不同材料單株提取的小孢子誘導胚胎發生存在極顯著差異,有的材料未能誘導胚狀體生成,如534-1、534-18;有的材料有少量胚狀體生成,如534-2、438-66、438-96 等;也有大量出胚的材料,如534-38、438-42(表3)。說明利用細胞破碎儀提取的小孢子進行胚胎誘導,能夠客觀反映出不同材料間小孢子誘導胚胎發生能力的 差異。
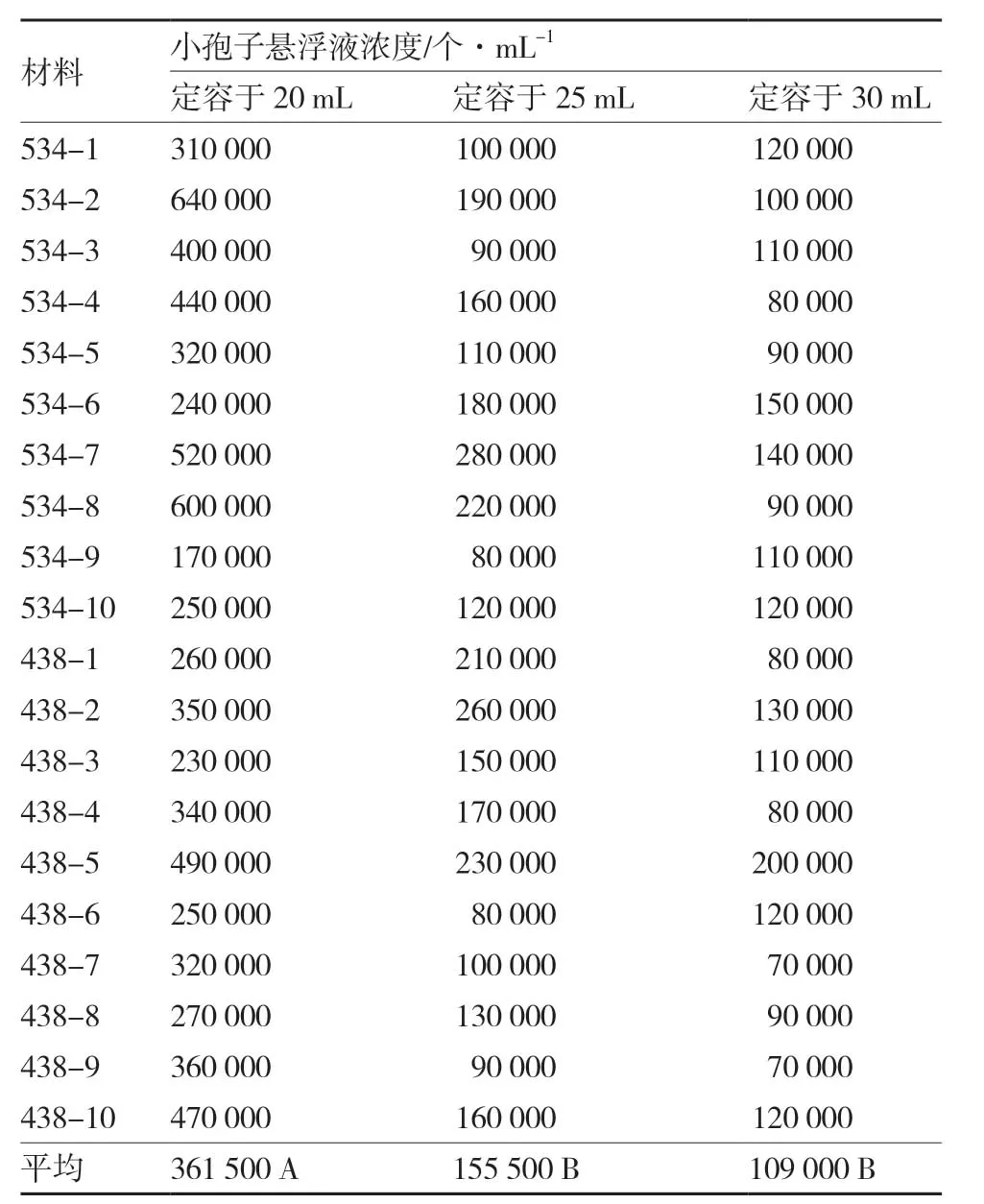
表2 不同NLN-13 培養基定容體積對大白菜小孢子懸浮液濃度的影響

圖5 機械破碎提取與人工擠壓提取的小孢子誘導胚胎發生的效果
3 結論與討論
游離小孢子培養技術由于其在胚胎發育學研究、基礎研究的群體構建以及育種工作中潛在的應用價值,一直受到廣泛關注,但小孢子培養屬于組培范疇的細胞培養,大量的外界干擾因素影響了這一技術的高效應用。蕓薹屬作物小孢子培養相對于其他作物較為成功,特別是甘藍型油菜、大白菜、甘藍等作物都已建立較為成熟的培養體系(Shashi et al.,2004)。在供體植株的培養條件上,通過人工氣候室栽培創造了較為恒定的栽培條件;精細量化培養基成分,減少了誘導環節的操作誤差。但人為干擾因素仍然在很大程度上影響了小孢子培養的可重復性,相同材料在不同人員操作下,如花蕾擠壓提取時的擠壓力度不同、試驗操作的細節差異等都有可能影響后期小孢子誘導胚胎發生的效果。同時,目前的游離小孢子培養仍局限于小規模的試驗操作,能夠進行大量材料的高效誘導培養是這一技術廣泛應用的前提。
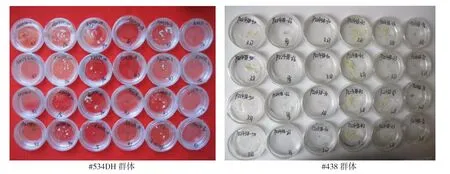
圖6 機械提取大白菜小孢子胚胎發生情況
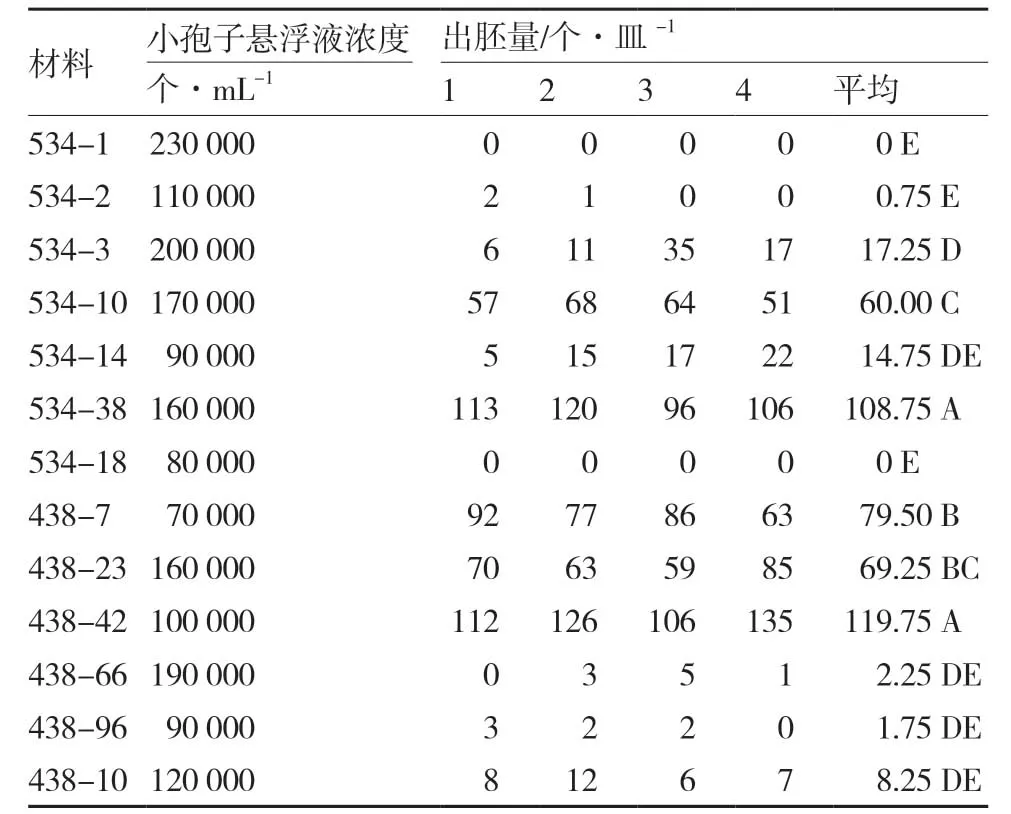
表3 不同材料機械提取小孢子誘導胚胎發生情況
本試驗嘗試用機械提取小孢子替代人工擠壓提取,結果顯示細胞破碎儀可以很好的替代人工操作,小孢子的提取量及小孢子活力與人工擠壓提取無顯著差異。一般利用5 mL 離心管收集40~50個適期花蕾,10 s 即可同時均勻破碎6 份材料,提取效率大大超過人工提取。如更換小離心管進行少量小孢子的收集,則可同時進行更多材料的提取。
小孢子培養是單細胞的群體培養,小孢子濃度對胚胎誘導率有一定的影響(申娟 等,2008),但目前要達到小孢子準確的定量培養還有一定難度。現有培養體系,人工擠壓提取小孢子,相同花蕾數由于操作中擠壓力度不同,小孢子的提取量存在差異,對小孢子的濃度調整一般采用血球計數板計算調整;本試驗通過20 份材料的3 組小孢子濃度比較認為,利用細胞破碎儀(TOMY MS-100R)進行小孢子的機械化提取,用力均勻,小孢子提取量較為穩定,從試驗操作上簡化了濃度調整環節,提高了工作效率。
觀察機械提取小孢子誘導胚胎發生的情況,結果顯示機械提取小孢子經懸浮培養可正常誘導胚胎發生,可以客觀反映材料單株的小孢子胚胎發生能力。值得注意的是,本試驗發現在適宜的小孢子培養濃度范圍內,小孢子的濃度不是影響胚胎發生的主要因素。如參試材料534-14 的小孢子濃度為90 000個·mL-1,每皿的平均出胚量為14.75個,與534-3 的每皿平均出胚量17.25個無顯著差異,而534-3 的小孢子濃度為200 000個·mL-1;534-38 的 小 孢 子 濃 度 為160 000個·mL-1,與534-3的小孢子濃度較為接近,但534-38 的每皿平均出胚量為108.75個,與534-3 的每皿平均出胚量17.25個達到極顯著差異。同樣,參試材料438-7與438-42 的小孢子濃度分別為70 000個·mL-1和100 000個·mL-1,每皿平均出胚量分別為79.50個和119.75個,都極顯著高于小孢子濃度為190 000個·mL-1、每皿平均出胚量為2.25個的438-66。由此可見,大白菜小孢子濃度雖影響小孢子的胚胎誘導率,但小孢子的胚胎發生能力主要取決于材料本身特性。
本試驗為建立高效的大白菜游離小孢子培養體系,在國內首次嘗試了用機械提取小孢子替代人工擠壓方法,在一定程度上消除了人為干擾對試驗結果的影響。在簡化試驗操作、提高試驗效率上都有令人滿意的結果,這為集中開展大批量試驗材料的游離小孢子培養,進行更為深入細致的群體研究提供了更優化的試驗平臺。本試驗結果對大白菜小孢子培養體系是個新的突破,小孢子培養的完全機械化操作是未來發展的趨勢。
付穎,楊碩,包美麗,劉雪利,馮輝.2011.小菘菜游離小孢子培養技術研究.中國蔬菜,(8):51-54.
顧祥昆,李菲,張淑江,章時蕃,張慧,孫日飛.2013.芥菜游離小孢子培養技術研究.中國蔬菜,(12):23-30.
李菲,張淑江,章時蕃,孫日飛.2009.大白菜小孢子提取液中的蔗糖和甘露醇對胚胎發生的影響.園藝學報,36(1):33-38.
劉凡,莫東發,姚磊,張月云.2001.遺傳背景及活性炭對大白菜小孢子胚胎發生能力的影響.農業生物技術學報,9(3):297-300.
劉絢霞.1998.醋酸洋紅染色法測定油菜花粉的生活力.陜西農業科學,(1):23-24.
申娟,梁秋霞,曹剛強,李峰,應芳卿.2008.蔬菜類作物游離小孢子培養中的影響因素.北方園藝,(6):59-62.
張鳳蘭,釘貫靖久,吉川宏昭.1994.環境條件對大白菜小孢子培養的影響.華北農學報,9(1):95-100.
Ajisaka H Y,Kuginuki M,Shiratori K,Ishiguro S,Enomoto M H.1999.Mapping of loci affecting the cultural efficiency of microspore culture ofBrassica rapaL.syn.campestrisL.using DNA polymorphism.Breed Sci,49:187-192.
Ferrie A M R,Caswell K L.2011.Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production.Plant Cell Tiss Organ Cult,104:301-309.
Lichter R.1982.Induction of haploid plants from isolated pollen ofBrassica napus.Z Pflanzenphysiol,105:427-434.
Sato T,Nishio T,Hirai M.1989.Plant regeneration from isolated microspore cultures of Chinese cabbage(Brassica campestrisL.ssp.pekinensis).Plant Cell Rep,8:486-488.
Shashi B B,Pradeep K A,Sahay S,Sant S B.2004.Isolated microspore culture ofBrassica:an experimenttal tool for developmental studies and crop improvement.Indian Journal of Biotechnology,3:185-202.
Zhang F L,Aoki S,Takahata Y.2003.RAPD markers linked to microspore embryogenic ability inBrassicacrops.Euphytica,131:207-213.

