碘量法測定銅量中選擇淀粉指示劑的探討
解正軍
(四川康西銅業有限責任公司,四川 西昌 615013)
0 前言
碘法的終點常用淀粉指示劑來確定。 在有少量I 存在下,I2與淀粉反應形成藍色吸附包合物,根據藍色的出現或消失來指示終點。 碘法中所用的淀粉是多糖類(C6H10O5)的一種,高等學校《有機化學實驗》教材也指出:“淀粉在百萬分之幾時仍能給出碘試驗的正性結果”。因此,在生化領域的生產和檢驗中,都廣泛地利用淀粉和碘化鉀組成的混合液作為氧化還原反應一類滴定的指示劑,或用碘來證實淀粉的存在。 但在實際分析操作中,往往會出現市售可溶性淀粉配制成的淀粉溶液在遇一定量碘時不一定顯藍色的現象。為了確保分析結果的準確性,需要我們對所用淀粉作一些對比分析,選擇質量好的淀粉作為指示劑來使用。
1 實驗部分
淀粉溶液的準備:5g/L
將市售A、B、C、D、E 五個不同廠家生產的可溶性淀粉分別稱取0.5 克,調成糊狀后分別配入已燒沸的五杯蒸餾水中,煮沸攪拌直至淀粉溶解完全,冷卻稀釋至100 mL 備用。
方法(一):標樣法
每種淀粉溶液隨機滴定兩杯標樣。
參照GB/T 3884.1-2012《銅精礦化學分析方法 第1 部分 銅量的測定 碘量法》,將已知銅含量為20.17%的硫化銅精礦標準樣品,分別稱量0.2000 克于10 個500mL 錐形燒杯中,用少量水潤濕,加入10mL鹽酸(ρ1.19g/mL),置于電熱板上低溫加熱 3~5 分鐘,取下稍冷,加入5mL 硝酸(ρ1.42g/mL)和 0.5~1 mL 溴,蓋上表皿,混勻,低溫加熱;待試料完全分解后,取下稍冷,用少量水洗滌表皿,繼續加熱蒸至近干,冷卻。 用蒸餾水30mL 沖洗表皿及杯壁,蓋上表皿,置于電熱板上煮沸,使可溶性鹽類完全溶解,取下冷至室溫。
滴加乙酸銨(300g/L)溶液至紅色不再加深并過量3~5mL,然后滴加氟化氫銨飽和溶液至紅色消失并過量1mL,混勻。 加入10mL(40%)片狀固體碘化鉀溶液搖勻,立即用硫代硫酸鈉標準溶液(C=0.04mol/L,按國標方法標定好滴定度)滴定到淺黃色,加入2mL 淀粉溶液,繼續滴定至淺藍色,加入5mL 硫氰酸鉀(100g/L)溶液,激烈搖振至藍色加深。 再滴定至藍色剛好消失即為終點。
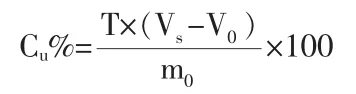
式中:T——硫代硫酸鈉標準滴定溶液的滴定度,g/mL;
Vs——測定時,滴定試料溶液所消耗的硫代硫酸鈉標準滴定溶液的體積,mL;
V0——測定時,滴定空白試料溶液所消耗的硫代硫酸鈉標準滴定溶液的體積,mL;
m0——試料的質量,g;
方法(二):銅標準法
將純度99.999%以上的銅片按GB/T 3884.1——2012 進行預處理,稱取1.0000 克,按操作規程配制成1mg/mL 的銅標準溶液備用。
需要時, 吸取一定量銅標準溶液于潔凈的燒杯中, 按GB/T 3884.1——2012 中方法2 調節酸度,加入試劑,直至加入淀粉,觀察顯色情況,以確定淀粉質量。
注:此方法簡單、快捷,能快速辨別淀粉質量,也可對比評估淀粉影響分析結果的情況,在此略過。
2 結果與討論
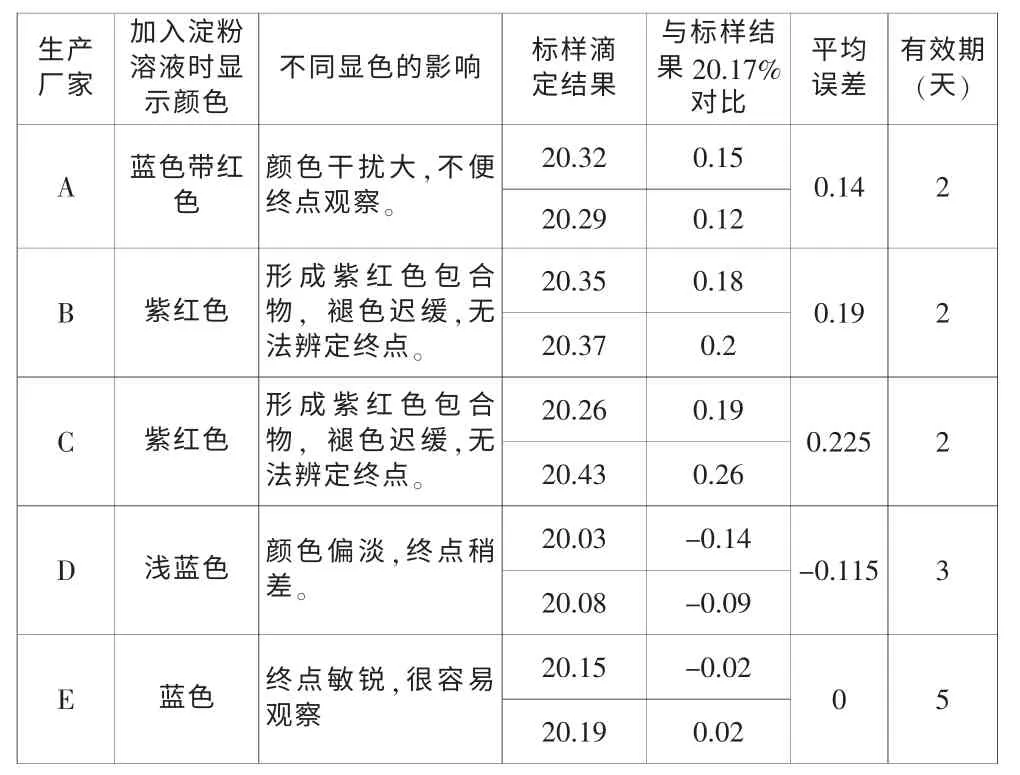
表1
就以上結果顯示顯淺藍色的淀粉滴定結果略偏低,藍帶紅或紫紅色的容易導致結果波動,通常達0.1%以上,尤其紫紅色的褪色很難觀察,根本不能用來指示終點。只有顯藍色的滴定結果很穩定。在隨后分析成批樣品對比時也證明了此種結論。
隨后幾天觀察所配淀粉溶液,顯藍色的最多可用近一周,但其它幾種只能用2~3 天,就出現懸糊絲狀物,出現腐敗、變質現象,顯色時明顯失真。
結合所學知識并查閱相關資料顯示:
淀粉是白色無定形的粉末,從結構上可分為直鏈和支鏈兩種。 淀粉跟碘生成的包合物的顏色, 跟淀粉的聚合度或相對分子質量有關。在一定的聚合度或相對分子質量范圍內,隨聚合度或相對分子質量的增加,包合物的顏色的變化由無色、橙色、淡紅、紫色到藍色。
碘量法中應用最多的是淀粉指示劑。 通常淀粉溶液遇I2顯深藍色,反應可逆并極靈敏,在I2濃度為10-5~10-6mol/L 時亦能觀察到溶液的藍色。 含直鏈成份多的淀粉與I2(或I3)作用形成深藍色,反應可逆并極靈敏,在室溫條件下,可檢出約10mol/L 的碘溶液;含支鏈成份的淀粉,只能松動地吸附I,形成一種紅紫色產物,靈敏度低,不能作為碘量法的終點指示劑。
天然淀粉中含有油脂,且不同的植物,其淀粉中油脂的含量有所不同。 我們知道,油脂是有碘值的(即能與碘反應褪色),碘溶于油脂中,會使得液體呈現紅至橙紅色。 淀粉分子末端單糖所含有的醛基也可被碘水氧化,使碘水褪色。 (參照處理方法:可用市售的可溶性淀粉(55℃~65℃),最好是在55℃左右提取的可溶性淀粉干燥后,用CCL4在40℃~65℃下浸泡半小時,過濾,并用CCL4多次洗滌,進行脫脂處理。 將上述提取的淀粉干燥后, 用3%的H2O2浸泡二十分鐘以上,過濾,并用蒸餾水反復洗滌,除去淀粉分子末端單糖的醛基。經上述處理過的淀粉,試驗時可使產生的藍色較為準確,也觀察不到顏色的消褪現象,可以避免指示劑引入誤差,使檢驗結果更準確。 )
淀粉跟碘生成的包合物在pH=4 時最穩定,所以它的顯色反應在微酸性溶液里最明顯,實際操作時應控制好滴定溶液的酸度,并在室溫下進行操作,同時在滴定時應注意以淀粉作指示劑的加入時刻。 直接碘量法,在酸度不高的情況下,可滴定前加入;間接碘量法時,應先以硫代硫酸鈉溶液滴定到溶液呈淺藍色(此時大部分I2 已作用),然后加淀粉溶液,再用硫代硫酸鈉標液滴定至藍色恰好消失,即為終點。淀粉加入不能太早,因滴定反應中產生大量的CuI 沉淀,大量的I2 與淀粉過早形成藍色包合物(也即淀粉凝聚,而且吸附在淀粉表面上的I2 不易釋出),大量I3 被吸附,終點顏色呈較深的灰色,終點“遲純”,不好觀察。
淀粉溶液易于變質、腐敗,最好臨用前配制,若放置過久,則與I2形成的包合物呈紫或紅色而非藍色。這種紅紫色吸附包合物在用硫代硫酸鈉溶液滴定時褪色慢,終點不敏銳。
3 結論
我們在實際使用淀粉作為碘量法的指示劑時, 可參照方法一或二,及時試驗對比所購淀粉質量,選擇顯色最好的淀粉來使用,同時嚴格按淀粉使用的注意事項進行現配現用,以免造成數據不穩定,引起供需雙方較大的爭議,甚至給企業帶來重大損失。
[1]碘遇淀粉真的都顯藍色嗎[OL].http://dxchong.bokee.com/5677522.html.
[2]指示劑[OL].http://class.ibucm.com/fxhx/6/right4_3.htm.
[3]中華人民共和國國家質量技術監督檢驗檢疫總局、中國國家標準化管理委員會發布.GB/T 3884.1-2012 銅精礦化學分析方法 第1 部分 銅量的測定 碘量法[S].中華人民共和國國家標準,北京:中國標準出版社.2013,5.
[4]武漢大學,主編.分析化學[M].3 版.高等教育出版社,1995,5.
[5]胥朝,主編.分析工[M].化學工業出版社,1997,5.
[6]劉珍,編.化驗員讀本(上冊):化學分析[M].4 版.化學工業出版社,2004,1.
[7]淀粉遇到碘變成藍色,為什么[OL].http://iask.sina.com.cn/b/3837660.html.
——硫代硫酸鈉

