胃蛋白酶中性蛋白酶水解酪蛋白的研究
王立暉,盧楠,李培駿
(1.現代職業技術學院,天津300350;2.河北化工醫藥職業技術學院,河北石家莊050026;3.溫州質量技術監督檢測院,浙江溫州325000)
胃蛋白酶中性蛋白酶水解酪蛋白的研究
王立暉1,盧楠2,李培駿3
(1.現代職業技術學院,天津300350;2.河北化工醫藥職業技術學院,河北石家莊050026;3.溫州質量技術監督檢測院,浙江溫州325000)
本實驗主要研究雙蛋白酶(胃蛋白酶-中性蛋白酶)催化酪蛋白水解的反應過程。實驗中首先設計正交試驗確定了中性蛋白酶和胃蛋白酶各自單獨水解酪蛋白的最佳反應條件,分別為酶濃度0.6%、溫度55℃、pH 8.0、底物濃度2%和酶濃度1.5%、溫度55℃、pH 1.6、底物濃度10%。在此基礎上以雙蛋白酶作為催化劑水解酪蛋白的反應過程進行研究,并利用層析分離技術和液相色譜初步驗證了水解產物中含有β-啡肽-7等多肽類物質。
酪蛋白;水解度;胃蛋白酶;中性蛋白酶;生物活性多肽
酪蛋白是乳制品中含量最高的蛋白質,是一種完全蛋白質,內含人體自身無法合成的全部的8種必需氨基酸,可以為生物體生長發育提供堅實的營養基礎[1]。在適當蛋白酶的催化下,酪蛋白能夠發生水解反應,生成眾多具有獨特生物活性和重要生理功能的多肽類物質,例如,酪蛋白磷酸肽具有防止礦物質流失、預防齲齒,防治骨質疏松與佝僂病,促進動物體外受精,調節血壓,治療缺鐵性貧血等多種生理功效。因此,酪蛋白已被確認是未來用于開發新藥物和新型功能性食品的重要原料物之一。
本實驗分別研究了單蛋白酶與雙蛋白酶催化酪蛋白水解的過程。首先采用正交試驗法,分別確定了中性蛋白酶和胃蛋白酶單獨水解酪蛋白的最佳反應條件,并在此基礎上,進一步研究了雙蛋白酶(中性蛋白酶與胃蛋白酶)水解酪蛋白的過程,并利用層析分離技術和高效液相色譜儀初步驗證了水解產物中的多肽類物質的種類及含量。
1 材料與方法
1.1 實驗材料
干酪素(食品級):徐州百順生物科技有限公司;胃蛋白酶(EC 3.4.23.1):Sigma-Aldrich公司;中性蛋白酶:Novo公司;甲醛(分析純):梯希愛(上海)化成工業發展有限公司;交聯葡聚糖Sephadex G-15:Sigma-Aldrich公司;甲醇(色譜級):天津江天化工技術有限公司;乙腈(色譜級):國藥集團化學試劑有限公司;β-酪啡肽-7(純度98%):梯希愛(上海)化成工業發展有限公司;其余試劑純度等級均為分析純。
1.2 實驗儀器
PHS-3C型pH計:上海偉業儀器廠;85-2B數顯恒溫磁力攪拌器:江蘇省金壇市友聯儀器研究所;BILONHW-10S水浴恒溫振蕩器:上海比朗儀器制造有限公司;DHG-06型電熱恒溫鼓風干燥箱:深圳市耐美特工業設備有限公司;FA3204B電子分析天平:上海精科天美貿易有限公司;HD-3紫外檢測儀:美國熱電有限公司;BT101S恒流泵:武漢恒流泵業制造有限公司;Centrifuge 5810R離心機:Sigma-Aldrich公司;Lyostar凍干機:新默真科技(北京)有限公司;Heto Hsc 500記錄儀:丹麥Heto公司;QT超聲波儀:天津市瑞普電子儀器公司;LC-2900型高效液相色譜儀:Sigma-Aldrich公司;LC-10AT液相流動泵:Sigma-Aldrich公司;SPD-10A型紫外-可見監測器:Sigma-Aldrich公司;2010色譜工作站數據處理系統:Sigma-Aldrich公司;7 52型(自動)紫外分光光度計:上海天普分析儀器有限公司;微孔過濾膜(0.45 nmφ50):天津大學科威公司。
1.3 實驗方法
1.3.1 單酶催化水解酪蛋白
1)酪蛋白溶液(蛋白含量為0.785)配制
向85℃的NaOH(0.1mol/L,100mL)溶液中緩慢加入干酪素(酪蛋白),攪拌溶解,蒸餾水定容至250mL。調節溫度和pH至蛋白酶的最適催化條件(來源于文獻資料),恒溫儲藏待用。
2)水解反應
中取100mL酪蛋白溶液置于恒溫振蕩水浴鍋中的錐形瓶,分別加入等量的蛋白酶(中性蛋白酶或胃蛋白酶)后開始水解反應,一段時間后,取出錐形瓶并立即倒入強堿液終止反應。
3)水解度的測定
水解度(Degree of Hydorlysis,DH)是指原料蛋白中肽鍵裂解的百分數,也表示蛋白質被水解的程度。由于蛋白質每斷裂一個肽鍵就會生成一個-NH2和-COOH,因此只需要定量測定增加的-NH2和-COOH并通過計算即可求得該蛋白在反應中的水解度。
本實驗中采用甲醛法進行酪蛋白水解度的測定,具體操作為:將終止反應后的反應液(10mL)與去二氧化碳蒸餾水(30mL)想混合,調節混合液pH到8.2后加入甲醛(10mL,pH 7.0)。1min后,用標準NaOH溶液滴定至pH 9.2,記錄所用NaOH體積。以酪蛋白溶液為底物反應做空白試驗。水解度的計算公式如下:

式中:M為NaOH溶液的濃度,(mol/L);V為水解液滴定時消耗的氫氧化鈉溶液的體積,mL;V0為空白液滴定時消耗的氫氧化鈉溶液的體積,mL;Cwo,V1為所取酪蛋白溶液的濃度,(mg/mL)和體積,mL;X為酪蛋白樣品中蛋白質的含量;8.2為每克酪蛋白中所含的肽鍵數,(mmol/g)。
4)正交試驗
選擇實驗中的反應溫度,酪蛋白溶液pH,酪蛋白濃度,蛋白酶濃度等適當的因素水平,構建不同蛋白酶做催化劑的四因素三水平的L9(34)正交實驗表。每組變量實驗重復3次。研究不同反應條件對酪蛋白水解度的影響,并分析后確定各蛋白酶的最佳反應條件。
1.3.2 雙蛋白酶催化水解酪蛋白
1)以中性蛋白酶水解酪蛋白的最佳反應條件為實驗條件,在反應一段時間(60、90、120min)后,終止反應,取一定量的反應液檢測酪蛋白的水解度。
2)以上一步得到的反應液為底物溶液,胃蛋白酶為催化劑,在該酶最佳催化條件下(酶濃度1.5%、溫度55℃、PH 1.6)分別反應0.5、1.0、1.5、2.0、2.5 h,取出反應液并終止反應,測定此時酪蛋白的水解度。
1.3.3 酪蛋白水解產物的定性研究
1)以交聯葡聚糖作為層析柱填充物,用水溶脹后填入φ17 cm的層析柱中,確保壓實后柱中填充物高度為57.5 cm。用3倍柱床體積的緩沖液洗脫柱子。
2)將水解樣品經過離心、過濾、濃縮等初步提純后,將反應液用制得的層析柱分離,收集目標流出物,冷凍干燥得到水解產物。
1.3.4 RP-HPLC檢測酪蛋白水解產物
1)通過查詢資料可知,酪蛋白水解后得到產物為多肽鏈(5個~10個氨基酸組成的具有生物活性的多肽類物質),平均長度可用公式[4]計算得出。

2)本實驗中以其中一種典型的七肽,即腦啡肽中的β-酪啡肽-7作為主要研究對象進行分析檢測。張源淑[5]的研究介紹了利用反相高效液相色譜儀(RPHPLC)對β-酪啡肽-7進行檢測的操作條件,通過這個方法能夠實現驗證組合酶水解酪蛋白得到的反應液中是否含有β-酪啡肽-7等生物活性多肽類物質。
3)準確稱取2.65mgβ-酪啡肽-7標準樣,用甲醇溶解并定容至5mL,溶解時可用超聲波儀助溶。取標準品溶液(10μL)用液相色譜儀進行定性檢測,色譜檢測條件為色譜柱:SHIM-PACK VP-ODSC18;檢測波長:215 nm,柱溫40℃,柱壓9.6MP;乙腈∶水=20∶80作為流動相,流速為1mL/min。重復多次檢測,以確保結果的準確性。檢測過程中溶劑在使用前需要用微孔濾膜過濾以及超聲波儀脫氣處理。
4)準確稱取一定數量反應液提純物,用甲醇溶解并定容至5mL,超聲波儀助溶,在上述條件下用液相色譜儀進行檢測樣品液,觀察出峰情況。
2 結果與分析
2.1 單蛋白酶催化水解酪蛋白
2.1.1 中性蛋白酶催化水解酪蛋白反應分析
在不同反應條件下,以中性蛋白酶作為催化劑催化酪蛋白水解0.5 h,重復3次實驗,構建L9(34)正交試驗(表1),不同反應條件下的水解度結果如表2所示。對正交試驗結果進行數據分析(表3)可知,4個變量因素(反應溫度,酪蛋白溶液pH,酪蛋白濃度,反應液中酶濃度)中顯著性的顯著程度為:酪蛋白溶液pH(D)<反應溫度(C)<酪蛋白濃度(A)<反應液中酶濃度(B),從而確定四因素水平的最佳組合方式為:A2B3C2D3,即中性蛋白酶催化水解酪蛋白的最佳反應條件為:0.6%酶濃度、2%酪蛋白濃度、55℃反應溫度、酪蛋白溶液pH 8.0。

表1 L9(34)正交試驗因素表Table1 Levelsof factorsof orthogonal test L9(34)

表2 L9(34)正交試驗結果Table2 Resultsof orthogonal test L9(34)
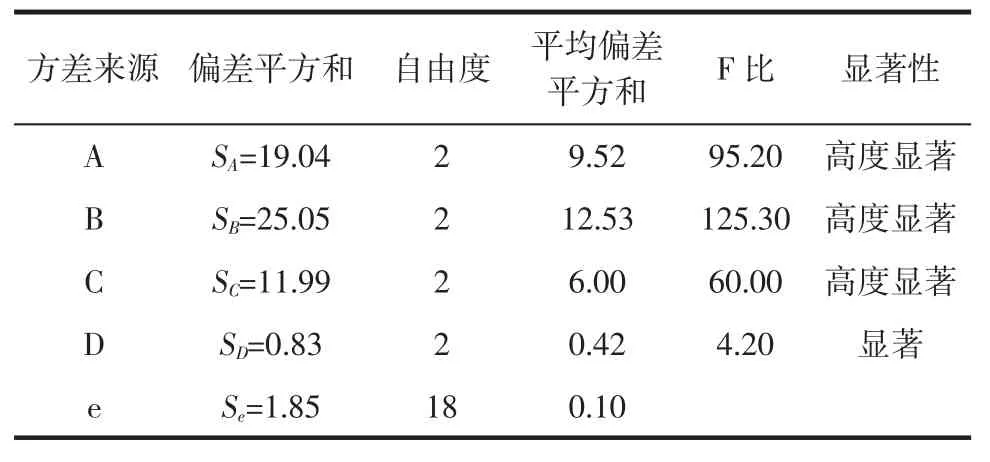
表3 L9(34)正交試驗數據分析表Table3 Datasheet AMalysisof of orthogonal test L9(34)
2.1.2 胃蛋白酶催化水解酪蛋白反應分析
在不同反應條件下,以中性蛋白酶作為催化劑催化酪蛋白水解2 h,重復3次實驗,構建L9(34)正交實驗(表4),不同反應條件下的水解度結果如表5所示。

表4 L9(34)正交試驗因素表Table4 Levelsof factorsof orthogonal test L9(34)

表5 L9(34)正交試驗結果Table5 Resultsoforthogonal test L9(34)
通過方差分析,確定正交試驗中4個因素的顯著性順序為:反應溫度(D)<酪蛋白溶液pH(C)<反應液中酶濃度(B)<酪蛋白濃度(A),最佳因素組合為A1B3C3D3,估計實驗數值為y=8.53+2.36+1.46+0.5+ 0.24=13.10。以實驗和數據分析結果為基礎,結合需要的最佳水解度值和成本因素,最終確定胃蛋白酶催化酪蛋白水解的最佳反應條件為:酪蛋白濃度10mg/mL,反應液中酶濃度1.5%;反應液pH 1.6,反應溫度55℃。
2.2 雙蛋白酶催化水解酪蛋白的反應分析
以雙蛋白酶(中性蛋白酶-胃蛋白酶)作為催化劑,不同反應時間條件下,水解酪蛋白結果如表6所示。

表6 雙酶催化水解酪蛋白的結果Table6 Hyd rolysis resultsof casein catalyzed by doubleenzyme
從表6中結果可知,相比單一蛋白酶作為催化劑水解酪蛋白,雙酶體系可以取得更佳的水解效果。隨著中性蛋白酶催化時間的增加,最終得到的酪蛋白水解度也隨之增加,并且水解度明顯優于單酶的水解結果。
綜上所述,雙蛋白酶水解酪蛋白的最佳反應條件為:中性蛋白酶水解30min后,胃蛋白酶水解2.5 h。并以此條件作為下一階段實驗的反應條件,從而對水解產物進行研究。
2.3 酪蛋白水解產物的定性研究
2.3.1 水解產物的層析分離結果
雙酶催化酪蛋白水解反應中的B13水解液經分離和提純。將不同時間的流出液進行吸光度檢測,通過對比酪蛋白空白曲線圖和B13水解液的吸光度-洗脫峰的曲線(圖1和圖2)可以清晰證明,水解反應后有新的物質產生。
2.3.2 水解產物組分的標準品的色譜分析
2.3.2.1 β-啡肽-7標準物的色譜分析
利用反相高效液相色譜儀對β-啡肽-7標準品進行色譜分析,結果如圖3所示。

圖1 酪蛋白空白Fig.1 Casein
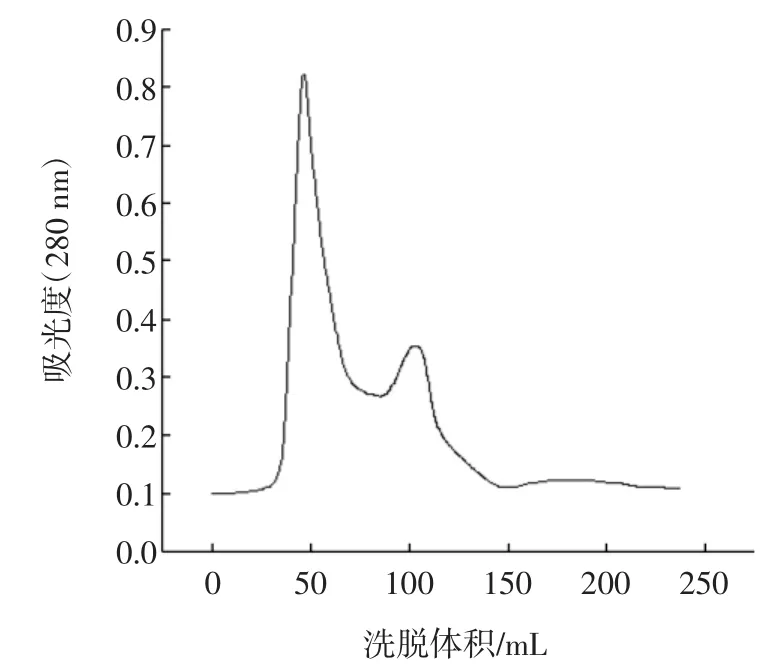
圖2 雙酶水解液Fig.2 Subtilisin-pepsin hydrolyte

圖3 β-啡肽-7標準品色譜分析圖Fig.3 ChroMatograManalysis figureofβ-啡肽-7
從圖中可以看出β-啡肽-7特征峰的保留時間是29.912min,峰面積為7 584 300.5,峰高度是327.534,含量為0.977 8%。
2.3.2.2 樣品B13的液相色譜檢測
利用反相高效液相色譜儀對水解度為15.91%的B13樣品的提純物進行檢測分析,并將結果與β-啡肽-7標準樣的特征峰進行比對,實驗結果及數據記錄如圖4和表7。
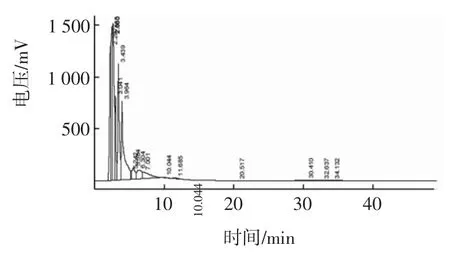
圖4 中性蛋白酶-胃蛋白酶組合中目標峰的檢測結果Fig.4 Subtilisin-pepsin coMbination HPLC detection results

表7 RP-HPLC檢測結果Table7 Resultsof RP-HPLC
檢測結果證實由雙蛋白酶催化酪蛋白反應得到的水解物中含有β-酪啡肽-7等生物活性多肽。
3 討論與結論
本實驗主要研究雙蛋白酶(中性蛋白酶-胃蛋白酶)催化酪蛋白水解的反應過程。實驗中首先設計正交試驗確定了中性蛋白酶和胃蛋白酶各自單獨水解酪蛋白的最佳反應條件,分別為酶濃度0.6%、底物濃度2%、溫度55℃、pH 8.0和酶濃度0.15%、溫度55℃、pH 7.5、底物濃度6%。在此基礎上以雙蛋白酶作為催化劑水解酪蛋白的反應過程進行研究,并利用層析分離技術和液相色譜初步驗證了水解產物中含有β-啡肽-7(保留時間30.410min、峰面積731 924、峰面積百分比(%)0.626)。
酶解酪蛋白是蛋白質研究領域中的熱門方向,各種酪蛋白的酶解方法、水解產物的提純和檢測手段也越來越受國內外學者的重視,尤其是對水解產物中所含的生物活性肽的研究,不僅擴展了食物蛋白的應用范圍,也為動物學、營養學、生物醫藥以及食品科學等學科的發展提供了一個新的思路。我們能夠相信,在功能食品和飼料添加劑制造領域中,生物活性多肽的發展前景是非常廣闊的。
[1]鄒思湘.酪蛋白源活性肽[J].生命的科學,1993,13(1):18
[2]林立.酶促水解反應的實驗和優化[D].華東理工大學碩士學位論文,2001:18-19
[3]Brantl V,Teschemacher H,Henschen A.Novel opioid peptides derived froMcasein(β-casomorphins)[J].I.Isolation froMbovine casein peptone.Hoppe~Seyler's ZPhysiolChem,1979,360:1211-6
[4]J.Adler Nissen.Enzymatic hydrolysisof food proteins[M].New York, Elsevier Appl.Sci.Pub:1986
[5]張源淑,鄒思湘.反相高效液相色譜法分析結構相似酪啡肽[J].食品科學2005,26(2):172-174
Reseach on the Hydrolytic Course froMCasein w ith Pepsin and Subtilisin
WANGLi-hui1,LUNan2,LIPei-Jun3
(1.Tianjin Modern Vocation Technology College,Tianjin 300350,China;2.HebeiChemicaland Pharmaceutical Vocational Technology College,Shijiazhuang050026,Hebei,China;3.Wenzhou Instiute of Technology and Calibration,Wenzhou 325000,Zhejiang,China)
The focus of the experiment is reseach on the hydrolytic course froMcasein with double enzymes(pepsin and subtilisin).Firstly,thebest testconditionsof casein hydrolysate catalyzed were obtained by dispase or pepsin according to the results of orthogonal tests which were designed firstl.the optimistic conditions for dispase or pepsinwere as follow:enzyme concentration 0.6%,temprature 55℃,pH 8.0,substrate concentration 2%and enzyme concentration 1.5%,temprature 55℃,pH 1.6,substrate concentration 10%.Subsequently,reseachon thehydrolytic coursecatalyzed bysubtilisin-pepsinwascarried and thehydrolysateconteinsβ-CM-7 biologicalactivitypeptidesidentified by chromatographyand RP-HPLC.
casein;degree ofhydrolysis;pepsin;dispase;biologicalactivity peptides
10.3969/j.issn.1005-6521.2014.18.099
2014-09-24
王立暉(1981—),男(漢),副教授,碩士,研究方向:食品生物技術。

