酯交換法合成2,6-萘二甲酸乙二醇酯動力學研究
喬 遷, 柳大勇, 孫林平
(長春工業大學化學工程學院,吉林長春 130012)
0 引 言
聚萘二甲酸乙二醇酯(PEN)是一種熱塑性高分子材料,通常由2,6-萘二甲酸(NDCA)與乙二醇(EG)進行縮聚反應或2,6-萘二甲酸二甲酯(NDC)與乙二醇(EG)酯交換后再經縮聚反應而得到[1-3]。PEN具有氣密性、耐熱性、抗紫外線性、耐腐蝕性和低吸附性等優異物化特性[4],使得PEN成為研究熱點。日本帝人化學公司、英國ICI公司、荷蘭Shell化學公司已經開發出適用于不同用途的PEN樹脂生產技術[5]。國內關于PEN合成工藝的研究處于萌芽階段,北京服裝學院李琪[6]等通過研究2,6-萘二甲酸與乙二醇的直接酯化和廢PEN塑料醇解再縮聚合成PEN工藝,得到相應反應的動力學參數。關于PEN聚合中間體的2,6-萘二甲酸二乙二醇酯的合成研究報道較少。綜上所述,文中以2,6-萘二甲酸二甲酯和乙二醇的酯交換合成2,6-萘二甲酸二乙二醇酯為研究對象,考察催化劑種類、催化劑用量、EG/NDC摩爾比對酯交換反應動力學的影響。
1 實驗部分
1.1 試劑與儀器
實驗所用化學試劑見表1。

表1 實驗試劑
1.2 實驗過程
準確稱量一定量的2,6-萘二甲酸二甲酯(NDC)和乙二醇(EG),分別預熱后將其加入充滿氮氣的玻璃反應釜中,并將油浴溫度升到設定的反應溫度,開動恒速攪拌器進行攪拌,同時加入一定量的酯交換反應催化劑。當第一滴餾分滴入收集器時,開始對該反應計時,定時記錄流出餾分的體積,到設定反應時間停止進行反應。采用氣相色譜儀(FID,GC7890N,Agilent)對NDC與EG反應產物(餾分)進行定性分析。
根據文獻[7-10]報道,NDC和EG進行酯交換反應過程如下:
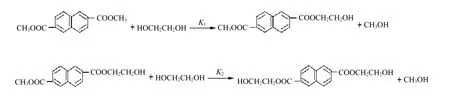
在酯交換反應動力學處理中,我們假設K1和K2近似相等。此外,為簡化動力學模型,做了4點假定:反應生成的副產物甲醇及時排出;反應體系由于甲醇的餾出,反應體系體積減小,反應為變容過程;動力學處理過程中,忽略副反應發生的影響;反應進程通過餾出的甲醇體積量監控。因此,酯交換反應式可以簡化為:
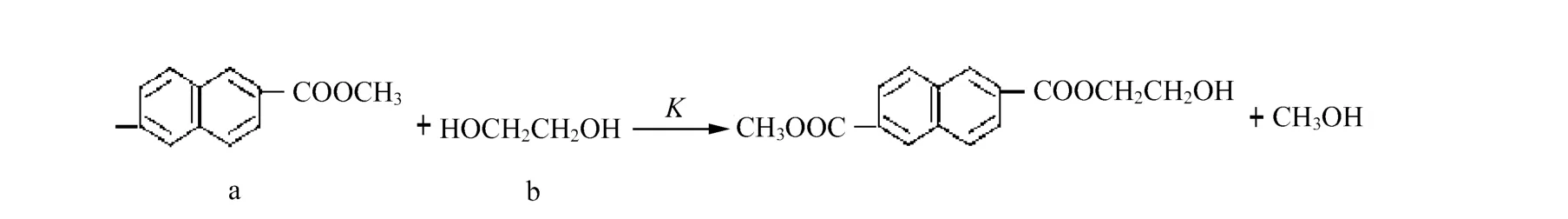
則以NDC(a)消耗表示的速率方程為:
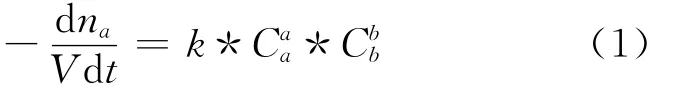
由于
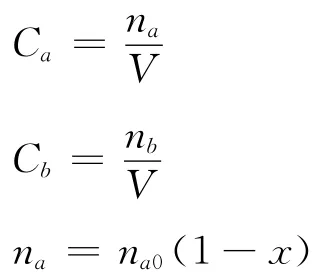
那么式(1)變為:
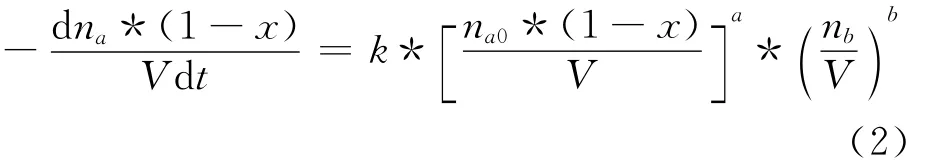
式中:k——速率常數;
Ca——反應體系中組分a的濃度;
Cb——反應體系中組分b的濃度;
na0——反應體系中組分a的初始摩爾數;
nb0——反應體系中組分b的初始摩爾數;
na——反應體系中組分a在反應過程中的摩爾數;
nb——反應體系中組分b在反應過程中的摩爾數;
V——反應體系的體積;
x——反應轉化率。
由于
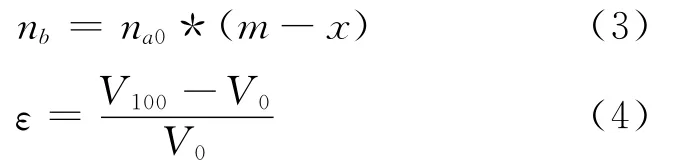
式中:m——EG與NDC中甲酯基的物質的量比;
ε——體積校正系數;
V0,V100——反應轉化率分別為0和100%時體系的體積。
將式(3)和式(4)代入式(2),得到:

化簡式(5)得到NDC與EG酯交換反應速率方程為:
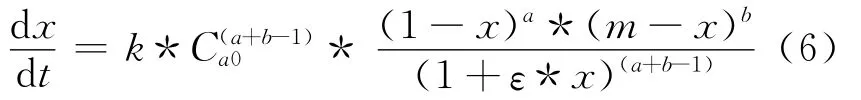
對式(6)整理積分得到:
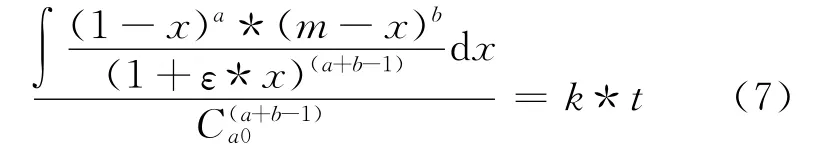
令:
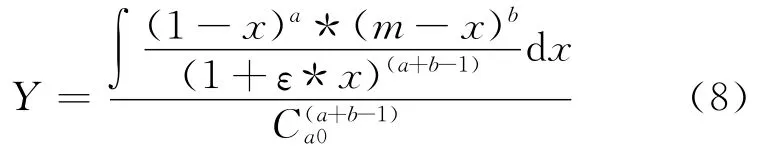
得到:

2 結果與討論
2.1 催化劑種類對NDC與EG反應動力學的影響
在反應溫度195℃,EG/NDC摩爾比2.3條件下,分別以醋酸鋅、醋酸錳、鈦酸四正丁酯及醋酸鋅/醋酸錳為催化劑,催化劑及用量見表2。

表2 NDC和EG酯交換反應催化劑及其用量
選取不同的a,b值,應用式(8)、式(9)做動力學曲線,如圖1所示。
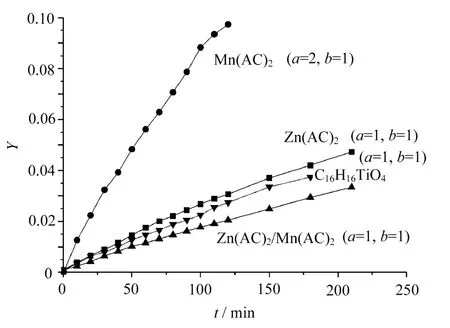
圖1 NDC與EG酯交換反應動力學曲線
由圖1可見,對不同催化劑,NDC與EG酯交換反應遵循不同的動力學規律。以醋酸鋅、鈦酸四正丁酯及醋酸鋅/醋酸錳做NDC與EG酯交換反應催化劑時,NDC與EG酯交換反應基本遵循二級反應動力學,對NDC及EG均為一級反應;以醋酸錳做NDC與EG酯交換反應催化劑時,NDC與EG酯交換反應基本遵循三級反應動力學,對NDC為二級反應,對EG為一級反應。
2.2 催化劑用量對NDC與EG反應動力學的影響
選反應溫度為195℃,EG/NDC摩爾比為2.5,以Zn(CH3COO)2為NDC與EG酯交換反應催化劑,其用量分別為1×10-4,3×10-4,6× 10-4,9×10-4,12×10-4,15×10-4mol/mol NDC,進行實驗,選取不同的a,b值,應用式(8)和式(9)做動力學曲線,分別如圖2和圖3所示。
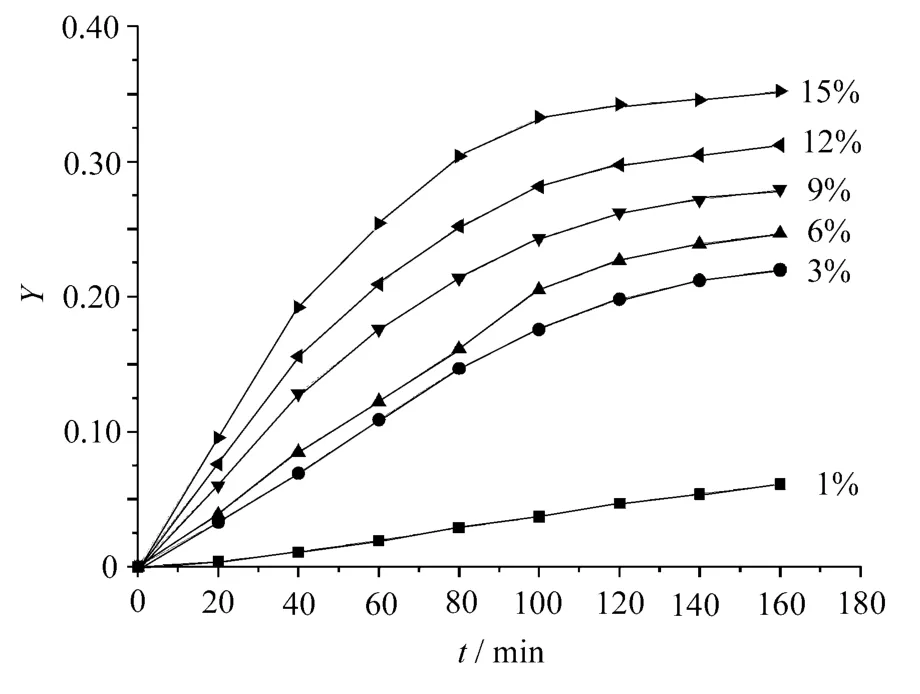
圖2 a=1,b=1時NDC與EG酯交換反應動力學曲線
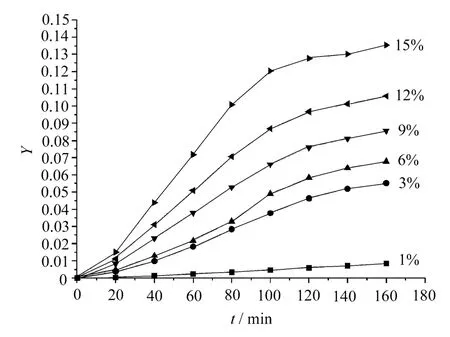
圖3 a=2,b=1時NDC與EG酯交換反應動力學曲線
從圖中可見,隨著催化劑用量增加,反應速率加快。當催化劑用量小于3×10-4時,NDC與EG酯交換反應遵循二級反應動力學,對NDC和EG都是一級反應;當催化劑用量小于9×10-4時,NDC與EG酯交換反應基本符合三級反應動力學,對NDC為二級反應,對EG為一級反應;當催化劑用量大于9×10-4時,NDC與EG酯交換反應都不能很好地符合上述幾種模擬動力學曲線,反應過程更加復雜。
2.3 EG/NDC摩爾配比對NDC與EG反應動力學的影響
選取醋酸鋅為催化劑,其用量為3×10-4mol/mol NDC,反應溫度為195℃,EG/NDC摩爾比分別為2.0,2.2,2.5,3.5,選取不同的a,b值,應用式(8)和式(9)做動力學曲線,如圖4和圖5所示。
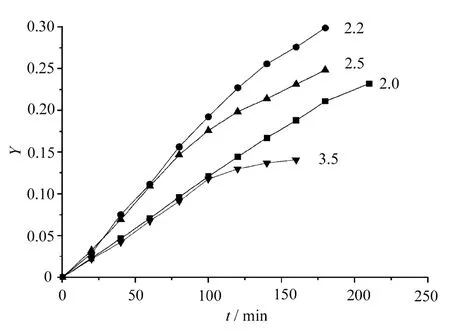
圖4 a=1,b=1時NDC與EG酯交換反應動力學曲線
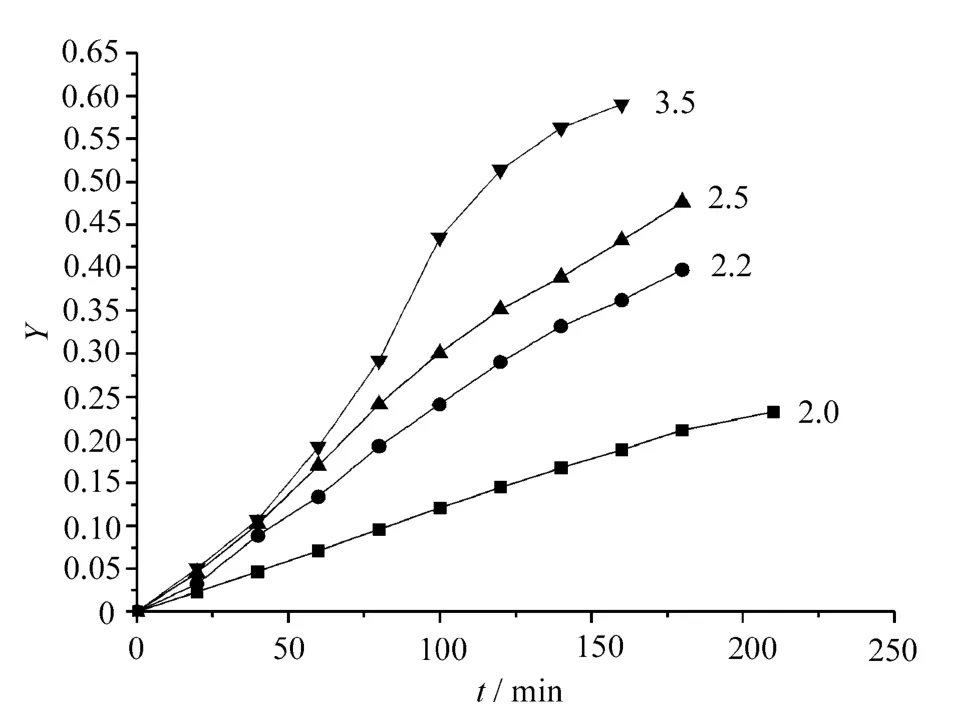
圖5 a=2,b=0時NDC與EG酯交換反應動力學曲線
從圖中可見,隨著EG/NDC摩爾配比增加,反應速率加快。在所研究的范圍內,NDC與EG酯交換反應基本遵循二級反應動力學。當EG/NDC摩爾比為2.0時,對NDC及EG均為一級反應;當EG/NDC摩爾配比為2.2,2.5及3.5時,對NDC為二級反應,對EG為零級反應,這說明EG大量過量時,NDC與EG酯交換反應速率與EG的濃度無關。
3 結 語
NDC與EG酯交換反應并不是單純地遵循二級反應動力學。催化劑種類、催化劑用量、反應溫度、EG/NDC摩爾比均對反應動力學方程有影響。以醋酸鋅、鈦酸四正丁酯及醋酸鋅/醋酸錳催化劑時,反應遵循二級反應動力學,對NDC及EG均為一級反應;以醋酸錳做NDC與EG做催化劑時,反應遵循三級反應動力學,對NDC為二級反應,對EG為一級反應。當醋酸鋅用量小于3×10-4時,NDC與EG酯交換反應遵循二級反應動力學;當醋酸鋅用量小于9×10-4時,NDC與EG酯交換反應基本符合三級反應動力學;當醋酸鋅用量大于9×10-4時,NDC與EG酯交換反應過程更加復雜。EG/NDC摩爾比在2.0~3.5,NDC與EG酯交換反應基本遵循二級反應動力學,當EG大量過量時,NDC與EG酯交換反應速率與EG的濃度無關。
[1] 劉桂云,喬遷,韓毅軍,等.新型聚酯PEN的研究開發及應用[J].溫州師范學院學報:自然科學版,2005,26(2):73-79.
[2] 鄒盛歐.聚丙烯的改性與加工[J].現代塑料加工應用,1999,11(5):60-64.
[3] 王克政,左志俊,宋厚春,等.聚萘二甲酸乙二酯的合成工藝與應用[J].合成纖維工業,1999,22(3):28-32.
[4] 劉乃青,顧巍,喬遷,等.聚萘二甲酸乙二醇酯(PEN)的優異特性[J].長春工業大學學報:自然科學版,2004,25(2):7-9.
[5] 錢伯章.聚碳酸酯的國內外市場分析[J].化工新型材料,2008,36(1):7-9.
[6] 李琪,賈方方,黃光葆.聚萘二甲酸乙二酯的制備及其性能研究[J].現代化工,2012,32(8):60-64.
[7] Wang C S,Sun Y M.Studies on the formation of PENⅠkinetic A spects of catalyed reaction in transesterification of dimethylnapthalate with ethylene glyco[J].Polym.Sci.,Part A:Poly.Chem.,1994,30:1295-1304.
[8] Wang C S,Sun Y M.Studies on the formation of PENⅡpolymerization of bischydroxyethyl naphthalate by various metallic catalysts[J].Polym. Sci.,Part A:Poly.Chem.,1994,32:1305-1315.
[9] PAN Zhu-Ren.Polymer chemistry[M].3rd Edition.Beijing:Chemical Industry Press,2003:181-214.
[10] SHI Zi-Jin.Foundation of polymer reaction engineering[M].Beijing:Chemical Industry Press,1991.

