黃瓜子不同提取部位對體外培養大鼠成骨細胞的影響
裴啟洋, 佟 鑫, 賈天柱
(遼寧中醫藥大學,遼寧省中藥炮制工程技術研究中心,遼寧 大連 116600)
黃瓜子為葫蘆科植物黃瓜CucumbersativusL.的干燥成熟種子。《中華本草》中記載黃瓜子具有續筋接骨、祛風、消痰的功效,主治骨折筋傷、風濕痹痛、老年痰喘[1],在民間多用于接骨療傷,近年收載于《遼寧省中藥材標準》[2]。黃瓜子在許多復方中有應用且作用明顯,如骨折挫傷散等。但其接骨作用機制及在骨代謝過程中的細胞生物學作用尚未見報道,因此為了研究其藥理藥效作用,本實驗選取細胞增殖、骨鈣素水平及堿性磷酸酶活性為指標,觀察了生制黃瓜子不同提取部位及含藥血清對成骨細胞增殖、分化的影響,以此來評價黃瓜子對成骨細胞的作用,并為探討黃瓜子接骨作用機理及臨床應用提供科學依據。
1 材料
1.1 藥材 生品黃瓜子購于安徽亳州,經遼寧中醫藥大學藥用植物教研室王冰教授鑒定為葫蘆科植物黃瓜CucumbersativusL.的干燥成熟種子;制品黃瓜子:以溫度計測量鍋底溫度,待溫度上升至120 ℃時,取生品黃瓜子置于鍋內,保持鍋溫條件下炒制2 min至深黃色,取出放涼備用。
1.2 主要試劑 DMEM液體培養基(賽默飛世爾生物化學制品有限公司);胎牛血清(Gibco);胰酶(Gibco);Ⅱ型膠原酶(Gibco);CCK-8(上海生博生物醫藥科技有限公司);骨鈣素放免試劑盒(南京建成生物工程研究所);堿性磷酸酶酶免試劑盒(南京建成生物工程研究所)。
1.3 主要儀器 倒置顯微鏡(Olympus,日本);CO2培養箱(sanyo,日本);Multuskan Mk3型酶標儀(賽默飛世爾儀器有限公司)。
1.4 動物 1 d齡SD新生大鼠及SD雌性大鼠均購自大連醫科大學動物實驗中心,許可證號:SCXK(遼)2008-0002。
2 方法
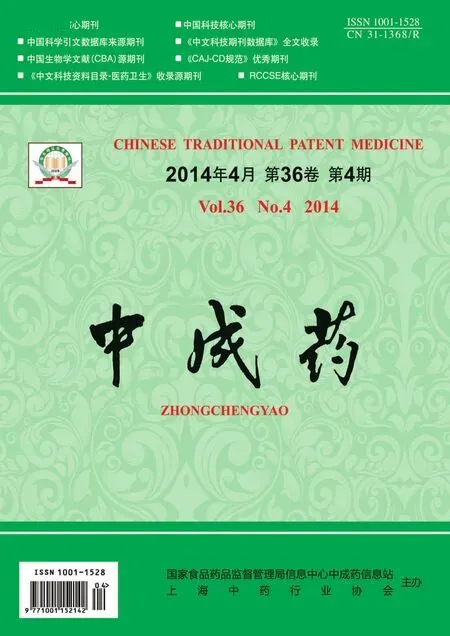
2.1 新生大鼠顱骨成骨細胞的培養[3-5]取1 d齡SD大鼠用75%乙醇消毒5 min后置于培養皿中,取出顱骨,置PBS液內清除骨膜、血管及結締組織等,剪成1 mm2的碎片;將骨片移入0.25%胰酶中,于5%CO2培養箱中37 ℃消化20 min;棄去消化液,加入0.1%Ⅱ型膠原酶,于CO2培養箱中37 ℃消化2 h;用100目篩網將消化液濾過至離心管,加入培養液終止消化,1 000 r/min離心10 min后棄去上清液,向離心管中加入15%胎牛血清的DMEM培養基(以下簡稱血清培養液),用細胞計數板調整細胞密度為5×105/mL, 接種于培養瓶,于5%CO2培養箱中37 ℃培養,24 h后換液,以后每兩日換液一次;待原代細胞(見圖1)80%鋪滿瓶底時以1∶2的比例進行傳代培養,并依上法加血清培養液繼續培養、傳代,取第3代成骨細胞進行實驗。

圖1 原代成骨細胞(20x)
2.2 黃瓜子的提取及含藥血清的制備 取黃瓜子生、制品粗粉,70%乙醇回流提取3次,每次2 h,合并提取液經濃縮后,分別用石油醚、乙酸乙酯、正丁醇萃取。收集各萃取液,蒸干后加純凈水配成相當于飲片生藥量為1 g/mL的藥液,分別為:生品石油醚層、生品乙酸乙酯層、生品正丁醇層、生品水層、制品石油醚層、制品乙酸乙酯層、制品正丁醇層、制品水層。取SD雌性大鼠隨機分為9組,每組6只,其中8組分別為生品石油醚層、生品乙酸乙酯層、生品正丁醇層、生品水層、制品石油醚層、制品乙酸乙酯層、制品正丁醇層、制品水層,用藥劑量根據黃瓜子臨床成人一日用量[2]與人和動物體積表面折算和等效劑量比率表[6]進行折算后,按1 mL/100 g給藥量灌胃上述提取的相應藥液,剩余一組灌胃生理鹽水,記為空白對照組,每日1次,連續7 d,最后一次給藥后2 h,用3%的水合氯醛腹腔注射麻醉(1 mL/100 g),腹主動脈取血,離心得血清,-20 ℃保存備用。
2.3 細胞培養試藥的制備 在預實驗中根據黃瓜子臨床成人一日用量[2]與人和動物體積表面折算和等效劑量比率表[6]進行了嚴謹的量效關系考察,最終確定兩種培養液的配制方法與給藥劑量如下。
2.3.1 含藥培養液 將“2.2”項下提取的黃瓜子生、制品各提取部位蒸干稱定質量,溶于DMSO中,配成相當于飲片含黃瓜子提取物為50 mg/mL的藥液,再加無血清培養液將其稀釋至5×10-2mg/mL,0.22 μm過濾除菌,得含藥培養液,-20 ℃保存備用。
2.3.2 含藥血清培養液 將“2.2”項下所得血清室溫融化,再加無血清培養液將其稀釋至含15%含藥血清的培養液,0.22 μm過濾除菌,得含藥血清培養液,-20 ℃保存備用。
2.4 細胞加藥培養及檢測[7-8]
2.4.1 黃瓜子不同提取部位對成骨細胞增殖的影響 選擇第3代成骨細胞,用血清培養液調配細胞密度為0.5×105/mL,鋪入96孔板,每孔200 μL,培養24 h后換無血清培養液繼續培養24 h后,棄去培養液;向96空孔板中加入“2.3”項下制備的培養液,每藥重復4孔,每孔200 μL,培養48 h后棄去培養液(以制品正丁醇組為例,加藥培養前后見圖2,圖3),每孔加入CCK-8試劑50 μL,培養4 h后,用酶標儀于405 nm處測定其吸光度值,所得吸光度值用SPSS統計學軟件進行處理,計算公式如下:細胞增殖率=[(A加藥-A對照)/A對照]×100%

圖2 加藥培養前的成骨細胞(10×)
2.4.2 黃瓜子不同提取部位對成骨細胞內骨鈣素水平及堿性磷酸酶活性的影響 參照“2.4.1”項下加藥培養細胞的方法,加藥培養48 h后棄去培養液,加入0.25%胰酶消化細胞,吸出細胞懸液至EP管中,反復凍融以使細胞破碎,其上清液以雙抗體夾心酶聯免疫法測定骨鈣素水平,以微量酶標法測定堿性磷酸酶活性。
3 結果
3.1 黃瓜子對成骨細胞增殖的影響 生、制黃瓜子不同提取部位的含藥培養液及含藥血清對成骨細胞的增殖均有明顯的促進作用,結果見表1~2。
3.2 黃瓜子對成骨細胞骨鈣素水平的影響 生、制黃瓜子正丁醇及乙酸乙酯提取部位的含藥培養液及含藥血清對成骨細胞骨鈣素的合成有一定促進作用,結果見表3~4。
3.3 黃瓜子對成骨細胞堿性磷酸酶活性的影響 生、制黃瓜子正丁醇及乙酸乙酯提取部位的含藥培養液及含藥血清對成骨細胞堿性磷酸酶活性有一定促進作用,結果見表5~6。
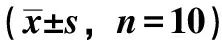
表1 含藥培養液對成骨細胞增殖的影響
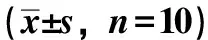
表2 含藥血清培養液對成骨細胞增殖的影響
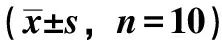
表3 含藥培養液對成骨細胞骨鈣素水平的影響
4 討論
成骨細胞是骨代謝過程中的主要功能細胞,負責骨基質的合成、分泌和礦化,并在骨修復過程中與破骨細胞相互協調,參與破骨細胞骨吸收功能的調節,在骨代謝過程中有極為重要的作用。成骨細胞數量不足或功能減退都會影響骨的修復過程,并可能引發骨質疏松癥等骨疾病,因此提高成骨細胞的增殖和分化水平是防治此類疾病的關鍵[9]。所以本實驗選取成骨細胞增殖、骨鈣素水平及堿性磷酸酶活性為指標,觀察生制黃瓜子不同提取部位及其含藥血清對體外培養成骨細胞增殖及分化的影響,來評價黃瓜子在骨代謝過程中對成骨細胞的作用。

表4 含藥血清培養液對成骨細胞骨鈣素水平的影響
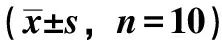
表5 含藥培養液對成骨細胞堿性磷酸酶活性的影響
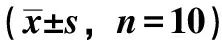
表6 含藥血清培養液對成骨細胞堿性磷酸酶活性的影響
成骨細胞在體內外均可增殖,而成骨細胞數量的增加會生成更豐富的膠原,促使生成更多的骨組織;反之,成骨細胞過度凋亡導致骨形成量不足,就會引發骨折和骨質疏松等疾病[10]。本實驗結果顯示黃瓜子各提取部位對成骨細胞增殖均具有促進作用,說明黃瓜子的接骨作用是通過加快成骨細胞的生長,達到促進骨形成和修復的目的。
骨鈣素又稱骨γ-羧基谷氨酸蛋白,是由成骨細胞和成牙骨質細胞特異合成和分泌的一種非膠原蛋白,是構成骨基質的成分之一,為骨基質中含量最多的非膠原蛋白,其功能是保證骨的正常礦化[11],是成骨細胞分化的標志之一。堿性磷酸酶由成骨細胞分泌,它既可做為成骨細胞的功能標記物,又可反映其分化成熟程度,是成骨細胞分化的特異性標志[12]。本實驗結果顯示生制黃瓜子正丁醇及乙酸乙酯提取部位能促進成骨細胞的骨鈣素分泌及提高堿性磷酸酶活性,說明該提取部位的化學成分能促進成骨細胞的分化與成熟,生成更多的骨基質來實現接骨作用。
另外實驗結果顯示炮制品作用普遍優于生品,這可能是因為黃瓜子經炮制后其有效化學成分的溶出度增加,或者炮制過程中發生了化學成分的轉化致使有效成分總量增加,有待進一步研究。
目前,在研究中藥對體外細胞的作用時,多采用將中藥提取液直接與細胞共同培養的模式。本實驗為盡量模擬體內環境,在采用中藥提取液直接與細胞共同培養模式的同時,還進行了含藥血清與細胞培養液共同培養,以分析藥物進入體內經代謝后對成骨細胞的影響。對促成骨細胞生長與分化過程中起主要作用的乙酸乙酯層及正丁醇層,其相應含藥血清組與原含藥培養液組相比,在實驗結果上并未體現出明顯差別,說明黃瓜子中促進成骨細胞生長與分化的化學成分受胃腸道及血液代謝的影響很小;空白血清組相較無血清組其成骨細胞骨鈣素水平與堿性磷酸酶活性也有一定提高,提示大鼠血清中也含有可以促進成骨細胞分化與成熟的成分。
黃瓜子正丁醇提取部位在成骨細胞增殖、骨鈣素水平及堿性磷酸酶活性實驗中均體現了比其他提取部位更強的促進作用,提示黃瓜子提高成骨細胞增殖和分化水平進而促進骨形成及修復過程的物質基礎主要存在于正丁醇提取部位。另外巴戟天[13]、狗脊[5]等藥物作用于成骨細胞的提取部位同為正丁醇層,提示各中藥對成骨細胞起促進作用的成分可能主要集中在正丁醇提取部位,有可能為一類具有相似結構或性質相近的化合物,這為繼續研究該類藥物對成骨細胞的作用機制提供了新思路。
參考文獻:
[1] 國家中醫藥管理局《中華本草》編委會.中華本草:第5卷[M].上海:上海科學技術出版社,1999:522.
[2] 遼寧省食品藥品監督管理局.遼寧省中藥材標準:第1冊[M].沈陽:遼寧科學技術出版社,2009:175-179.
[3] Wang Xi, Huang Jian, Zhang Tianlan,etal. Cytoskeleton reorganization and FAK phosphorylation are involved in lanthanum (III)-promoted proliferation and differentiation in rat osteoblasts[J].ProNatSci,2009,19(3):331-335.
[4] 邢國勝,談志龍,王淑云,等.補腎健骨湯對成骨細胞增殖及堿性磷酸酶、骨鈣素合成的影響[J].中草藥,2001,32(11):1020-1022.
[5] 于海濤,李 慧,賈天柱,等. 狗脊炮制品中促進成骨細胞增殖分化成分的篩選[J].中成藥,2012,34(6):1139-1142.
[6] 李儀奎.中藥藥理實驗方法學[M]. 2版.上海:上海科學技術出版社,2006:589.
[7] Zhang Dawei, Cheng Yan, Zhang Jinchao,etal. Cytotoxic effects of flavonol glycosides and nonflavonoid constituents of Epimedium koreanum on primary osteoblasts[J].PharmBiology,2008,46(3) : 185-190.
[8] Harada S I, Rodan G A. Control of osteoblast function and regulation of bone mass[J].Nature,2003,423(6937) : 349-355.
[9] 孔祥鶴,牛銀波,王婷梅,等.黃芪多糖對大鼠原代成骨細胞的影響及其機制研究[J].中草藥,2011,42(10):2065-2069.
[10] Weinstein R S,Manolagas S C.Apoptosis and osteoporosis[J].AmJMed,2000,108(2):153-164.
[11] Lian J B, Gunderg C M. Osteoealcin.Biochemical consideration and clinial applications[J].ClinOrthopRelRes,1987,226(2):267-270.
[12] 安亞蘭,王建舫,許水明,等.補骨脂水提液及補骨脂素對體外培養成骨細胞的影響[J].畜牧獸醫學報,2009,40(2) : 266-271.
[13] 凌 昆,趙 詣,郭素華.巴戟天藥物血清對成骨細胞生物學特性的影響[J].中華中醫藥雜志,2010,25(6):846-849.