辛通暢絡法對系膜增生性腎炎模型大鼠IL-1、IL-6和細胞外基質的影響
支勇 竇一田 曹式麗
(天津中醫藥大學第一附屬醫院,天津 300193)
辛通暢絡法對系膜增生性腎炎模型大鼠IL-1、IL-6和細胞外基質的影響
支勇 竇一田 曹式麗
(天津中醫藥大學第一附屬醫院,天津 300193)
目的:觀察辛通暢絡中藥復方腎蘇Ⅱ對系膜增生性腎炎(MsPGN)模型大鼠腎組織白介素1(IL-1)、白介素6(IL-6)及腎小球細胞外基質(ECM)的影響,探討中醫藥防治MsPGN的有效途徑。方法:采用抗Thy-1系膜增生性腎炎大鼠模型,以中藥復方腎蘇Ⅱ為治療藥物,貝那普利為對照藥物,于治療6周末,分別觀察各組大鼠腎組織IL-1、IL-6和腎小球纖維連接蛋白(FN)、層粘連蛋白(LN)和Ⅳ型膠原(ColⅣ)表達的變化情況。結果:治療6周末,中藥組在抑制MsPGN大鼠腎組織IL-1、IL-6表達,減少腎小球FN、LN、ColⅣ表達量等方面顯示療效優勢,且均明顯優于西藥組。結論:以辛通暢絡立法的中藥復方腎蘇Ⅱ,具有減輕MsPGN模型大鼠腎小球ECM積聚,改善腎小球硬化的作用。
系膜增生性腎炎 辛通暢絡 中藥復方 白介素 腎小球細胞外基質 實驗研究
系膜增生性腎小球腎炎(MsPGN)是臨床常見的腎小球疾病的病理類型,在我國原發性腎病綜合征中MsPGN高達30%[1],成為導致腎小球硬化進而發展為晚期腎功能衰竭的主要疾病。MsPGN的組織學特征為腎小球系膜細胞的異常增生和系膜基質的病理性積聚。在MsPGN的病變過程中,細胞因子起到重要作用,如IL-1、IL-6等。本研究采用抗大鼠胸腺細胞抗體(Anti-Thy-1)誘發MsPGN大鼠模型,觀察腎蘇Ⅱ對腎組織IL-1、IL-6和腎小球基質成分FN、LN和ColⅣ表達的影響。
1 實驗材料
1.1 實驗動物健康雄性日本大耳白兔4只,體重(1250± 250)g,普通級;遠交系健康雄性SD大鼠40只[10周齡,體重(150±10)g],幼齡SD大鼠10只(4周齡),SPF/VAF級。以上實驗動物均由中國醫學科學院放射醫學研究所動物中心提供(合格證號:SCXK津2005-0001)。
1.2 實驗試劑完全福氏佐劑與不完全福氏佐劑(Sigma公司);IL-1、IL-6試劑盒(尚柏生物醫學技術北京公司);FN、LN、ColⅣ試劑盒(Labvision公司)。
1.3 實驗藥物腎蘇Ⅱ,處方:柴胡12g,黃芩10g,生黃芪30g,當歸10g,女貞子15g,澤蘭15g,水蛭10g,細辛3g,煎煮濃縮(含0.85g生藥/mL),裝瓶密封,置4℃冰箱保存備用。藥物購自天津中醫藥大學第一附屬醫院中藥房,加工由天津中醫藥大學藥廠協助完成。苯那普利:瑞士諾華制藥有限公司產品,規格:10mg/片,批號:06031404。
2 實驗方法
2.1 動物分組40只大鼠適應性飼養1周后,按體重分層隨機分為正常組、模型組、西藥組和中藥組,每組10只。
2.2 模型復制參考文獻[2-4]復制抗Thy-1系膜增生性腎炎大鼠模型。大鼠30只,經尾靜脈注射兔抗鼠胸腺細胞抗體血清(ATS),每周1次,連續3周,初次注射ATS(1∶32)1.0mL/只,加強注射ATS(1∶16)1.0mL/只。
2.3 給藥方法自MsPGN模型制備第1天起,中藥組每日1次以3.5g/100g體重灌服腎蘇Ⅱ,西藥組每日1次以0.33mg/100g體重灌服貝那普利混懸液,正常組與模型組每日1次灌服等量生理鹽水,共進行6周。實驗全程各組均給予普通飼料喂養,自由進水。實驗過程中因灌胃誤入氣管,中藥組于治療第4周初死亡1只,其他各組實驗過程中無動物死亡。
2.4 標本采集于給藥后第6周末殺檢全部大鼠,打開腹腔,摘取腎臟,迅速剪取部分腎組織放入凍存管并置于液氮中凍存,用于腎組織IL-1、IL-6檢測;另再取部分腎臟組織置于10%福爾馬林中固定,用于腎小球FN、LN、ColⅣ檢測。
2.5 檢測指標采用雙抗體夾心ELISA法檢測腎組織IL-1、IL-6。采用免疫組化ABC法檢測腎小球FN、LN、ColⅣ。采用HMIAS-2000高清晰度彩色病理圖像分析系統,于400倍高倍鏡下,每個標本隨機選取10個視域,測量腎小球FN、LN、ColⅣ表達的陽性反應物信號的面積比(陽性信號物質占腎小球體的面積百分比),分析各組大鼠腎小球FN、LN、ColⅣ表達的相對水平,評價各組腎小球ECM增殖程度。
2.6 統計學方法實驗數據應用SPSS13.0統計軟件進行分析,各組實驗數據以(±s)表示,對實驗數據進行單因素方差分析,檢驗結果以P<0.05為有統計學意義。
3 實驗結果
3.1 各組大鼠腎組織IL-1、IL-6的表達實驗結果顯示,給藥6周末,模型組、西藥組、中藥組大鼠腎組織IL-1、IL-6表達均較正常組明顯增加(P<0.01,P<0.05);西藥組、中藥組明顯低于模型組(P<0.05,P<0.01);中藥組明顯低于西藥組(P<0.05)。見表1。
表1 各組大鼠給藥6周后腎組織IL-1、IL-6的表達(±s)pg/mL

表1 各組大鼠給藥6周后腎組織IL-1、IL-6的表達(±s)pg/mL
注:與正常組比較,*P<0.05,**P<0.01;與模型組比較,#P<0.05,##P<0.01;與西藥組比較,△P<0.05。
組別動物數IL-1IL-6正常組1068.76±43.11270.00±118.64模型組10西藥組10213.21±180.76**#499.90±245.99**#中藥組9171.58±113.34*##△325.46±193.05*##△291.21±189.23**523.71±167.73**
3.2 各組大鼠腎小球FN、LN、ColⅣ的表達量比較實驗結果顯示,給藥6周末,模型組、西藥組、中藥組大鼠腎小球FN、LN、ColⅣ的表達量較正常組不同程度增加(P<0.05,P<0.01);其中模型組的表達量最高,中藥組明顯低于模型組(P<0.01)與西藥組(P<0.05,P<0.01)。見表2。
表2 各組大鼠給藥6周后腎小球FN、LN、ColⅣ的表達量比較(±s)%
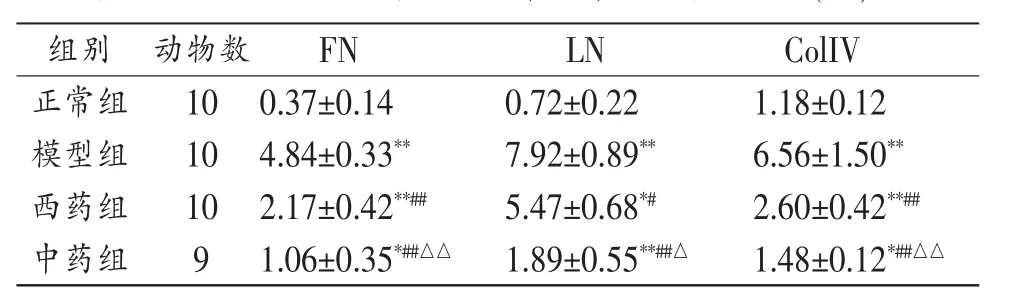
表2 各組大鼠給藥6周后腎小球FN、LN、ColⅣ的表達量比較(±s)%
注:與正常組比較,*P<0.05,**P<0.01;與模型組比較,#P<0.05,##P<0.01;與西藥組比較,△P<0.05,△△P<0.01。
組別動物數FNLN ColIV正常組100.37±0.140.72±0.221.18±0.12模型組10西藥組102.60±0.42**##中藥組91.48±0.12*##△△4.84±0.33**7.92±0.89**2.17±0.42**##5.47±0.68*#1.06±0.35*##△△1.89±0.55**##△6.56±1.50**
4 討論
MsPGN以腎小球系膜細胞(MsC)的異常增生和細胞外基質(ECM)的病理性積聚為特征。腎小球系膜細胞是系膜區分泌合成ECM的主要細胞,ECM的過度生成和積聚是MsPGN病變的關鍵機制。本實驗中MsPGN模型組大鼠腎小球FN、LN、ColⅣ等ECM成分的表達量顯著增加,表明腎小球ECM的大量合成與積聚是導致MsPGN,并發展形成腎小球硬化的重要環節。針對此環節,通過抑制系膜細胞的異常增生,進而減少ECM的大量合成,應該是防治MsPGN的有效手段。
IL-1、IL-6是MsPGN中參與免疫調節和介導炎癥反應的細胞因子,同時也是重要的系膜細胞增殖促進因子。IL-1對系膜細胞的增殖和產生ECM具有促進作用,而且系膜細胞本身也可通過自分泌方式產生具有生物活性的IL-1并表達其受體。Werber等[5]研究發現在免疫復合物性腎炎大鼠腎小球系膜細胞的IL-1mRNA表達量比正常大鼠增加2~3倍,表明免疫復合物性腎炎大鼠腎小球系膜細胞能夠持續分泌大量的IL-1,刺激系膜細胞增殖及大量合成ECM。IL-6是促進系膜細胞增殖和產生ECM的另一重要細胞因子,也是系膜細胞自分泌的調節因子。正常腎臟能產生微量的IL-6并表達IL-6受體,而當腎小球系膜細胞受到病理因素的刺激后分泌IL-6異常增多,與受體結合刺激系膜細胞增殖,促進ECM的大量合成與積聚。如Horii等[6]研究顯示MsPGN的系膜細胞能分泌IL-6,并被IL-6所作用而進一步增殖。由于IL-1、IL-6是具有促進系膜細胞增殖作用的細胞因子,因此通過抑制IL-1、IL-6的表達來阻抑系膜細胞增殖及ECM的合成可成為防治MsPGN的有效途徑[5,7]。
中醫學認為絡脈是氣血運行通道,亦是病邪傳變途徑,具有易瘀易滯、易積成形的病理特點。腎為藏精貯液之臟,又為利水排毒之官,腎臟絡脈暢通、氣血充盈是其生理功能的前提,而腎氣虛弱作為慢性腎臟病的內在病理基礎,與瘀血、濕濁、熱毒、外邪等病理因素相互影響,久病入絡,致腎之精血虛損,腎絡郁滯,故腎絡樞機不利,因虛致實,腎絡郁滯是MsPGN等多種慢性腎臟病的共同病理基礎。腎蘇Ⅱ是以“樞機不利,腎絡郁滯,虛實錯雜”為MsPGN病機關鍵,形成以“標本兼治、辛通腎絡”為法的中藥復方制劑。方中柴胡、黃芩暢達三焦,樞轉氣機;黃芪、當歸益氣補血,扶正理虛;細辛、水蛭辛通暢絡,化瘀消滯。諸藥協同,疏導調節,養臟和絡,促進腎絡氣血調暢。應用本方干預MsPGN大鼠模型,結果顯示腎蘇Ⅱ能夠顯著降低MsPGN大鼠腎組織IL-1、IL-6的表達量,同時減少腎小球FN、LN、ColⅣ等ECM成分的合成,減輕腎小球系膜基質增生。通過上述IL-1、IL-6的促系膜細胞增殖及ECM增生的作用機制,我們推斷腎蘇Ⅱ防治MsPGN的機理可能是通過抑制MsPGN大鼠腎組織IL-1、IL-6的生成,減輕其對系膜細胞增殖的病理性作用,進而減少系膜細胞合成FN、LN、ColⅣ等ECM成分,達到阻抑腎小球系膜增生,防治腎小球硬化的效果。
[1]葉任高,主編.中西醫結合腎臟病學.北京:人民衛生出版社,2003:229
[2]Nomura K,Liu N,Nagai K,et al.Roles of coagulation pathway and factor Xa in rat mesangioproliferative glomerulonephritis.Lab Invest,2007,87(2):150
[3]劉靜芳,溫進坤,嚴霞,等.抗胸腺細胞血清法誘發大鼠系膜增殖性腎炎模型.中國病理生理雜志,1999,15(3):274
[4]Shinosaki T,Notoya M,Nomura Y,et al.Glomerular epithelial cell injury accelerates the progression of antibody -induced mesangial proliferative nephritis.Exp Nephrol,2002,10(4):245
[5]Werber HI,Emancipator SN,Tykocinski ML,et al.The interleukin 1 gene is expressed by rat glomerular mesangial cells and is augmented in immune complex glomerulonephritis.J Immunol,1987,138(10):3207
[6]Horii Y,Muraguchi A,Iwano M,et al.Involvement of IL -6 in mesangial proliferative glomerulonephritis.J Immunol,1989,143 (12):3949
[7]Shima Y,Iwano M,Yoshizaki K,et al.All -trans -retinoic acid inhibits the development of mesangial proliferative glomerulonephritis in interleukin -6 transgenic mice.Nephron Exp Nephrol,2005,100(1):54
R692.310.5
A
1672-397X(2014)01-0075-02
支勇(1974-),男,醫學博士,主治醫師,從事中西醫結合治療腎臟疾病的臨床與基礎研究。
曹式麗,shilicao@126.com
2013-09-26
編輯:吳寧
國家自然科學基金項目(30772808)

