扛板歸及苦菜黃酮類物質超聲波提取工藝優化及其抗氧化活性
李 偉
(1.湖北民族學院 生物科學與技術學院,湖北 恩施 445000;2.湖北民族學院 湖北省生物資源保護與利用重點實驗室,湖北 恩施 445000)
扛板歸(Polygonum perfoliatum L.)又名河白草、地葡萄,分布于全國各地,生長在山野、路旁、荒地或河岸的草叢、灌叢中,資源豐富[1]。扛板歸的化學成分主要有黃酮苷、蒽苷、強心苷、酚類、鞣質等,據《中藥大辭典》記載,扛板歸以其根和地上部全草入藥,具有利水消腫、清熱活血、解毒等功效[2-4]。目前多以全草藥效進行研究,對其所含黃酮成分的藥用和食用價值的開發利用尚未見報道。苦菜(Sonchus oleraceus L.)在我國很早就被當作一種野菜食用,屬無毒害純天然綠色食品,具有很高的營養價值和明顯的抗氧化作用[5-6]。由于利用超聲波產生的強烈振動、高的加速度、強烈的空化效應、攪拌作用等,可加速植物材料中的有效成分進入溶劑從而增加有效成分的提取率,縮短提取時間,并且可避免高溫對提取成分的影響[7-9]。本研究主要以扛板歸為原料,采用超聲波對其黃酮提取工藝進行優化,并用優化的工藝浸提苦菜黃酮,而后對比2種原料黃酮的體外抗氧化作用,以期為扛板歸和苦菜資源的開發利用提供新的信息資料。
1 材料與方法
1.1 材料與試劑
扛板歸全草、苦菜全草:采于湖北民族學院,洗凈、烘干、粉碎過80目篩備用。
蘆丁(純度≥95%):西安艾沃生物科技有限公司;1,10鄰菲羅啉(鄰二氮菲)(分析純):沈陽市新光化工廠;無水乙醇、亞硝酸鈉、硝酸鋁、氫氧化鈉、硫酸亞鐵、石油醚、過氧化氫、水楊酸(分析純):國藥集團化學試劑有限公司。
1.2 儀器與設備
722S可見分光光度計:上海精密科學儀器有限公司;RE-5220旋轉蒸發器:上海亞榮生化儀器廠;HH-8電子恒溫水浴鍋:深圳國華儀器廠;FA2104電子天平:上海天平儀器廠;800B離心機:上海安亭儀學儀器廠。
1.3 實驗方法
1.3.1 黃酮含量測定方法
NaNO2-Al(NO3)3-NaOH比色法[10-11]。
以蘆丁作為標準品;以蘆丁的質量C(mg)為橫坐標,以吸光度值A510nm為縱坐標繪制標準曲線,標準曲線方程為A510nm=0.007 5+1.235 2C,r=0.999 6。樣品中黃酮含量計算式:
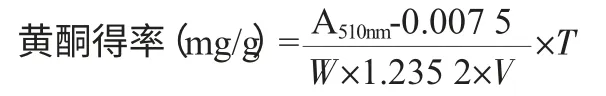
式中:T 為供試液總體積,mL;V 為測定時吸取的樣品體積,mL;W 為樣品質量,g;A 為510nm 波長下測定吸光度值。
1.3.2 扛板歸黃酮的提取工藝優化
首先對乙醇體積分數、超聲波時間、料液比進行單因素試驗,而后采用L9(33)正交設計,對其提取條件進行優化。
1.3.3 黃酮對羥自由基的清除作用
黃酮在水楊酸體系中對羥自由基的清除作用:參照莫開菊等[12-13]的試驗方法進行測定,利用H2O2與Fe2+混合產生·OH,在體系內加入水楊酸捕捉·OH并產生有色物質,該物質在波長510nm處有最大吸收。反應體系中含6mmol/L H2O2溶液、1.5mmol/L FeSO4溶液、10mmol/L水楊酸-乙醇1mL、不同質量濃度的樣品溶液1mL。最后加H2O2啟動反應,37℃反應0.5h。試劑的加入情況見表1。
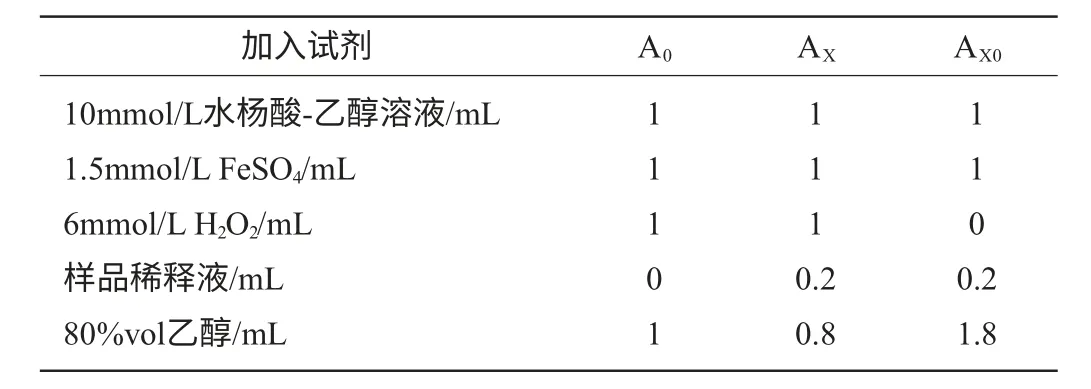
表1 水楊酸體系中加入試劑的方法Table 1 Method of adding reagents in the salicylic acid system

式中:A0為空白溶液吸光度值;AX為加入樣品后的體系吸光度值;AX0為樣品本底吸光度值。
黃酮在鄰二氮菲體系中對羥自由基的清除作用:參照金鳴等[14]的方法進行測定。Fe2+/H2O2體系產生·OH自由基,由于·OH可特異地使鄰二氮菲-Fe2+轉化為鄰二氮菲-Fe3+,從而使紅色褪色,根據反應后體系的褪色程度,可衡量·OH的量。
體系含有0.75mmol/L鄰二氮菲無水乙醇溶液1mL,2mL 0.2mol/L磷酸緩沖液(pH7.4)2mL,0.75mmol/L硫酸亞鐵1mL,樣品溶液0.2mL,混勻后加1mL 0.01%的雙氧水,37℃水浴加熱60min后,在波長536nm處測定吸光度值。分組及各試劑加入方法見表2。
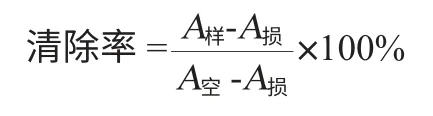
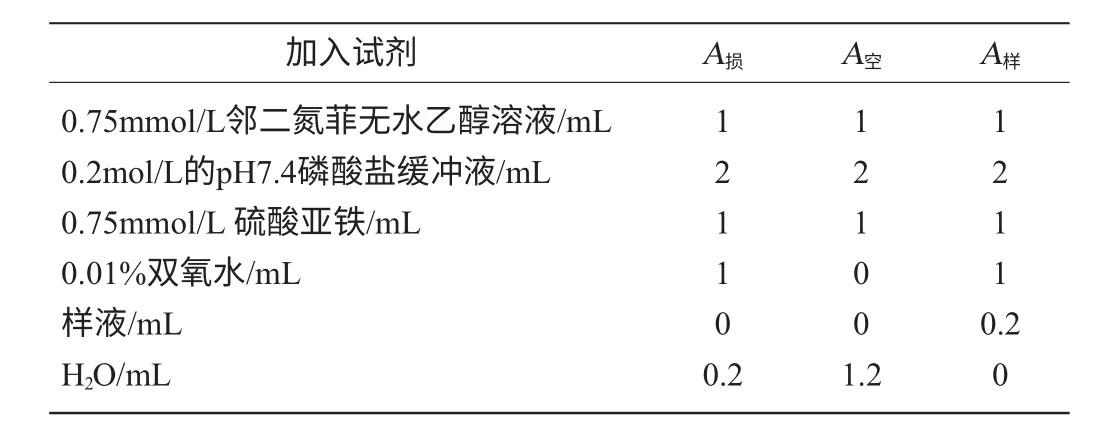
表2 在鄰二氮菲體系內各試劑加入方法Table 2 Method of adding reagent in the phenanthroline system
2 結果分析
2.1 扛板歸黃酮化合物的提取工藝優化
2.1.1 乙醇體積分數對扛板歸黃酮得率的影響
準確稱取0.5g脫脂扛板歸干粉,以1∶30料液比,分別加入體積分數40%、50%、60%、70%、80%、90%、95%的乙醇,超聲波提取30min,浸提結果見圖1。

圖1 乙醇體積分數對黃酮得率的影響Fig.1 Effect of ethanol volume fraction on flavonoids yield
由圖1可以看出,隨乙醇體積分數增加黃酮得率增加,當乙醇體積分數超過70%時黃酮得率反而下降,采用極差法分析[15]乙醇體積分數對扛板歸黃酮得率的影響,乙醇體積分數70%時的黃酮得率與其他水平的得率相比,差異都極顯著。因此選擇最佳乙醇體積分數為70%。
2.1.2 超聲時間對扛板歸黃酮得率的影響
準確稱取0.5g脫脂扛板歸粉末,采用體積分數70%的乙醇,料液比1∶50超聲波處理10min、20min、30min、40min、50min、60min,黃酮浸提結果見圖2。在10~40min內隨超聲處理時間增加,黃酮得率增加,超過40min后,黃酮得率反而逐漸減少,可能是因此超聲波在處理過程中具有一定的熱效應,長時間的超聲波處理使已經浸提出來的黃酮被氧化從而導致含量下降,因比選擇40min為最佳超聲時間。
2.1.3 料液比對扛板歸黃酮得率的影響
準確稱取0.5g脫脂扛板歸粉末,用體積分數70%的乙醇,分別以1∶30、1∶40、1∶50、1∶60、1∶70料液比超聲波處理40min,黃酮浸提結果見圖3。圖3結果表明,料液比越大,黃酮得率越高,但從1∶50開始,增加幅度趨于緩和,采用極差法分析在0.01水平1∶50、1∶60、1∶70料液比對扛板歸黃酮得率的影響差異不顯著,考慮到產業化和環境問題,選擇1∶50為最佳料液比。
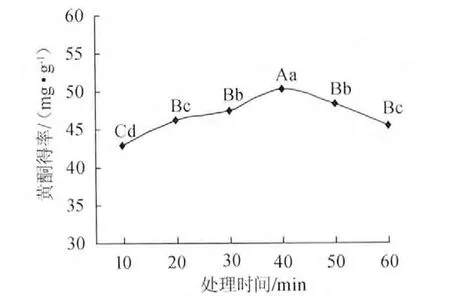
圖2 超聲波處理時間對黃酮得率的影響Fig.2 Effect of ultrasonic time on flavonoids yield
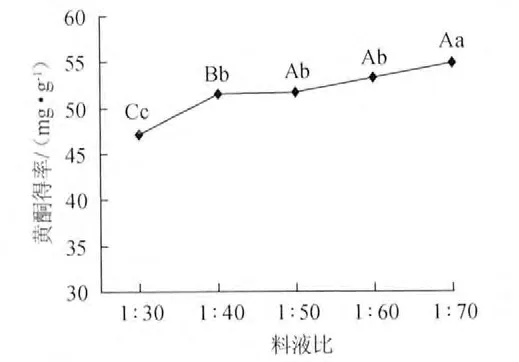
圖3 料液比對黃酮得率的影響Fig.3 Effect of liquid to solid ratio on flavonoids yield
2.1.4 扛板歸黃酮提取工藝優化的正交試驗
扛板歸黃酮提取工藝優化的正交試驗結果如表3。
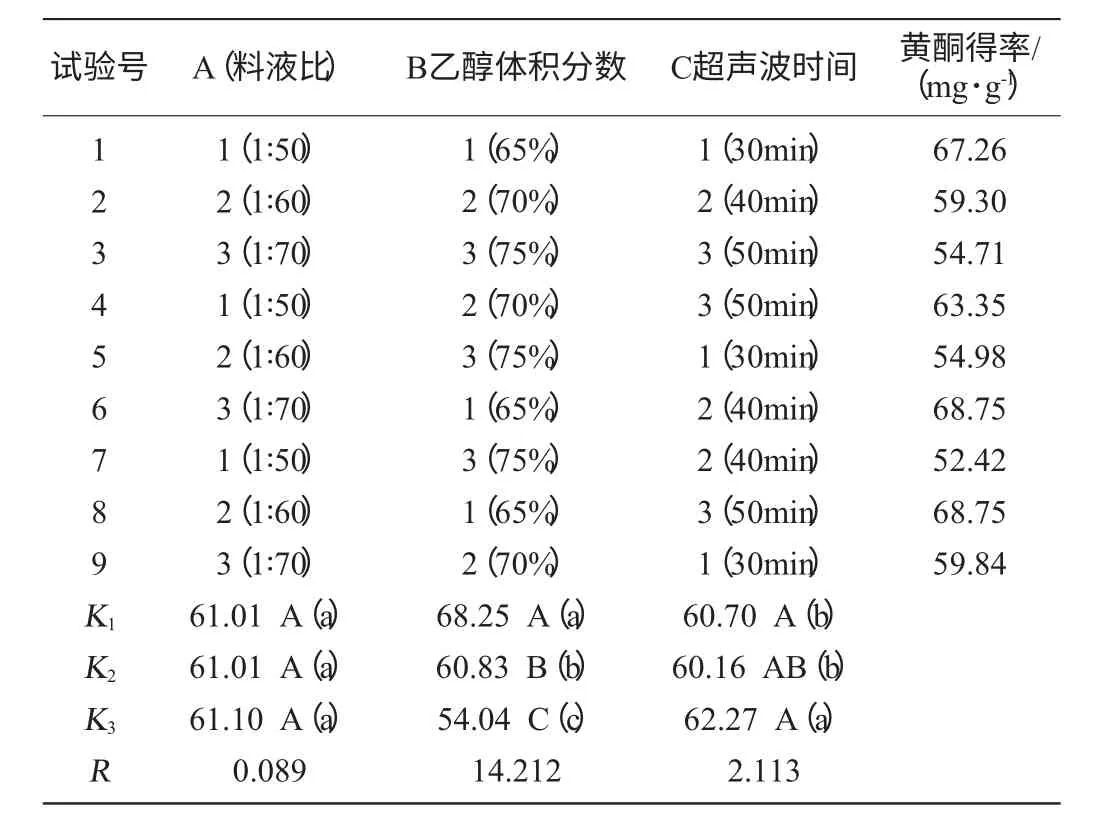
表3 黃酮提取的正交試驗結果與分析Table 3 Results and analysis of orthogonal experiment for optimization of flavonoids extraction
采用SPSS17.0軟件對表3試驗數據進行方差分析[20],結果見表4。

表4 正交試驗方差分析表Table 4 Variance analysis of orthogonal experiment for optimization of flavonoids extraction
由表3、表4可得出超聲波提取黃酮化合物的最佳工藝是A3B1C3,影響其得率的主次因素是B>C>A,即乙醇體積分數最為顯著,其次是超聲時間和料液比。各因素水平的分析(見表3、表4)說明A因素的各個水平間差異并不顯著,B因素的3水平間差異非常顯著,C因素的1、2水平差異不明顯,2、3水平差異較大。按照試驗得出的最佳提取條件組合是A3B1C3,同時由于A因素對得率影響很小,選擇A1水平比A3水平節約成本,可獲得更好的效益。分別以A1B1C3和A3B1C3做驗證試驗,得出苦菜黃酮的得率分別為70.77mg/g和71.18mg/g,二者差異不顯著。在此條件下可得到苦菜黃酮得率為18.54mg/g。
2.2 扛板歸黃酮對自由基的清除作用
2.2.1 扛板歸黃酮在水楊酸體系中對羥自由基的清除作用
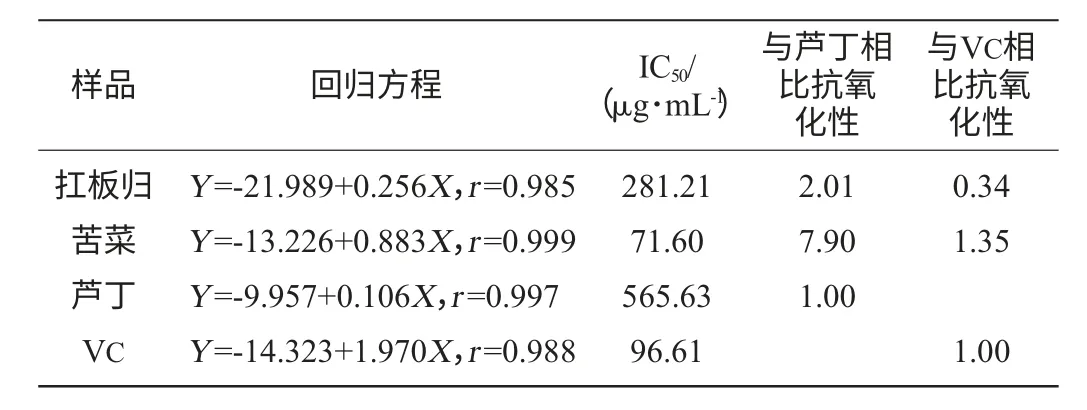
表5 黃酮類物質在水楊酸體系對羥基自由基清除作用Table 5 The scavenging activity of flavonoids on·OH in salicylic acid system
由表5可在,在水楊酸體系,扛板歸黃酮對·OH的清除作用弱于苦菜黃酮,同時扛板歸黃酮對·OH的清除作用強于蘆丁弱于VC;苦菜黃酮對·OH清除作用約是蘆丁的8倍,與VC效果相比,略高于VC。
2.2.2 扛板歸黃酮在鄰二氮菲體系中對羥自由基的清除作用
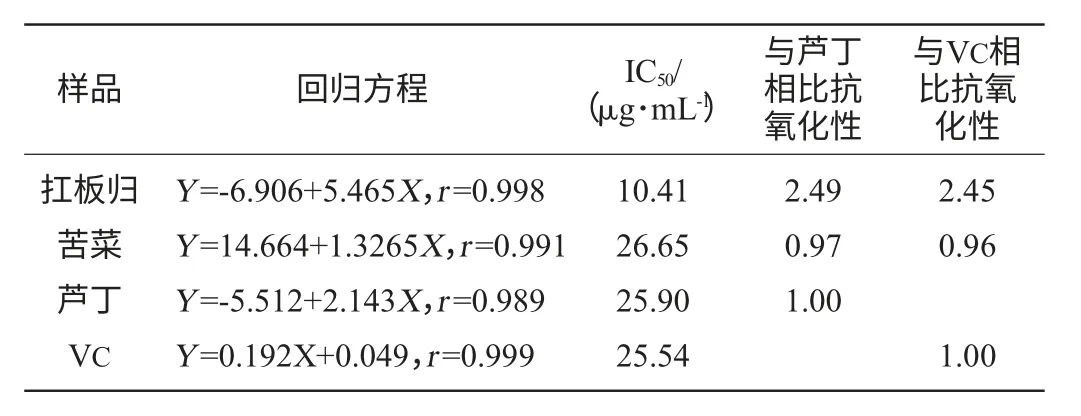
表6 黃酮類物質在鄰二氮菲體系對羥基自由基清除用Table 6 The scavenging activity of flavonoids on·OH in phenanthroline system
由表6可知,在鄰二氮菲體系,苦菜黃酮對·OH的清除作用略弱于蘆丁和VC,大約是VC和蘆丁活性的0.95~0.98倍左右。扛板歸黃酮對·OH的清除作用強于苦菜黃酮的,約是蘆丁和VC活性的2.5倍左右。
3 結論
利用超聲波浸提扛板歸和苦菜黃酮,通過單因素和正交試驗分析,優化出扛板歸黃酮超聲波浸提的最佳條件為1∶50料液比,體積分數65%的乙醇,進行超聲波提取50min,在此條件下,扛板歸黃酮得率為70.77mg/g,苦菜黃酮得率為18.54mg/g。2種原料黃酮對在不同體系中對·OH的清除效果不同,總的來說在水楊酸體系中苦菜黃酮對·OH的清除效果強于扛板歸黃酮,在鄰二氮菲體系正好相反,具體原因還有待于進一步探索。
[1]趙海英,盧兆成,金開美,等.信陽毛尖茶區惡性雜草——扛板歸的生物學特性及防除措施[J].廣東農業科學,2007(11):65-67.
[2]蔣益花,蔣新龍.扛板歸紅色素的提取及穩定性研究[J].中國食品添加劑,2005(6):16-20.
[3]江蘇新醫學院.中藥大辭典(上冊)[M].上海:上海科學技術出版社,2000.
[4]章永紅.抗癌中藥大全[M].南京:江蘇科學技術出版社,2000.
[5]韓陽陽,王天曉,朱海芳,等.苦菜不同部位提取物的抗氧化活性[J].食品科學,2010,31(19):45-48.
[6]周勸娥,田呈瑞,關 為,等.陜西苦菜葉總黃酮的提取及抗氧化活性的測定[J].食品工業科技,2013,34(9):97-102.
[7]謝明杰,宋 明,鄒翠霞,等.超聲波提取大豆異黃酮[J].大豆科學,2004,23(1):75-76.
[8]紀學芳,徐懷德,張淑娟,等.響應面試驗優化超聲波提取光皮木瓜黃酮和多糖復合物[J].食品科學,2013,23(6):47-51.
[9]喬 孟,屈曉清,丁之恩.響應面法優化超聲波輔助提取湖北海棠葉中總黃酮工藝[J].食品科學,2013,34(2):143-147.
[10]周存山,余筱潔,楊虎清,等.油梨皮黃酮提取及大孔樹脂純化[J].農業工程學報,2008,24(8):271-274.
[11]李 濤,趙 云,陳增潔.龍眼核黃酮的微波提取工藝[J].食品研究與開發,2013,34(2):37-39.
[12]莫開菊,柳 圣,程 超.生姜黃酮的抗氧化活性研究[J].食品科學,2006,27(9):110-114.
[13]程 超.麥冬果實藍色素的抗氧化特性研究[J].中國釀造,2009,28(4):58-60
[14]金 鳴,蔡亞欣,李金榮,等.鄰二氮菲-Fe2+氧化法檢測H2O2/Fe2+產生的羥自由基[J].生物化學與生物物理進展,1996,23(6):553-555.
[15]王 頡.試驗設計與SPSS 應用[M].北京:化學工業出版社,2006.

