紹興黃酒熟麥曲制曲過程的宏蛋白質組學研究
張 波,余培斌,陸 健*
(1.浙江經貿職業技術學院,浙江 杭州 310018;2.江南大學 糧食發酵工藝及技術國家工程實驗室,江蘇 無錫 214122)
麥曲在黃酒釀造中占有極重要的地位,不僅是糖化發酵的粗酶制劑,而且其代謝產物能賦予黃酒特定的風味與口感,因此麥曲又有“酒之骨”的美譽[1]。20世紀60年代起,為適應黃酒現代化生產需要,在對傳統生麥曲的繼承和發展的基礎上,開始推廣應用熟麥曲。熟麥曲是將小麥蒸熟后,殺死原料中的微生物,接種純種米曲霉進行培養[2-3]。生產出的麥曲具有加快黃酒發酵、提高原料利用率,防止醪液酸敗和減少用曲量等優點[3]。
熟麥曲的制曲過程是在米曲霉的參與,在一定空氣和溫濕度調節的條件下,發生一系列生物化學變化的過程。通過對米曲霉生理活動的觀察,一般將熟麥曲的制曲過程分為4個時期:孢子萌芽期(接種后最初6~8h,孢子開始吸水膨脹),菌絲生長期(接種后12~20h,菌絲迅速延長),菌絲繁殖期(菌體的生長繁殖進入旺盛時期,菌絲大量生長),孢子著生期(米曲霉的生命活動停滯,開始著生分生孢子)。由于麥曲品溫和水分含量的變化,不同時期麥曲中微生物生長情況不同,所參與的反應以及產酶情況也有所不同[2-4]。
目前對黃酒麥曲制曲過程的研究,一般多是通過對酶活力的測定來研究制曲過程中主要水解酶系的活力變化,其操作步驟繁瑣,準確度不高,并且對于這些同功酶的構成及其來源等往往不能進行全面而有效的分析[5-6]。本研究利用宏蛋白質組學的理論和方法,將麥曲樣品浸提液中所有可溶性蛋白定義為待研究的“宏蛋白質組”,對麥曲制曲過程中的宏蛋白質組動態變化情況進行分析,有利于進一步了解麥曲發酵過程中主要水解酶系的變化,為制曲工藝的控制和改良提供參考依據。
1 材料與方法
1.1 材料與試劑
2012年3月,在紹興某黃酒廠制曲車間跟蹤三批熟麥曲在制曲過程中的溫度和濕度變化,分別取8h、20h、32h和44h的產品作為熟麥曲制曲過程中4個典型時期樣品。為了便于與原料小麥蛋白區分開來,選擇已蒸熟尚未接種的小麥作為空白樣品。
樣品制備、雙向電泳所用部分試劑見參考文獻[8]。α-氰基-4-羥基肉桂酸、碳酸氫銨、三氟乙酸(trifluoroacetic acid,TFA)、胰蛋白酶、乙腈等購于美國Sigma公司。
1.2 儀器與設備
Ettan IPGphor 3等電聚焦電泳儀、ImageScanner掃描儀:美國GE公司;Mini-Protein 3 Cell蛋白垂直電泳系統:美國Bio-Rad公司;Ultraflextreme串聯飛行時間質譜儀:德國Bruker公司;CR22G型高速冷凍離心機:日本HITACHI公司;CentriVap冷凍干燥系統:美國Labconco公司;UV-2100型紫外可見分光光度計:上海尤尼柯儀器有限公司。
1.3 方法
1.3.1 樣品制備
熟麥曲宏蛋白質組樣品的制備參照文獻[9]方法,包括黃酒麥曲的浸提來獲得蛋白粗提取液,使用Clean up kit試劑盒除去粗提取液中的雜質,獲得純凈的蛋白沉淀加入樣品水化液溶解,-20℃保存。
1.3.2 雙向電泳(2-DE)實驗分析[10]
按照GE公司《雙向電泳操作手冊》進行等電聚焦和聚丙烯酰胺凝膠電泳(SDS-PAGE)。將蛋白質樣品(110μg)以水化上樣的方式加到pH 3~10的固定化干膠條(immobilized pH gardient,IPG)中。使用Ettan IPGhor 3系統進行第一向等電聚焦電泳,程序設置如下:快速(250V×2h);線性(500V×1h);線性(1 000V×1h);線性(5 000V×2h);線性(5 000V×10 000Vh)。
等電聚焦結束后,立即進行平衡。IPG膠條在水化平衡液I(加1%的二硫蘇糖醇)中振蕩平衡15min。然后同法放置在水化平衡液II(加2.5%的碘乙酰胺)中振蕩平衡15min。
平衡結束后將膠條轉移至12.5%的SDS-PAGE凝膠上進行第二向分離。使用蛋白垂直電泳系統Mini-Protein 3 Cell以恒電流方式進行電泳:20mA/膠條。電泳結束后使用考馬斯亮藍(coomassie brilliant blue,CBB)R-250進行凝膠的固定、染色、脫色,直至背景無色透明,蛋白點清晰為止。
1.3.3 凝膠掃描及圖譜分析[10-11]
使用Image Scanner III掃描儀對凝膠進行掃描并保存圖像。使用PDQuest軟件對不同時期的麥曲浸提液的雙向電泳圖譜進行比對分析,并對蛋白點的定量值以相對體積(%vol)進行標準化處理。定量差異≥2倍才被認定為差異蛋白點。為避免系統誤差,對每個樣品需要進行3次平行實驗。
1.3.4 質譜鑒定及數據庫搜索[12]
從雙向電泳凝膠上手動切下差異蛋白點,并用胰蛋白酶溶液進行酶解。使用Ultraflextreme MALDI-TOF MS串聯質譜儀器進行質譜鑒定。使用Mascot軟件在美國國立生物技術信息中心(national center of biotechnology information,NCBI)數據庫中對質譜數據進行搜索,Mascot分值大于55即為鑒定成功。
2 結果與討論
2.1 熟麥曲制曲過程中水分含量和溫度的變化情況
小麥經過軋碎、拌水、蒸煮、接種、入池、培養(包括靜止培養、間斷通風培養、連續通風培養),最終得到成品熟麥曲。在麥曲的生產過程中,工廠主要是通過控制通風來控制麥曲的品溫,以獲得品質優良的麥曲[2-4]。制曲過程中溫度的變化曲線如圖1所示。

圖1 熟麥曲制曲過程中溫度的變化曲線Fig.1 Change of temperature in cooked wheat koji-making
從圖1可以看出,接種后最初6~8h,曲料品溫在28~30℃,相對濕度為90~95%,孢子在適當的水分和溫度條件下吸水膨脹。在此階段,原料中的空氣能夠滿足菌體生長繁殖需要,并且菌體的生長不是十分旺盛,產生的熱量及CO2不是很多,不需要對曲層進行通風降溫,為靜止培養。接種后的12~20h,菌絲迅速延長,品溫逐漸上升。需要間斷通風,一方面調節品溫,當品溫上升至33~34℃,需要通風來降低品溫,當品溫降低至30℃時停止通風。另一方面供給足夠氧氣,并利用空氣帶走曲層中的CO2。間斷通風3~4次后,菌體的生長繁殖開始進入旺盛時期,菌絲大量生長,產生大量的熱量,品溫達到38~40℃,此時應開始連續通風。到后期,米曲霉的生命活動逐步停滯,開始著生分生孢子,曲料呈現淡黃色直至嫩黃綠色。一般從入池到出曲時間達到38~42h時,應及時出房,以利于酶最大程度地積累[13-14]。
2.2 熟麥曲制曲過程中不同時期的雙向電泳圖譜分析
根據制曲過程中溫濕度、水分含量、通風狀況以及米曲霉自身的生長情況,分別取8h、20h、32h和44h作為熟麥曲制曲過程中4個時期的關鍵點,為了便于與原料小麥蛋白的區分開來,也選擇已蒸熟尚未接種的小麥作為空白樣品。用0.1mol/L HAc-NaAc緩沖液(pH 4.2)浸提麥曲,按照文獻[9]方法來處理樣品,控制每個時期蛋白樣品相同上樣量(110μg),應用7cm,pH 3~10非線性的IPG膠條進行雙向電泳實驗,實驗獲得的2-DE圖譜見圖2。

圖2 紹興黃酒熟麥曲制曲過程中不同時期的2-DE圖譜Fig.2 2-DE atlas of the different stages in cooked wheat koji-making
對熟麥曲制曲過程的2-DE圖譜分析發現,蒸熟的小麥(0h)圖譜中呈現的蛋白點是原料小麥蛋白,隨后在米曲霉分泌蛋白酶的作用下逐步降解,到菌絲繁殖期(32h)時原料小麥蛋白已基本消失。這與日本清酒所用的米曲霉RIB40在麥麩上的生長情況基本一致[15]。
為了深入了解熟麥曲制曲過程中宏蛋白質組的變化情況,使用PDQuest軟件對制曲過程中4個時期的2-DE圖譜進行差異分析。并對圖譜中顯著蛋白點的表達豐度(根據蛋白點的相對體積自動生成的數量值)進行定量分析,共找到5個明顯差異蛋白點(見圖3及表1)。

圖3 紹興黃酒熟麥曲孢子著生期樣品的2-DE圖譜上差異蛋白點Fig.3 Different spots of cooked wheat koji in mature period from 2-DE profiles
2.3 差異蛋白點的質譜鑒定結果
在熟麥曲孢子著生期樣品的2-DE凝膠上挖取這5個差異蛋白點進行串聯質譜分析,質譜分析所得數據通過Mascot軟件,在NCBI蛋白質總庫進行檢索,鑒定結果列于表2。
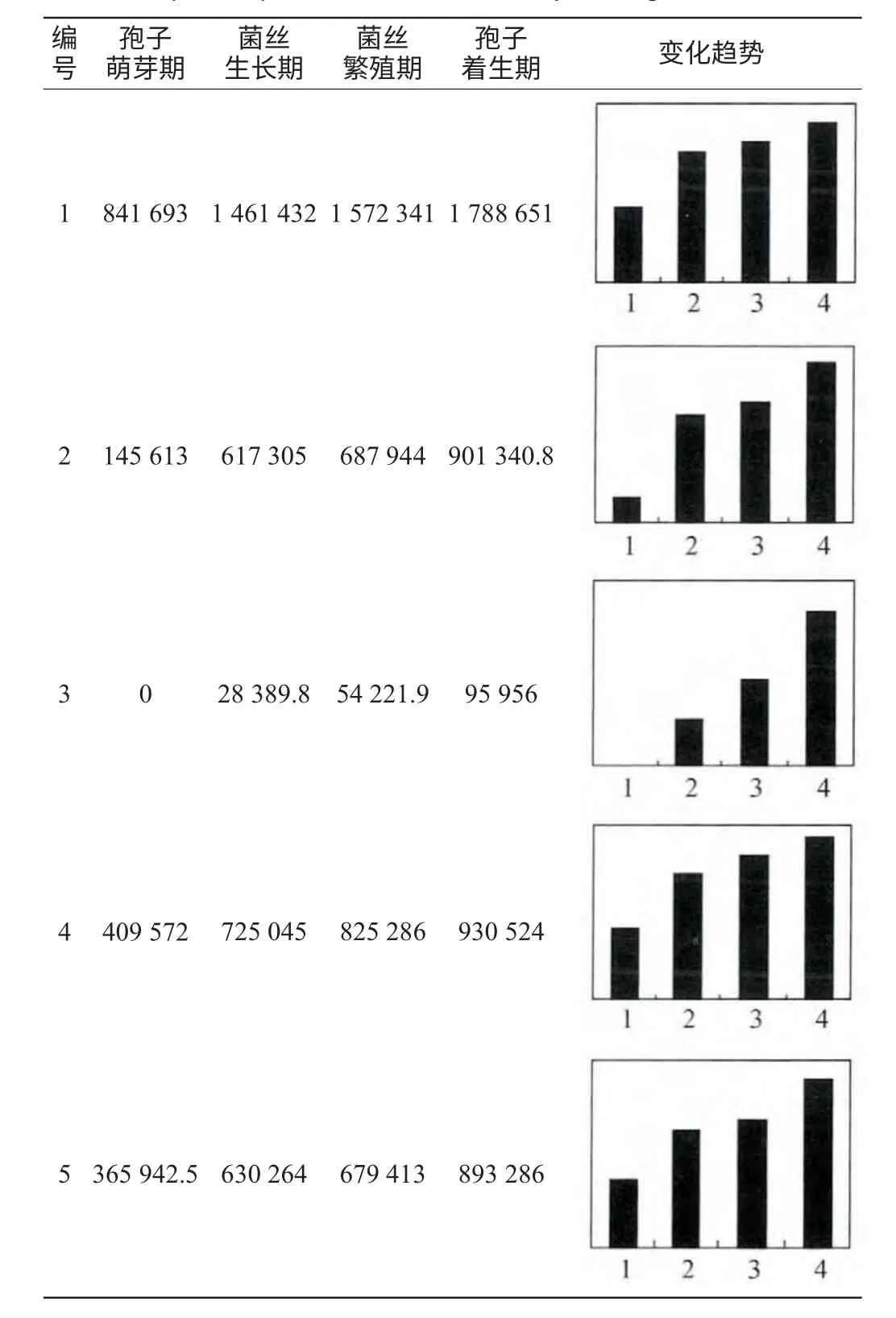
表1 熟麥曲制曲過程中顯著蛋白點的表達豐度及變化趨勢Table 1 Expressive abundance and variation trend of significant protein point in cooked wheat koji making
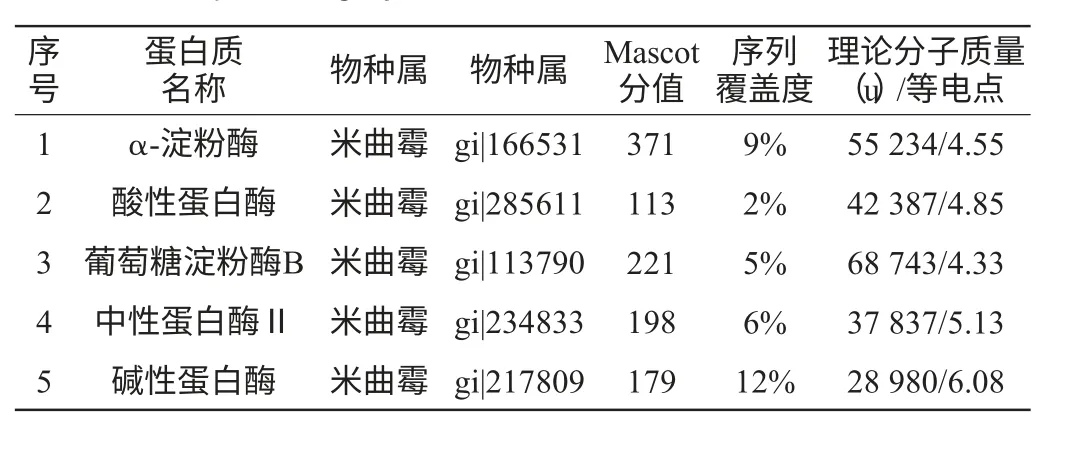
表2 紹興黃酒熟麥曲制曲過程中不同時期差異蛋白點的MALDI-TOF/TOF MS鑒定結果Table 2 Identification of different spots from different stages of koji-making by MALDI-TOF/TOF MS
由表2可知,鑒定得到5種蛋白質(α-淀粉酶、葡萄糖淀粉酶B、酸性蛋白酶、中性蛋白酶II、堿性蛋白酶),全部來自于微生物米曲霉,且在整個制曲過程中蛋白表達豐度呈現逐漸遞增的趨勢,這與文獻報道的米曲霉接種8~10h后分泌的淀粉酶、蛋白酶活力逐漸增大,至40h左右基本接近最高活力的結果相一致[16]。分析其原因主要有兩方面:首先是菌種,熟麥曲采用純種培養的米曲霉蘇-16,產淀粉酶、蛋白酶的能力較強。其次是適宜的培養條件,一般曲霉菌生長適溫在30~37℃,超過40℃對于微生物生長和產酶不利。在制曲過程中,培養溫度始終控制在40℃以下,并且根據曲霉繁殖規律,以靜止、間歇、連續的方式進行通風,來保證其生長產酶的需要[3]。在后期,米曲霉生命活動逐步停滯,開始生成孢子時及時出曲,此時曲中積累了最多的酶。因此在黃酒釀造中熟麥曲對原料的利用率更高,縮短發酵周期。
熟麥曲中淀粉酶主要為α-淀粉酶和葡萄糖淀粉酶B(又稱糖化酶),二者相互配合,以接力的方式完成從淀粉到葡萄糖的一系列糖化反應。整個制曲過程中,2種淀粉酶在2-DE圖譜中的蛋白豐度不斷增大,其中豐度最高的是α-淀粉酶,PDQuset軟件分析其約占圖譜中總蛋白體積的70%,說明熟麥曲有較強淀粉分解能力。結合前人研究發現,熟麥曲中行使糖化功能主要是米曲霉分泌的葡萄糖淀粉酶B。而生麥曲除此之外,還有來源于原料小麥的β-淀粉酶,其酶系更加豐富,生成的代謝產物也會更加復雜多樣[7]。
在孢子萌芽時期(米曲霉接種8h后),2-DE圖譜中已出現酸性蛋白酶、中性蛋白酶II和堿性蛋白酶,整個制曲過程中圖譜上這3個蛋白點豐度逐步增大,并始終以高豐度蛋白形式存在。三者共同作用將原料中的蛋白質水解形成多肽、低肽及氨基酸等含氮化合物,能賦予黃酒特有的風味并為酵母的繁殖提供營養物質[2,14]。
制曲過程的最后時期,2-DE圖譜中出現了很多新的蛋白,一方面由于隨著微生物的生長,代謝產物逐漸增多,此外隨著微生物生命活動的終止,微生物細胞裂解也會釋放出一些胞內蛋白。這些蛋白有待于進一步研究。
在工業化生產的大背景下,降低麥曲使用量將成為一種趨勢,麥曲使用量的減少必須以保證黃酒麥曲品質,不影響黃酒質量為前提,因此迫切需要對麥曲進行機理性研究。本研究利用宏蛋白質組學理論和方法,對紹興黃酒熟麥曲制曲過程中4個不同時期的麥曲浸提液進行宏蛋白質組學研究,包括通過雙向電泳分離宏蛋白質組樣品,利用PDQuest軟件分析差異蛋白點,以及串聯質譜鑒定差異蛋白,所獲得研究結果有利于進一步了解麥曲中主要水解酶系變化,為制曲工藝的控制和改良提供參考依據。
[1]顧國賢.釀造酒工藝學[M].北京:中國輕工業出版社,2007.
[2]謝廣發.黃酒釀造技術[M].北京:中國輕工業出版社,2010.
[3]壽泉洪.生麥曲與熟麥曲在黃酒生產中的應用[D].無錫:江南大學碩士論文,2006.
[4]許贛榮,胡文峰.固態發酵原理、設備與應用[M].北京:化學工業出版社,2009.
[5]王 璐.黃酒麥曲中淀粉酶的分離純化及其性質研究[D].無錫:江南大學碩士論文,2007.
[6]徐 翔,毛 健,陳正行,等.黃酒生麥曲的生化性能及在發酵過程中的研究[J].食品工業科技,2008,29(8):140-142.
[7]ZHANG B,KONG L Q,CAO Y,et al.Metaproteomic characterization of a Shaoxing rice wine“wheat Qu”extract[J].Food Chem,2012,134(1):387-391.
[8]孔令瓊.黃酒麥曲浸提液的宏蛋白質組學研究[D].無錫:江南大學碩士論文,2011.
[9]ZHANG B,GUAN Z B,CAO Y,et al.Secretome of Aspergillus oryzae in Shaoxing rice wine koji[J].Int J Food Microbiol,2012,155(3):113-119.
[10]魏開華,應天翼.蛋白質組學實驗技術新編[M].北京:化學工業出版社,2010:21-24.
[11]辛普森.蛋白質與蛋白質組學實驗指南[M].北京:化學工業出版社,2006.
[12]陳 捷.農業生物蛋白質組學[M].北京:科學出版社,2009.
[13]XIE G F,LI W J,LU J,et al.Isolation and identification of representative fungi from Shaoxing rice wine Wheat Qu using a polyphasic approach of culture-based and molecular-based methods[J].J I Brewing,2007,113(3):272-279.
[14]CAO Y,XIE G F,WU C.et al.A study on characteristic flavor compounds in traditional chinese rice wine-Guyue Longshan rice wine[J].JI Brewing,2010,116(2):182-189.
[15]ODA K,KAKIZONO D,YAMADA O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solid-state culture condition[J].Appl Environ Microb,2006,72(5):3448-3457.
[16]張艷芳,陶文沂.米曲霉40188 產中性蛋白酶、α-淀粉酶特性的研究[J].食品與發酵工業,2008,34(5):35-37.

