15種中成藥微生物限度檢查方法驗證
趙會蘭
(云南麗江市食品藥品檢驗所,云南麗江 674100)
15種中成藥微生物限度檢查方法驗證
趙會蘭
(云南麗江市食品藥品檢驗所,云南麗江 674100)
目的:建立15種中成藥微生物限度檢查方法。方法:按《中國藥典》(2010年版)的規定,進行各品種微生物限度檢查方法的驗證。結果:8個品種(青葉膽片、開胸消食片、復方公英片、女金丸、婦舒丸、青陽參片、小兒導赤片、利膽止痛片)無抑菌作用,回收率均大于70%,可采用常規法進行細菌數測定;3個品種(通宣理肺片、田七花葉顆粒、七葉神安片)對枯草芽孢桿菌有不同程度的抑菌作用,可采用培養基稀釋法(0.2 mL/皿)進行細菌數測定;2個品種(瀉痢消片、七葉神安片)對白色念珠菌有抗菌作用,可采用培養基稀釋法(0.2 mL/皿)進行霉菌及酵母菌數測定;3個品種(血塞通片、血塞通膠囊、七葉神安片)對金黃色葡萄球菌和枯草芽孢桿菌有較強的抑菌作用,可采用薄膜過濾法進行細菌數測定;其余品種的細菌、霉菌及酵母數和控制菌均采用常規法進行測定。結論:以上驗證方法可作為各品種微生物限度檢查方法。
中成藥;微生物限度;方法驗證試驗;回收率
口服中成藥中很多品種有抑菌作用,本研究中有的品種中含黃連、厚樸、木香、白芍、吳茱萸、檳榔、黃芩、蒲公英、板藍根、大黃等具有明顯抑菌作用的中藥[1],如采用常規微生物限度檢查法檢查這些品種,測定的結果不準確,導致檢驗結果不可靠。按照《中國藥典》(2010年版)的規定建立藥品的微生物限度檢查法時應進行方法學驗證,以保證微生物限度檢查法的可行性和結果的可靠性,而現行《中國藥典》收載的各中成藥品種檢查項下,很少規定具體的微生物限度檢查方法,為確保用藥的安全與有效,本研究按《中國藥典》(2010年版)并參考其他標準和資料的基礎上[2-9],對以上品種微生物限度檢查方法進行了驗證試驗,確立了15種中成藥微生物限度檢查方法。
1 儀器與材料
1.1 儀器
GSP-9270MBE型隔水式恒溫培養箱,上海博訊實業有限公司醫療設備廠;HTY-2000A型集菌儀,杭州泰林生物技術設備有限公司;TG16-WS臺式高速離心機,長沙湘儀離心機儀器有限公司。
1.2 樣品
通宣理肺片,0.3 g/片,批號:20110601;瀉痢消片,0.35 g/片,批號:20100302;小兒導赤片,0.3 g/片,批號:20110301;婦舒丸,6 g/袋,批號:LJ1106;女金丸,5 g/袋,批號:20101104;青葉膽片,54片/盒,批號:20101104;復方公英片,36片/盒,批號:20110325;開胸消食片,0.3 g/片,批號:00309025;利膽止痛片,54片/盒,批號:20110301;青陽參片,100 mg/片,批號:00109002;以上藥品均為云南白藥集團麗江藥業有限公司生產。血塞通片,0.173 g/片,批號:130562;血塞通膠囊,0.22 g/片,批號:130603;七葉神安片,50 mg/片,批號:130601,均為云南維和藥業股份有限公司生產。田七花葉顆粒,10 g/袋,批號:130726;七葉神安片,50 mg/片,批號:20130501,為滇虹藥業集團玉溪生物制藥有限公司生產。
1.3 培養基及稀釋劑
營養瓊脂,批號:130422;玫瑰紅鈉瓊脂,批號:1303202;膽鹽乳糖,批號:130401;營養肉湯,批號:101124;麥康凱瓊脂,批號:101018;改良馬丁培養基,批號:101104,均為北京三藥科技開發公司生產。4-甲基傘形酮葡糖苷酸(MUG)培養基,批號:20120701,為北京牛牛基因技術有限公司生產,經檢查適用性符合《中國藥典》(2010年版)要求。稀釋劑:NaCl-蛋白胨緩沖液(pH7.0)。
1.4 菌種
枯草芽孢桿菌 [CMCC(B)63 501]、金黃色葡萄球菌[CMCC(B)26 003]、大腸埃希菌、[CMCC(F)44 102]、白色念珠菌[CMCC(F)98 001]、黑曲霉[CMCC(F)98 003]均由云南省食品藥品檢驗所提供。本實驗所用對照菌均在5代以內。
2 方法
按照《中國藥典》(2010年版)一部微生物限度檢查法附錄進行。
2.1 菌液制備
2.1.1 金黃色葡萄球菌、枯草芽孢桿菌、大腸埃希菌取經 35℃培養 18~ 24 h的金黃色葡萄球菌、枯草芽孢桿菌、大腸埃希菌的營養肉湯培養物1 mL,用0.9%無菌氯化鈉溶液10倍稀釋至約含50~100 cfu/mL的菌懸液,備用。
2.1.2 白色念珠菌取經25℃培養18~ 24 h的白色念珠菌的改良馬丁液體培養物1 mL,用0.9%無菌氯化鈉溶液10倍稀釋至約含50~100 cfu/mL的菌懸液,備用。
2.1.3 黑曲霉取1 mL黑曲霉孢子懸液,用0.9%無菌氯化鈉溶液10倍稀釋至約含50~100 cfu/mL的孢子懸液,備用。
2.2 供試液制備
稱取樣品 10 g,加 pH7.0無菌氯化鈉-蛋白胨緩沖液至100 mL,搖勻,為1∶10供試液。
2.3 驗證試驗
2.3.1 常規法
2.3.1.1 試驗組 取 1∶10供試液 1 mL和試驗菌50~ 100 cfu,然后每皿加15~20 mL營養瓊脂或玫瑰紅鈉瓊脂培養基,搖勻,置規定溫度培養48~72 h計數,進行細菌、霉菌和酵母菌數測定。2.3.1.2菌液組 取試驗菌50~100 cfu,然后每皿加15~20 mL營養瓊脂或玫瑰紅鈉瓊脂培養基,搖勻,置規定溫度培養48~ 72 h計數。
2.3.1.3 供試品對照組 取 1∶10供試液1 mL,然后每皿加15~20 mL營養瓊脂或玫瑰紅鈉瓊脂培養基,搖勻,置規定溫度培養 48~ 72 h計數。結果見表1。
表1結果表明,小兒導赤片、婦舒丸、女金丸、青葉膽片、復方公英片、開胸消食片、利膽止痛片、青陽參片8個品種對5株試驗菌的回收率均高于70%,說明無抑菌作用,可采用常規法進行細菌、霉菌和酵母菌數測定。通宣理肺片、田七花葉顆粒、七葉神安片3個品種對枯草芽孢桿菌有抑菌作用,瀉痢消片對白色念珠菌有抑菌作用,血塞通片、血塞通膠囊2個品種對枯草芽孢桿菌和金黃色葡萄球菌有抑菌作用,七葉神安片對枯草芽孢桿菌、金黃色葡萄球菌和白色念珠菌有抑菌作用,回收率小于70%,采用培養基稀釋法或薄膜過濾法重新進行細菌數、霉菌和酵母菌數驗證。
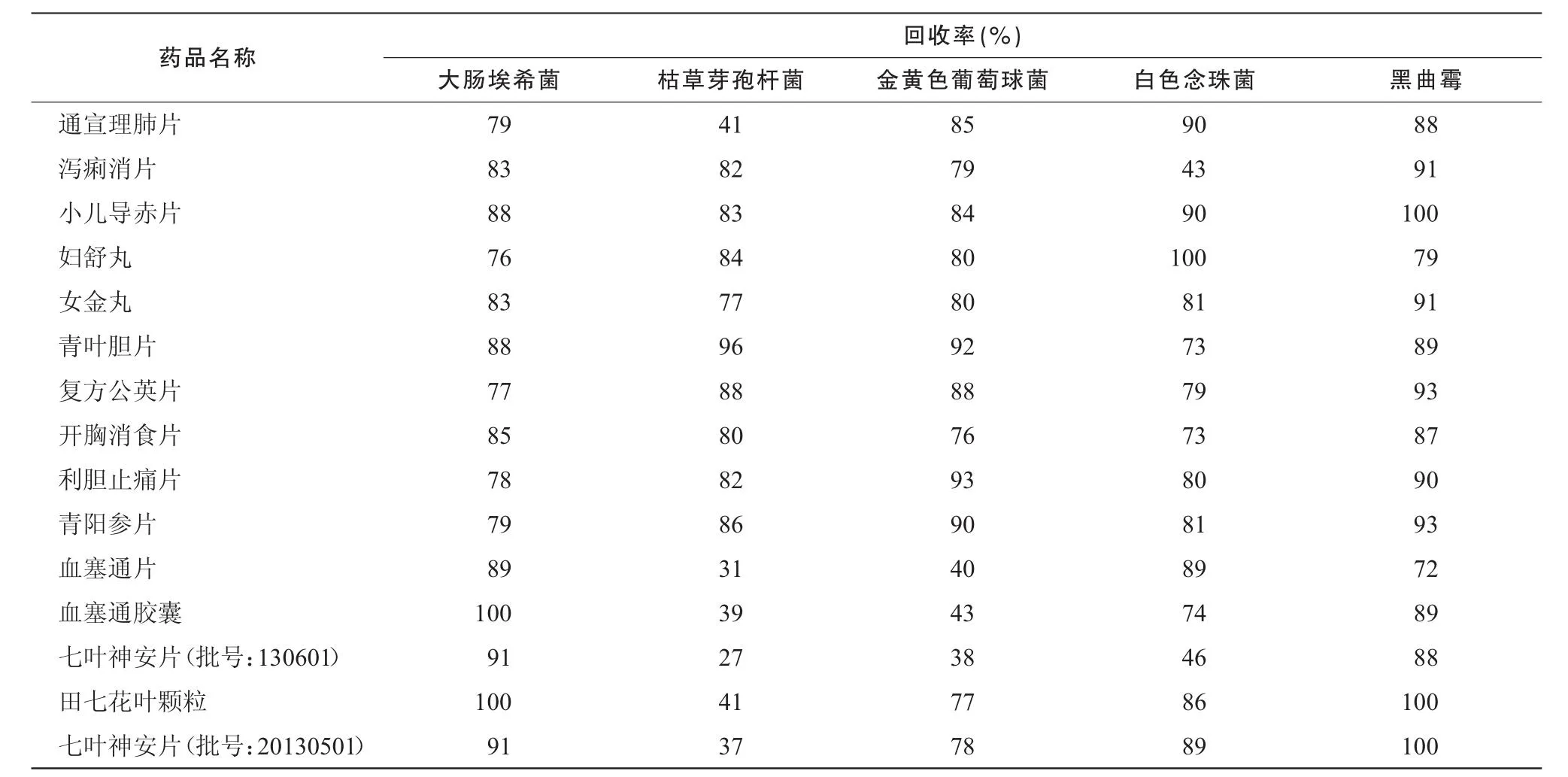
表1 常規法(1 mL/皿)5株陽性試驗菌回收率
2.3.2 培養基稀釋法取1∶10供試液采用0.5 mL/皿、0.2 mL/皿再加入試驗菌 50~ 100 cfu,方法同常規法進行試驗,結果見表2。
2.3.3 薄膜過濾法取1∶10的供試液10 mL,離心3 min(500 r/min),取上清液2 mL注入100 mL緩沖液中,用薄膜過濾器減壓抽濾至干,再用上述緩沖液少量多次沖洗,總沖洗量每膜400 mL,在最后一次沖洗液中加入試驗菌50~ 100 cfu,濾干,取膜菌面朝上貼于營養瓊脂平板,置規定溫度培養48~ 72 h計數,見表3。
表2,3結果表明,培養基稀釋法(0.2 mL/皿)可消除通宣理肺片、七葉神安片、田七花葉顆粒、瀉痢消片的抗菌作用;薄膜過濾法(每膜沖洗400 mL)可消除血塞通片、血塞通膠囊、七葉神安片的抗菌作用,回收率均大于 70%,故上述方法可用于該品種的細菌數、霉菌及酵母菌數測定方法。

表2 培養基稀釋法回收率
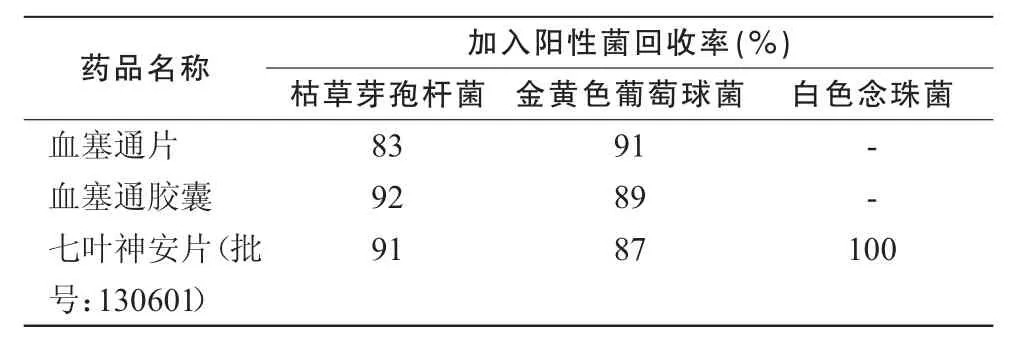
表3 薄膜過濾法回收率
2.4 控制菌檢查方法驗證(常規法)
2.4.1 試驗組取1∶10供試液10 mL和大腸埃希菌液 50~100 cfu,加入到膽鹽乳糖增菌培養基100 mL中,依據大腸埃希菌檢查法進行試驗。取10 mL膽鹽乳糖發酵培養基3支,分別加入1∶10供試液1 mL、1∶100的供試液1 mL、1∶1 000的供試液1 mL,同時分別加入上述大腸埃希菌液50~100 cfu,依據大腸菌群檢查法進行試驗。
2.4.2 陽性對照組取大腸埃希菌液50~100 cfu分別加入100 mL膽鹽乳糖增菌培養基和10 mL膽鹽乳糖發酵培養基中,依據大腸埃希菌和大腸菌群檢查法進行試驗。
2.4.3 陰性對照組取規定的稀釋劑,分別加入到100 mL膽鹽乳糖增菌培養基和10 mL膽鹽乳糖發酵培養基中,依據大腸埃希菌和大腸菌群檢查法進行試驗。
2.4.4 本研究中15個品種均為口服制劑,藥典規定不含藥材原粉的應檢大腸埃希菌,含藥材原粉的應檢大腸埃希菌和大腸菌群,且試驗組和陽性對照組應檢出大腸埃希菌,陰性對照組應無菌生長。常規法試驗結果表明,15個品種試驗組和陽性對照組均檢出大腸埃希菌,陰性對照組均無菌落生長,故該方法成立,可采用常規法進行控制菌檢查。
上述結果表明,通宣理肺片、七葉神安片(20130501)、田七花葉顆粒可采用稀釋法(0.2 mL/皿)進行細菌數測定;瀉痢消片可采用(0.2 mL/皿)進行霉菌及酵母菌數測定;血塞通片、血塞通膠囊采用薄膜過濾法(每膜沖洗 400 mL)進行細菌數測定;七葉神安片(130601)采用薄膜過濾法(每膜沖洗400 mL)進行細菌數測定,(0.2 mL/皿)進行霉菌及酵母菌數測定;其余品種和項目均可采用常規法進行測定。
3 討論
3.1 《中國藥典》(2010年版)規定,當進行藥品的微生物限度檢查時,應采用大腸埃希菌、枯草芽孢桿菌、金黃色葡萄球菌、白色念珠菌、黑曲霉菌 5株試驗菌逐一進行回收率測定,以確認所采用的方法適合該藥品的檢驗,驗證試驗應包括細菌、霉菌和酵母菌及控制菌的驗證。本研究的15個品種中通過5株試驗菌回收率測定,有3個品種對枯草芽孢桿菌,有2個品種對白色念珠菌,有3個品種對金黃色葡萄球菌和枯草芽孢桿菌有不同程度的抗菌作用,說明《中國藥典》規定進行方法學驗證試驗是必要的。
3.2 通過不同企業的七葉神安片驗證試驗顯示,其中一個廠家的七葉神安片對金黃色葡萄球菌、枯草芽孢桿菌和白色念珠菌均具有較強的抑菌作用,另一個廠家的七葉神安片只對枯草芽孢桿菌有抑菌作用,對金黃色葡萄球菌和白色念珠菌的回收率差異太大,對枯草芽孢桿菌的回收率無明顯差異,說明《中國藥典》規定進行方法學驗證的重要性,且方法學驗證試驗也可從側面反映藥品的質量,同一品種、不同生產企業的產品藥物抗菌活性有如此大的差異,值得研究,可能與企業采用的原藥材的產地、品質、成分的不同及含量,生產工藝有關。
[1] 《全國中草藥匯編》編寫組.全國中草藥匯編(上冊)[M].北京:人民衛生出版社,1982:62-871.
[2] 蘇德模,馬緒榮.藥品微生學檢驗技術[M].北京:華齡出版社,2007:209-236.
[3] 國家藥典委員會.中國藥典(2010年版)一部[S].北京:中國醫藥科技出版社,2010:附錄79.
[4] 中國藥品生物制品檢定所.中國藥品檢驗標準操作規范(2010年版)[S].北京:中國醫藥科技出版社,2010:351-389.
[5] 肖雙.不同企業來源安神丸微生物限度檢查方法學驗證比較[J].中國當代醫藥,2010,17(21):133-135.
[6] 特玉香,劉鵬,戴翚,等.黃連上清丸微生物限度檢查方法驗證淺析[J].藥物分析雜志,2006,26(11):1674-1677.
[7] 向東.影響微生物限度檢查及方法驗證的因素分析[J].現代醫藥衛生,2007,23(15):2329-2330.
[8] 劉鵬,馬仕洪,戴翚,等.不同企業來源活血止痛膠囊微生物限度檢查結果分析[J].中國藥事,2012,26(10):1112-1114.
[9] 王德啟.珍珠冰硼散微生物限度檢查方法學驗證[J].中國執業藥師,2011,8(2):37-39.
Method Validation of Microbial Limit Test of 15 Kinds of Traditional Chinese Patent Medicines
Zhao Huilan(Institute for Food and Drug Control of Lijiang City of Yunnan Province,Yunnan Lijiang 674100,China)
Objective:To establish a method for microbial limit test of 15 kinds of traditional Chinese patent medicines.Methods:According to the requirements set forth in the Chinese Pharmacopoeia of 2010 edition,method validation should be conducted of microbial limit test for different varieties.Results:Eight species(qingyedan tablets,kaixiongxiaoshi tablets,compound gongying tablets,nvjin pills,fushu pills,qingyangshen tablets,xiaoerdaochi tablets and lidan zhitong tablets)had no bacteriostasis effect with the recovery rate of more than 70%,and the conventional method can be used for bacterial number determination.Three species (tongxuanlifei tablets,tianqihuaye granules and qiyeshen’an tablets)had different degrees of inhibition on bacillus subtilis,and the culture medium dilution method (0.2 mL/plate)can be used for bacterial number determination.Tow species (xielixiao tablets and qiyeshen'an tablets)had antibacterial effect on candida albicans,and medium dilution method(0.2 mL/plate)should be used for the determination of mold and yeast counts.Three species (xuesaitong tablets,xuesaitong capsules and qiyeshen’an tablets)had stronger bacteriostasis on staphylococcus aureus and bacillus subtilis,and the bacterial numbers can be tested by membrane filtration.Other kinds of bacteria,mold and yeast counts and control bacteria can be measured by conventional methods.Conclusion:The above verification methods can be used for microbial limit tests of different varieties.
Chinese Patent Medicine;Microbial Limit;Method Validation Test;Recovery Rate
10.3969/j.issn.1672-5433.2014.05.005
2013-11-20)
趙會蘭,女,副主任藥師。研究方向:藥品檢驗。E-mail:1145472590@qq.com

