中藥有效成分辨識的研究進展
李 花,陳玉文
(沈陽藥科大學工商管理學院,遼寧 沈陽 110016)
中藥現代化是中藥國際化的必要基礎,提高中藥的質量使中藥治療更加準確,必須對中藥有效成分進行辨識,以達到國際市場標準和對產品的要求,在國際上廣泛流通。筆者就中藥有效成分(群)的辨識研究進展論述如下。
1 中藥有效成分(群)辨識研究背景
中藥對某種疾病或證候是否有效,直接取決于其有效成分的存在與否和量的多寡[1]。中藥中的有些化學物質對機體直接發揮生物學作用,稱之為有效效應物質;而另一些是間接發揮生物學作用,如大多數原生苷是前藥(prodrug),如燈盞乙素聚乙二醇[2],其在人體內的生物轉化產物和/或代謝產物發揮生物學作用,其他化學物質亦可能存在類似的轉化形式,這類天然化學物質稱為有效成分;既不產生直接作用,亦無間接作用的化學物質,稱為無效成分。有效效應物質、有效成分和無效成分均指中藥中原存在的物質,而在人體內直接產生生物學效應的化學效應物質稱為效應物質。效應物質包含了一部分有效效應物質,即有效成分(群)。
目前,用于中藥有效成分辨識的研究方法主要借鑒了化學藥和植物藥的模式,其基本過程是分離純化、活性篩選,方劑活性追蹤與有效成分發現等。這些研究模式或具有高效、快速的特點,或強調了對中藥有效成分的研究以臨床功效為出發點和落腳點,獲得了大量中藥化學成分、結構及其活性信息,成績斐然。然而,隨著研究工作的深入,這些方法已不能全面地探知中藥復雜體系中的奧秘。因此,整合中醫、中藥、生物、化學、信息等眾多學科的相關知識和方法,建立可體現已有研究模式優勢特色的中藥物質基礎研究技術,必將促進中藥學的技術革新和學科進步。中藥有效成分(群)辨識研究正是在此背景下應運而生,國內在這一研究領域已提出不少新的研究思路,筆者總結為2個思路,即以中藥本身為出發點和以生物體內代謝為出發點的研究方法,見圖1。
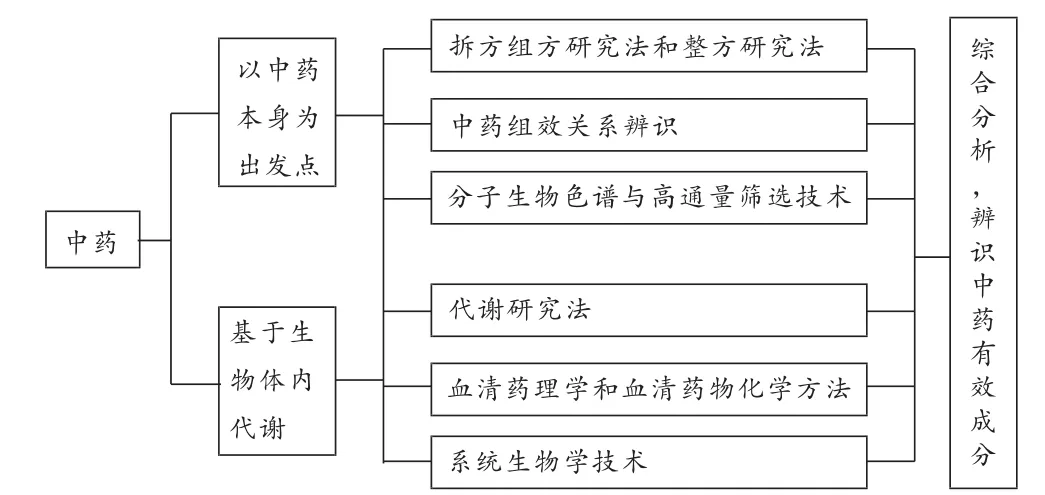
圖1 中藥有效成分辨識研究方法
2 以中藥本身為出發點的有效成分辨識
2.1 拆方和整方研究法
拆方研究法是對復方中藥進行篩選,以復方的功能主治為導向,即逐步減去復方中一味或幾味中藥,拆成單味藥或藥物組,以觀察療效的變化,逐漸縮小研究范圍,最終確定必須保留的藥物,從中尋找有效成分[3]。近年來,有學者對血府逐瘀湯[4]、吳茱萸湯[5]等進行了拆方研究,發現了具有代表性的有效成分。但拆方研究法忽視了方藥合煎的影響及成分之間的相互作用。隨著現代分析、分離、鑒定方法與技術的引入,整方研究法在一定程度上克服了拆方研究法的局限性,更能體現中藥復方的整體觀和辨證施治原則。整方研究法是將復方視為一個整體,以復方的君、臣、佐、使組方原則或功效為主要導向,研究中運用植化方法對復方煎煮后的藥液進行系統分離和鑒定,以獲得全方化學信息。還可結合單味藥成分,分析整方與單味藥的區別,發現煎煮等過程中有無新化合物生成等。如從麻醉復方整方中分離獲得東莨菪堿[6],從白頭翁湯中獲得生物堿、香豆素、皂苷、檸檬苦素4類化學成分等[7]。但整方中化學成分更加復雜,涉及面更廣,工作難度更大。將整方與拆方研究法結合運用,有助于中藥物質基礎的全面闡釋。
2.2 中藥組效關系辨識
所謂中藥“組效關系”(combination-activity relationship,CAR)是指在不同層次上的重要物質組合和藥效活性之間的關聯性[8]。必須系統地研究中藥復雜物質體系的組成與藥效之間的整體關系,包括中藥有效組分及其配伍與藥效間的相關性,多種化學組分生物效應的相關性及其整合調節機制等。顯然,單純采用傳統的試驗研究手段無法求解中藥復雜物質體系的系統辨識問題。通過綜合運用各相關學科的新理論和新方法,運用譜效關系理論、計算機優化設計技術,將有助于揭示中藥復方藥效物質基礎和藥效組分協同作用機制。
譜效關系是建立在指紋圖譜的研究之上,應用色譜及其聯用技術,最大限度地獲取有用的化學信息。通過對有效組分進行譜效關系研究,將標示活性成分群特征峰的指紋圖譜與藥效結果對應,將中藥指紋圖譜中化學成分的變化與藥效結果聯系起來,建立譜效關系,探討復方的物質基礎[9]。如石鉞等[10]利用高效液相色譜和液相色譜-串聯質譜提供的色譜和離子碎片信息,對相同試驗條件下提取的銀翹散中抗流感病毒有效組分及其組方各單味藥的指紋圖譜流出組分進行對比分析。
計算機輔助配伍配比優化方法研究,即在建立多組分藥效預測模型的基礎上,研究中藥有效組分配伍配比組合優化方法及計算機輔助中藥優化設計技術,著重開展化學組分-藥效模式空間上的遺傳算法、蟻群算法等智能搜索算法和優化搜索策略研究,為現代中藥創制技術發展提供科學依據和技術工具[11]。
2.3 分子生物色譜技術與高通量篩選技術
分子生物色譜技術與高通量篩選技術的基本方法均是針對中藥復方多成分調節作用的多靶點特性,通過配體-受體的藥物研究理論,進行藥效物質的篩選和確定。
生物色譜技術是以具有相同生物效應的中藥有效成分(群)為研究對象,能有效、深入地研究中藥有效成分(群)間的功效關聯性;選擇多個生物體系共同結合于同一分離器中,即可表達中藥有效成分(群)作用多環節、多途徑和多靶點的作用特點。操作過程是將生物體內活性物質如酶、受體、運輸蛋白和其他具有重要生理功能的生物大分子固定于色譜填料中,復方提取物通過色譜柱后,經過特異識別、結合和分離,最終被分離和鑒定。如Wang等[12]用人血清白蛋白(HSA)生物色譜技術研究了茵陳蒿的甲醇提取物在色譜柱上的結合狀態,發現了5個保留峰,并鑒定出其中的2個化合物分別為濱蒿內酯和茵陳新,說明這2個化合物具有生理活性。
以基因、受體、酶等為藥物作用靶點的高通量篩選技術在中藥有效成分篩選、分離等的辨識研究中發揮了重要作用。Sun等[13]用細胞外膜片鉗技術構建體外培養的皮質神經元模型,篩選了22種中藥對N-甲基-D-天冬氨酸受體的拮抗作用。結果顯示,黃芩、粉防己、鼠尾草等水提取物能阻斷N-甲基-D-天冬氨酸的通路。但高通量篩選的局限性也十分明顯,主要表現在該技術不能充分反映藥物的全面藥理作用,也無全面反映機體生理機能的理想模型。
盡管以中藥為出發點的生物研究方法取得了長足進步,得到了較多的研究成果,但也有不足之處,如傳統的中藥物質基礎研究模式重點考察中藥中含有哪些成分、哪些成分能在藥理試驗中顯示活性,沒有重視其中的化學成分是否能夠被吸收以及吸收后在體內的系列變化過程。眾所周知,任何藥物都是通過與人體的相互作用而發揮療效的,因此中藥物質基礎的研究應該緊扣人體對藥物的作用,充分考慮中藥有效成分在體內的動態變化過程(吸收、分布、代謝、靶向等),闡明體內發揮療效的真正藥效物質基礎[14],因此基于生物體內代謝過程進行中藥有效成分辨識的研究思路亟待研究。
3 基于生物體內代謝過程的中藥有效成分辨識
3.1 代謝研究法
代謝研究法的思路之一是用整體動物進行代謝研究,即通過給藥后對動物血液、尿、膽汁、胃液、腸液、糞便等進行分析、分離,從而發現復方在體內真正發揮藥效的物質,進而研究物質基礎和復方作用機理[15];思路之二是在體外模擬體內條件進行代謝研究,即通過分析復方在人工胃液、腸液及腸道菌叢中可吸收成分及其轉化特征,結合藥效學的結果分離中藥復方有效成分[16]。代謝研究法排除了復方本身復雜理化性質、胃腸中不能進入血清的藥物成分等干擾,可更快速地發現有效成分。用代謝研究法對小柴胡湯進行研究后發現,服用小柴胡湯后血漿中發現了原方中沒有的一些新化合物,如黃芩苷的新代謝物黃芩苷元硫酸酯等[17]。
3.2 血清藥理學和血清藥物化學方法
血清藥理學就是對中藥經生物體代謝轉化后進入血清的藥學成分進行藥效評價,而血清藥物化學則是對含藥血清進行有效成分的分離鑒定。實際操作是將復方制劑給動物灌胃后,取血并分離血清,結合體外血清藥理活性測定,進行血清中有效成分的分離鑒定,從而闡釋復方效應物質基礎。運用血清藥理學和血清藥物化學研究方法研究復方物質基礎取得了許多有價值的研究成果,如對茵陳蒿及其復方進行的血清藥物化學研究發現,口服給藥后,具有促進膽汁分泌作用的6,7-dimethylesculetin(6,7-DME)被大量吸收入血(生物利用度為62.4),其他藥物成分可能在其他環節對6,7-DME產生影響,但在血液中并未檢出,由此認定6,7-DME為茵陳蒿及茵陳蒿湯的效應物質基礎[18]。
然而,該法在實際運用中也遇到了較多問題。首先,在血清中檢測到的成分可能是無效物質或是有效物質的代謝產物;其次,某些檢測到的吸收入血的成分,經過富集和提純后,需比原來血清中的濃度高許多倍時才顯示相關藥理作用,這給有效成分的確定帶來困難;此外,不同種屬、年齡的動物對藥物吸收的差異,不同給藥劑量、采血時間造成的血藥成分、濃度的差異,加上血清內源性成分的干擾,給血清有效成分的分離、鑒定造成了較大的困難。因此,中藥血清藥物化學雖是一種很有發展前途的方法,但許多問題尚待今后更系統、深入地探討。
3.3 系統生物學技術
系統生物學技術主要研究一個生物系統中所有組成成分如基因、信使核糖核酸(mRNA)、蛋白質等的構成,以及在特定條件下這些組分間的相互關系[19]。
中藥復方臨床療效可視為一個“黑箱效應”,即復方(外界)的各類物質或其降解物、代謝物,最終均作用于靶細胞的表面,通過尚不明了的信號傳遞過程(黑箱部分)影響DNA,進而啟動或關閉某些mRNA,合成或停止產生某種或某些效應分子(蛋白質),從而達到治療目的。該法采用反向思維模式,不再把研究的重心放在分離、純化各種有效成分上,而是通過研究服藥后機體受到影響而出現的新的效應分子(蛋白質),來確定最終起治療作用的物質[20]。該法是通過分析單味藥及復方的化學成分(輸入)和血清或病變組織器官中與療效相關的效應成分(輸出)的關系,找出復方的物質基礎[21]。實際操作中,先獲得復方全成分化學信息,再利用計算機將復方成分與藥理試驗數據特別是蛋白質等效應分子的結構和功能進行相關,并對單味藥和各種不同配伍復方化學成分進行比較和歸納,尋找化學成分與活性的關系規律,從而闡明復方的作用物質基礎。肖紅斌等[22]在該分析基本思路的基礎上,運用智能多模式多柱色譜系統(IM2MCC)及其聯用技術探討了當歸補血湯效應物質基礎。與其他方法相比,該法忽視了組成復方的各單味藥之間的相互配伍和平衡關系。盡管如此,該法獨到的研究思路在復方效應基礎研究中將發揮應有的作用[21]。
4 結語
綜上所述,中藥有效成分研究經多年的探索,已建立了一些有效的方法。但就現狀而言,對中藥的研究還不夠深入。原因主要有:1)中藥藥效物質的辨識和篩選技術脫離了中醫藥理論,基本走上了“中藥西化”的道路,與中醫藥整體觀及多成分、多靶點整體作用特點不甚吻合。2)中藥有效成分研究沒有重視中藥有效成分體內的動態變化過程。傳統的研究模式重點考察中藥中含有哪些成分、哪些成分能在藥理試驗中顯示活性,沒有重視其中的化學成分是否能被吸收及吸收后在體內的系列變化過程。眾所周知,任何藥物都是通過與人體的相互作用而發揮療效的,因此中藥有效成分的研究應緊扣人體對藥物的作用,充分考慮有效成分在體內的動態變化過程(吸收、分布、代謝、靶向等),闡明體內發揮療效的真正藥效物質基礎[14]。3)中藥成分復雜,現有的系統生物學技術仍存在許多不足與弊端。因此,可依據傳統中醫藥理論,遵循中藥的整體性、協同性和多靶點作用特點,借鑒現代化學和生命科學領域的最新技術和方法從中藥活性成分的生成、吸收、分布、靶向作用和代謝的全過程對中藥開展系統研究,建立一種動物體內模擬的中藥有效成分辨識新方法,最大限度地綜合運用現代相關技術去揭示中藥復方的有效成分。
參考文獻:
[1]楊秀偉.基于體內過程的中藥有效成分和有效效應物質的發現策略[J].中國中藥雜志,2007,23(5):365-370.
[2]葉 海,張 燦,沈文斌,等.燈盞乙素聚乙二醇前藥的合成與表征[J].中國天然藥物,2006,4(4):283.
[3]張禮和.我對中藥復方有效成分研究的一些看法[J].化學進展,1999,11(2):186-188.
[4]Li XL,Xiao HB,Liang XM,et al.LC2MS /MS determination of naringin,hesperidin and neohesperidin in rat serum after orally administrating the decoction ofBulp leurum falcatum L.and Fractus aurantii[J].J Pharm Biomed Anal,2004,34(1):159-166.
[5]寧黎麗,畢開順,王 瑞,等.吳茱萸湯藥效物質基礎的方法學研究[J].藥學學報,2000,35(2):131-134.
[6]郭立民,王長云,顧謙群,等.中藥復方效應物質基礎研究方法及其發展趨勢[J].中成藥,2007,29(1):118.
[7]朱華旭,丁林生.白頭翁湯湯劑化學成分的分離研究[J].中成藥,1999,21(6):312.
[8]楊紅軍,雷 燕,唐仕歡,等.發現·辨識·優化——中藥新藥設計的核心與關鍵[J].世界科學技術 -中醫藥現代化,2011,13(1):154-158.
[9]Liu Y,Zhou JL,Liu P,et al.Chemical markers′fishing and knockout for holistic activity and interaction evaluation of the components in herbal medicines[J].J Chromatogr A,2010,1 217(32):39.
[10]石 鉞,石任兵.銀翹散抗流感病毒有效部位各組分變化及歸屬分析[J].藥學學報,2007,42(2):192.
[11]王 毅,程翼宇.中藥組效關系辨識方法學與計算理論研究思路與策略[J].中國天然藥物,2003,1(3):178-181.
[12]Wang HL,Zhou HF,Ni JY,et al.Fractionation and analysis of Artemisia capillaris Thunb.by affinity chromatography with human albumin asstationary phase[J].J Chromatogr A,2000,870(1-2):501-510.
[13]Sun X,Chan LN,Gong X,et al.N-Methyl-D-aspartate receptor antagonist activity in traditional Chinese strokemedicines[J].Neurosignals,2003,12(1):31.
[14]齊煉文,周建良,郝海平,等.基于中醫藥特點的中藥體內外藥效物質組生物、化學集成表征新方法[J].中國藥科大學學報,2010,41(3):195.
[15]Huang X,Kong L,Li X,et al.Strategy for analysis and screening of bioactive compounds in traditional Chinese medicines[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,812(1-2):71-84.
[16]何祥久,邱 峰,姚新生.中藥復方研究現狀和思路[J].化學進展,2001,13(6):481-484.
[17]馮年平,狄 斌,劉文英.藥物代謝研究與中藥現代化[J].世界科學技術 - 中醫藥現代化,2003,5(2):527.
[18]王喜軍.中藥及中藥復方的血清藥物化學研究[J].世界科學技術 - 中藥現代化,2002,4(2):124.
[19]劉昌孝.系統生物學與中藥現代研究(一)[J].天津中醫藥大學學報,2006,25(3):115.
[20]王米渠,吳 斌,袁世宏,等.試談復方藥物的分子機制研究[J].現代中西醫結合雜志,2003,12(5):449-450.
[21]劉 俊,青 杰,魏玉平.復方中藥物質基礎研究[J].時珍國醫國藥,2000,11(3):243-244.
[22]肖紅斌,梁鑫淼,盧佩章,等.中藥復方分析新方法及其應用[J].科學通報,1999,44(6):588-596.

