基于計算機輔助藥物設計的石薺 抗流感藥效物質多靶向作用研究
鄧麗麗 ,臧家娜 ,余陳歡 ,俞 冰
(1.浙江中醫藥大學,浙江 杭州 310053; 2.浙江省醫學科學院,浙江 杭州 310013)
計算機輔助藥物設計(CADD)應用量子力學、分子動力學、構效關系等基礎理論數據,研究藥物對酶、受體等作用的藥效模型,從而達到藥物設計的目的,是實現合理藥物設計的基本手段和工具。目前,該技術已滲透并介入到藥物發現、設計、開發等各個階段,通過對藥物先導化合物結構的優化及新的作用蛋白靶點的模型構建,簡化了藥物研究的前期過程,從而比以往的高通量篩選技術,顯現出了獨特的優越性[1]。隨著近年來生物信息學技術和化學信息技術的不斷革新,新的作用蛋白靶點不斷被研究、發現和構效解析,為CADD的研究提供了廣闊的發展空間,同時也為中藥及其復方藥效物質基礎的研究提供了強大的工具,為中藥及其復方藥效物質基礎和分子機制的研究帶來新的機遇。石薺Mosla scabra為唇形科草本植物,具有清熱解毒、理氣化濕的功效,《浙江民間常用草藥》記載其主治夏日感冒、腹痛泄瀉、跌打損傷等[2]。本課題組在前期研究中發現,石薺 (MDE)具抗炎、抗流感病毒作用[3-4]。本試驗中,在MDE藥效機制及化學成分分析[5-6]的基礎上,采用分子力學和柔性分子對接相結合的方法,以5-羥基-6,7-二甲氧基黃酮及其衍生物為候選藥物,研究其與流感血凝素蛋白(HA)、流感神經氨酸酶(NA)、炎癥靶點環氧合酶 2(COX-2)和炎癥靶點磷酸二酯酶 4(PDE4)受體的相互作用,在此基礎上闡明MDE抗流感病毒的作用機制,為從植物天然產物中篩選流感藥物先導化合物指明方向,也為有針對性地修飾現有的流感藥物提供理論依據。
1 試驗工具與方法
1.1 試驗工具
本研究的蛋白靶點均從Protein Data Bank(PDB)數據庫中獲取。5-羥基-6,7-二甲氧基黃酮及其衍生物均由 Chem Bio 3D Ultra 12.0(美國劍橋公司)構建。采用 Sybyl-X1.1軟件(美國Tripos公司)中的 Surflex-dock模塊和 DS 2.5軟件(美國 Accelrys公司)中的 Pharmacophore Generation模塊進行。采用 iGEMDOCK軟件(臺灣國立Chiao Tung大學)進行分子力學分析。所有計算均在Windows XP操作系統上完成。
1.2 試驗方法
1.2.1 石薺 黃酮類成分數據庫的建立
結合中國科學院上海有機化學研究所化學專業數據庫的子數據庫“中藥與有效成分數據庫”以及PubMed數據庫的子數據庫“Pub Chem compound”,通過 Chem Bio 3D Ultra 12.0 軟件,將其在MMFF94力場下進行結構優化,并保存為SDF格式。候選藥物化學結構見圖1。
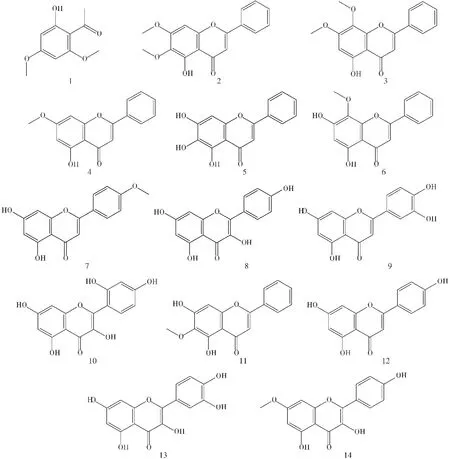
圖1 候選藥物化學結構
1.2.2 針對各靶點的分子對接
HA:HA的晶體結構引自 PDB數據庫,分辨率為 2.50?(PDB ID:2HTY)。保留晶體結構內活性腔附近Ca2+和2個結合水分子,刪除其他雜原子,然后用Biopolymer模塊修正蛋白質晶體結構的化學鍵、添加氫原子(pH=7)和末端氨基酸殘基的修飾。因為抑制劑和血凝素蛋白的作用是發生在水溶液中,故采用半徑為8?的TIP3P水模型,將血凝素蛋白結構置于其中。
NA:NA的晶體結構引自PDB數據庫,分辨率為2.49?(PDB ID:309K)。保留結晶水,對照 NA-乙酰葡萄酰胺(NAG)復合物晶體結構(PDB ID:1F8B)補齊缺失殘基,并加入氫原子及其他遺漏原子,能量優化后構型作為對接起始結構。將蛋白進行預處理,刪除水分子,去掉除NAG以外的所有配體殘基;以NAG為中心生成格點,并在受體8?范圍內進行對接。
COX-2:COX-2的晶體結構引自 PDB數據庫,分辨率為2.90 ?(PDB ID:4COX)。因 COX-2 為同源二聚體,在參考其活性口袋[7]的基礎上,選取其A鏈(即二聚體中的第1個單位),去除配體,加氫,作為分子對接的“受體”。計算過程中僅考慮配體分子8?范圍內的氨基酸殘基與配體的相互作用。首先固定受體COX-2的幾何構型,優化配體分子,然后對配體分子8?范圍內的氨基酸不作任何限制,將配體和受體進行分子對接。
PDE4:PDE4的晶體結構引自PDB數據庫,為PDE-4B2B與抑制劑 NPV 的復合物,分辨率為 1.95?(PDB ID:2QYL)。將蛋白進行預處理,刪除水分子,去掉除NPV以外的所有配體殘基;以NPV為中心生成格點,并在受體8?范圍內進行對接。
1.2.3 分子對接結果分析
通過iGEMDOCK模塊測得MDE黃酮類化合物與各蛋白受體關鍵氨基酸殘基間的范德華作用能、靜電作用能、氫鍵能等數據,以軟件綜合評分(匹配度)為指標進行對接效果評價。其他設置均采用默認值。采用DS 2.5軟件對候選藥物與作用蛋白受體活性位點進行結構分析。
2 結果
2.1 以HA為靶點的分子對接結果
采用iGEMDOCK軟件對候選藥物與HA活性位點進行分子對接,結果按打分高低排序,經統計分析,匹配度打分小于-5(門檻值)的候選藥物共有6個(表1),打分高低排序靠前的5個化學成分分子分別為木犀草素>槲皮素>黃芩素>漢黃芩素>花椒油素,其中以木犀草素與HA活性位點的匹配度最高,證明MDE中所含的黃酮類化合物為天然HA抑制劑。這與Liu等[8]報道的結果一致。同時,由表1可知,各藥物作用能和總能量等數據基本相似,以木犀草素為例,其范德華作用能為-43.26 kcal/mol,氫鍵能為 -26.98 kcal/mol,表明木犀草素等優勢候選藥物與血凝素蛋白之間的主要作用是范德華力。
2.2 以NA為靶點的分子對接結果
采用iGEMDOCK軟件對候選藥物與NA活性位點進行分子對接,結果按打分高低排序,經統計分析,各候選藥物的匹配度分值均小于-5(表1)。打分高低排序靠前的5個化學成分分子分別為鼠李檸檬素>槲皮素>黃芩素>桑色素>MF2,其中以鼠李檸檬素與NA活性位點的匹配度最高,證明MDE中所含的黃酮類化合物為天然NA抑制劑。這與王海娣等[9]報道的結果一致。同時,由表1可知,各藥物作用能和總能量等數據基本相似,以鼠李檸檬素為例,其范德華作用能為-64.18 kcal/mol,氫鍵能為-30.79 kcal/mol,表明鼠李檸檬素等優勢候選藥物與 NA之間的主要作用是范德華力。
2.3 以COX-2為靶點的分子對接結果
采用iGEMDOCK軟件對候選藥物與COX-2活性位點進行分子對接,結果按打分高低排序,經統計分析,各候選藥物的匹配度打分均遠小于-5(表2)。打分高低排序靠前的5個化學成分分子分別為槲皮素>MF2>木犀草素>桑色素>金合歡素,其中以槲皮素與COX-2活性位點的匹配度最高,證明MDE中所含的黃酮類化合物均為天然COX-2抑制劑。同時,由表2可知,各藥物作用能和總能量等數據基本相似,以槲皮素為例,其范德華作用能為 -53.25 kcal/mol,氫鍵能為 -25.10 kcal/mol,表明槲皮素等候選藥物與COX-2之間的主要作用是范德華力。
2.4 以PDE4為靶點的分子對接結果
采用iGEMDOCK軟件對候選藥物與PDE4活性位點進行分子對接,結果按打分高低排序。由于PDE4的活性口袋并非封閉性結合腔,對接分子與結合腔殘基的碰撞情況較少,故整體的對接打分區分度不大,但對接結果較好的分子仍應視為可能具有PDE4抑制活性的化合物。經統計分析,各候選藥物的匹配度打分均遠遠小于 -5(表2)。打分高低排序靠前的5個化學成分分子分別為鼠李檸檬素>黃芩素>槲皮素>山柰酚>金合歡素,其中以鼠李檸檬素與PDE4活性位點的匹配度最高,證明MDE中所含的黃酮類化合物均為天然PDE4抑制劑。同時,由表2可知,各藥物作用能和總能量等數據基本相似,以鼠李檸檬素為例,其范德華作用能為 -90.29 kcal/mol,靜電作用能為 -17.96 kcal/mol,氫鍵能為 -11.98 kcal/mol,表明鼠李檸檬素等優勢候選藥物與PDE4之間的主要作用是范德華力。
2.5 石薺 黃酮類成分抗流感作用的綜合評價
以HA,NA,COX-2和PDE4分子對接打分排序前20%的分子作為可能具有 HA,NA,COX-2和 PDE4生物抑制活性的分子,分析MDE中MF1及其衍生物的多靶導向作用。由表1及表2可知,共有7個化合物(黃芩素、鼠李檸檬素、槲皮素、木犀草素、金合歡素、桑色素和MF2)可同時抑制2個及以上靶標蛋白,其中槲皮素對4個靶標均呈較強的抑制作用,提示這些化合物可作為潛在的抗病毒、抗炎先導化合物。而MF1,MF2和MF3也均表現出不同程度的抗流感病毒和抗炎作用,證明這三者是MDE發揮抗流感病毒和抗炎作用的藥效物質。
3 討論
CADD是近年來發展起來的研究與開發新藥的一種嶄新技術,以量子化學、分子力學和分子動力學等為理論依據,借助計算機數值計算和邏輯判斷、數據庫、圖形學、人工智能等處理技術,進行合理的藥物設計。CADD的出現大大加快了研制新藥的速度,節省了新藥開發工作的人力、物力和財力,因為它從理論的角度出發,可避免以前研究中一定程度的盲目性,能進行直觀地設計,指導有目的地開發新藥[10]。以美國 Structure Bioinformatics Inc.(SBI)提供的數據為例,平均每個新靶點需篩選10萬個化合物,其命中率為0.1% ~0.01%,而以CADD進行新藥設計,其命中率可提高到 5%~20%,可減少 99.9%的費用。目前應用CADD成功設計出的新型藥物已有大量報道,如由Merck Sharp and Dohme公司開發的用于治療青光眼的碳酸酐酶抑制劑多佐拉米(Dorzolamid)、由Roche公司開發的 HIV蛋白酶抑制劑類抗艾滋病藥物沙奎那韋(saquinavir)等,而設計成功已進入臨床研究階段的藥物更多。世界上許多規模較大的制藥公司,近20年來紛紛投入巨資建立計算機理論和應用研究部門,以帶動新藥開發。
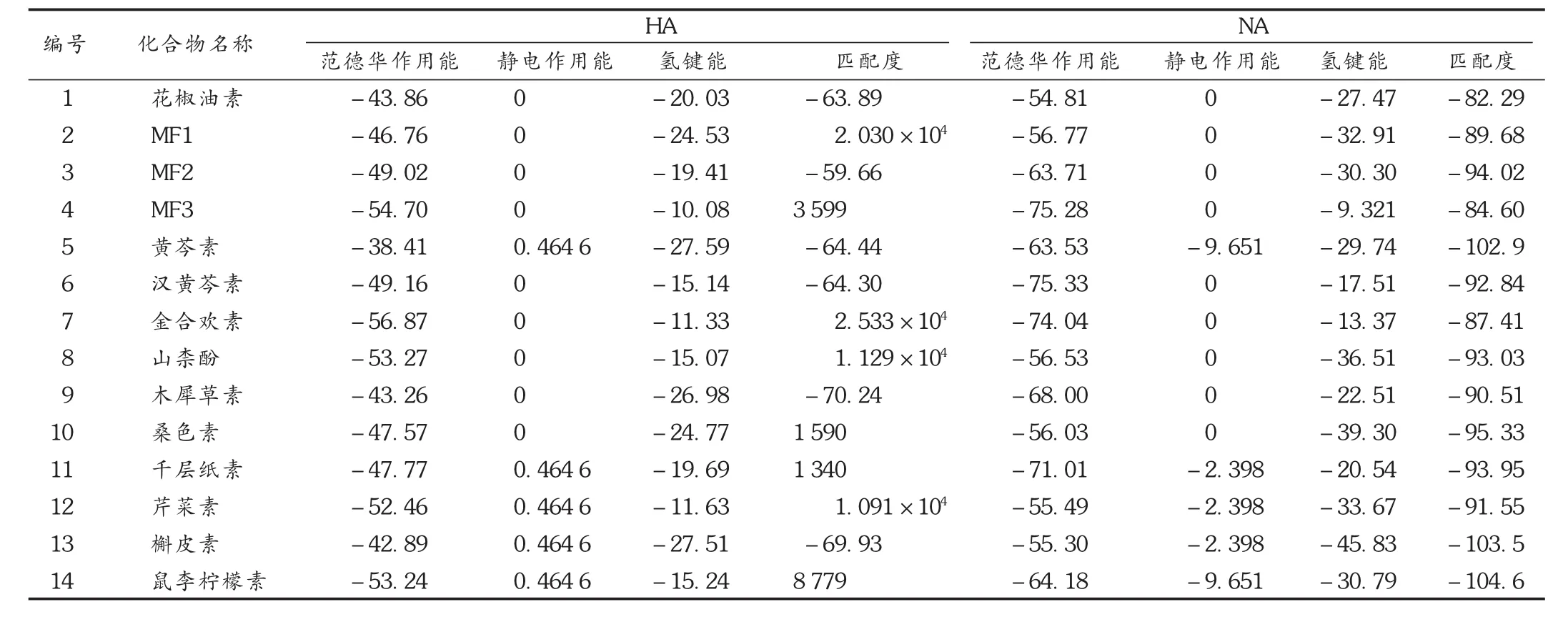
表1 候選藥物與HA及NA的分子對接結果
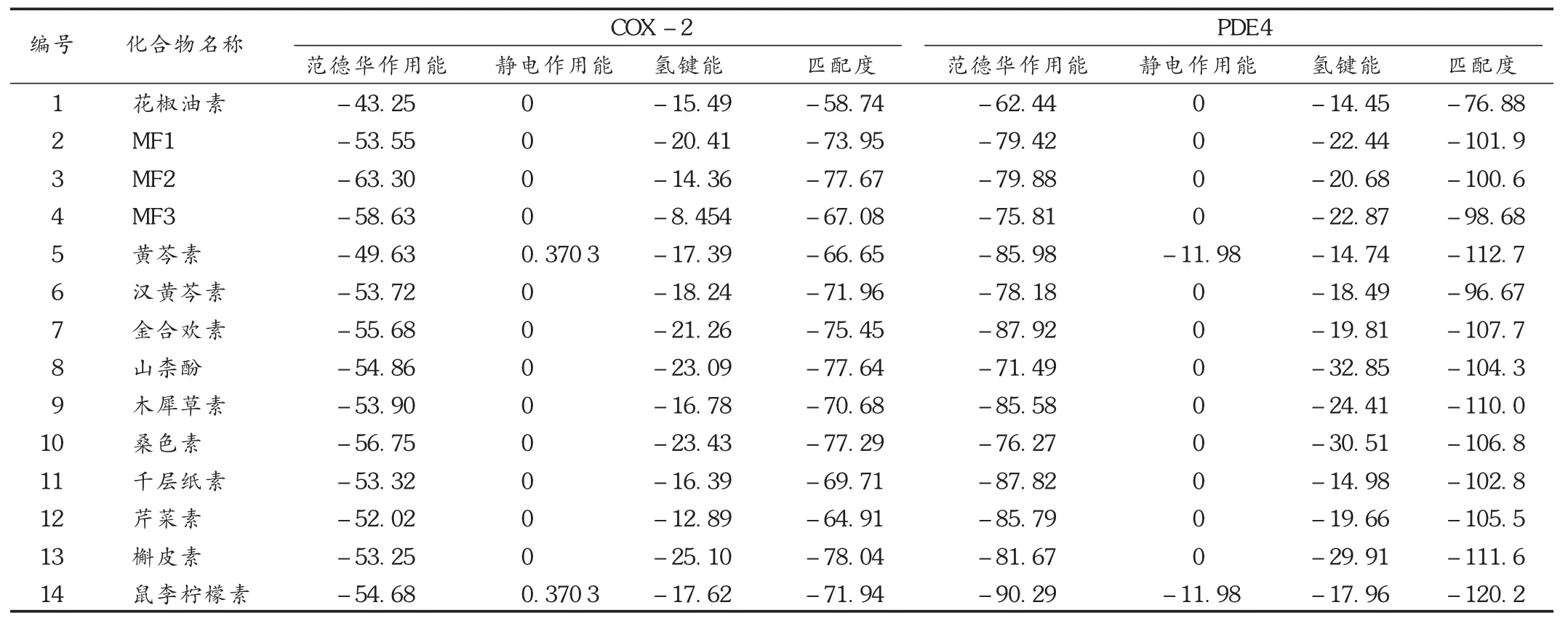
表2 候選藥物與COX-2及PDE4的分子對接結果
中草藥治療流行性感冒有數千年的歷史,不少方藥具有獨特的療效,并通過多靶點、多途徑發揮作用[11-12]。這種多靶向作用一方面表現在多成分的多靶向作用,另一方面也可能存在單個分子的多靶向作用,而正是由于這種多靶向“霹彈”作用的原理,彌補了中藥復方針對單靶藥效不強的缺陷,表現出整體治療、治調并舉的特色。如何用現代語言闡釋這種整體治療的原理與特色,到目前為止還是中醫藥研究領域的難點之一。中草藥在防治流感病毒方面具有獨特的優勢和廣闊的應用前景[13],但中藥及其復方常含有數百種化學成分,其真正的藥效物質基礎目前還知之甚少,其防治疾病的分子機制也尚未明確。因此,有必要對中藥及其復方藥效物質基礎和分子機制進行深入研究,并作出科學詮釋。
本試驗中通過CADD技術,綜合應用分子對接、藥效團模型及虛擬篩選方法,以抗流感病毒和抗炎作用為研究對象,對多靶點治療的藥效學作出闡釋。選取目前已明確的流感病毒蛋白靶標(HA和 NA)及炎癥靶標(COX-2和 PDE4),對化學成分分子庫進行虛擬篩選,并在此基礎上進行綜合分析。由表1及表2可知,MDE中化學成分對流感病毒蛋白靶點和炎癥相關蛋白靶點均具有一定的結合和抑制效應。MDE不僅存在多成分多靶點效應,而其中一些單分子本身也具有多靶點導向作用,即1個分子能同時對2個或2個以上的靶點產生作用,證明了中藥及其復方多靶點治療效應的物質基礎。
由于流感及其續發病癥發病機理涉及的信號轉導通路和靶點繁復龐雜,相關機制也正在深入研究之中。作為一項探索性研究,本試驗只選擇了與流感及其續發病癥病毒性肺炎明確相關的炎癥機制中的幾個關鍵靶點進行研究,靶標選擇數量上略顯不足。在后續工作中,靶標數目的增加,無疑將增強MDE多靶點導向效應的說服力度。
參考文獻:
[1]陳凱先,蔣華良,嵇汝運.計算機輔助藥物設計——原理、方法和應用[M].上海:上海科學技術出版社,2000:7-15.
[2]浙江省衛生局.浙江民間常用草藥(第3集)[M].杭州:浙江人民出版社,1972:69.
[3]聶 ,余陳歡,王芳芳,等.石薺 總黃酮抗炎作用及其機制研究[J].時珍國醫國藥,2008,19(1):65-66.
[4]吳曉寧,吳巧鳳,陳 京.浙江產石薺 屬植物研究進展[J].浙江中醫學院學報,2005,29(4):92-93.
[5]Yu CH,Yan YL,Wu XN,et al.Anti-influenza virus effects of the aqueous extract from Mosla Scabra[J].Journal of Ethnopharmacology,2010,127(2):280-285.
[6]Wu QF,Yu CH,Yan YL,et al.Antiviral flavonoids from Mosla scabra[J].Fitoterapia,2010,81(5):429-433.
[7]Kurumbail RG,Stevens AM,Gierse JK.Structure basis for selective inhibitor of cycloxygenase-2 by anti-inflammatory agents[J].Nature,1996,384(19):644-648.
[8]Liu AL, Wang HD, Lee SM, et al.Structure-activity relationship of flavonoids as inhibitors and their in vitro anti-viral activities[J].Bio Med Chem,2008,16(15):7 141-7 147.
[9]王海娣,杜冠華,劉艾林.天然黃酮類化合物的神經氨酸酶抑制活性評價[J].中國新藥雜志,2009,18(15):1 435-1 439.
[10]高 麗,劉艾林,杜冠華.計算機輔助藥物設計在新藥研發中的應用進展[J].中國藥學雜志,2011,46(9):641-645.
[11]趙宏偉,趙玉珍.金蓮花醇提物體外抗甲型流感病毒作用研究[J].中國藥業,2010,19(1):10-11.
[12]何維英,高榮梅,李興瓊,等.10種中成藥體外抗流感病毒活性研究[J].藥學學報,2010,45(3):395-398.
[13]張其威,張楚瑜.抗病毒中藥研究的最新進展[J].中成藥,2005,27(1):116-119.

