ERO1α及其DNA甲基化在同型半胱氨酸抑制肝細胞增殖中的作用
趙 麗,曹成建,劉現(xiàn)梅,孔繁琪,馬文斌,周龍霞,陳久凱,張鳴號,焦 運,楊曉玲,姜怡鄧
(寧夏醫(yī)科大學1.檢驗學院、2.基礎(chǔ)學院、3.總醫(yī)院,寧夏 銀川 750004)
同型半胱氨酸(homocysteine,Hcy)是甲硫氨酸代謝的中間產(chǎn)物,研究表明其可能通過甲硫氨酸循環(huán)影響基因的甲基化水平參與疾病的發(fā)生[1]。內(nèi)質(zhì)網(wǎng)氧化還原酶-1α(endoplasmic reticulum oxidoreductin 1-α,ERO1α)是存在于內(nèi)質(zhì)網(wǎng)的一種氧化酶,對維持內(nèi)質(zhì)網(wǎng)穩(wěn)態(tài)發(fā)揮重要的作用[2],主要負責維持肝細胞生長、支持細胞生存等[3],研究表明,Hcy可通過內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress,ERs)抑制肝細胞增殖[4],但 Hcy是否通過影響ERO1αDNA甲基化及其表達進而抑制肝細胞增殖目前未見報道。因此,本研究擬從DNA甲基化修飾角度探討ERO1α在Hcy抑制肝細胞增殖中的作用,為防治高同型半胱氨酸血癥(hyperhomocy steinemia,HHcy)提供理論依據(jù)。
1 材料與方法
1.1 主要儀器及試劑 超凈工作臺(蘇州安泰,中國);CO2培養(yǎng)箱(Heraeus,德國);實時熒光定量PCR儀(上海風嶺,中國);普通PCR儀(Bio-Rad,美國);Epoch全波段酶標儀(BioTek,美國);電泳儀(Bio-Rad,美國);凝膠成像儀(Bio-Rad,美國);RPMI1640培養(yǎng)基(Gibco);胎牛血清(Gibco);青、鏈霉素(碧云天生物技術(shù)研究所)胰酶(Solarbio);同型半胱氨酸(Hcy,Sigma);DNA提取試劑盒(TIANGEN);RNA提取試劑盒(TIANGEN);逆轉(zhuǎn)錄試劑盒(Fermantas);熒光定量試劑盒(Fermantas);anti-ERO1α(Abcom);HRP標記二抗(北京中杉);全蛋白提取試劑盒,MTT試劑盒(南京凱基生物科技發(fā)展有限公司);lipo2000(Invitrogen);DNA甲基化修飾試劑盒(ZYMO);引物(上海生工)。
1.2 方法
1.2.1 細胞分組及處理 HL7220肝細胞株購自長沙市湘雅研究所細胞庫。用含10%胎牛血清及1%雙抗的RPMI 1640培養(yǎng)液,于37℃、含5%CO2的培養(yǎng)箱中傳代培養(yǎng)。用含100μmol·L-1Hcy的培養(yǎng)液刺激細胞,并設(shè)置正常對照組(0μmol·L-1Hcy),每組重復3次,孵育48 h后收集細胞,凍存于-80℃,待用。
1.2.2 熒光定量PCR法檢測ERO1αmRNA的表達在Pubmed數(shù)據(jù)庫中查詢ERO1α獲取其編碼序列,采用Premier5.0設(shè)計相關(guān)引物。提取各組細胞的總RNA,按逆轉(zhuǎn)錄試劑盒說明書將mRNA反轉(zhuǎn)錄為cDNA,逆轉(zhuǎn)錄的反應(yīng)條件為:42℃60 min,70℃5 min。以cDNA為模板進行熒光定量PCR。ERO1α熒光引物(上游 5′-ATCCTTTGGCTTCTGGTCAAG-3′;下游 5′-GTTGTGTCCCCATTTCTTTTCT-3′),PCR反應(yīng)條件為:95℃ 10 min;95℃15 s,58℃ 30 s,72℃30 s,40個循環(huán)。
1.2.3 Western blot檢測 ERO1α蛋白的表達 采用全蛋白提取試劑盒提取兩組細胞全蛋白,取20μl進行SDS-PAGE凝膠電泳,120 mA恒流轉(zhuǎn)膜1 h,5%的脫脂奶粉封閉2 h,與anti-ERO1α4℃孵育過夜,HRP標記二抗孵育2 h,于凝膠成像分析儀上成像分析,以 β-actin為內(nèi)參,計算 ERO1α與 β-actin內(nèi)參灰度值的比值,進行分析。
1.2.4 ERO1α重組質(zhì)粒的構(gòu)建及轉(zhuǎn)染 提取肝細胞基因組DNA,擴增ERO1αDNA片段。上游引物:5′-CCGCTCGAGATGGGCCGCGGCTGGGGATTCTTGT-3′,下游引物:5′-AATTCTGCAGATGAATATTCTGTAACAAGTTCCTGAAGTTTTC-3′。設(shè)計 XhoI和 Pst I為酶切位點。將提純的ERO1αDNA片段與EGFPN1質(zhì)粒分別用XhoI和Pst I進行雙酶切。用T4連接酶將ERO1αDNA片段定向克隆到EGFP-N1質(zhì)粒的XhoI和Pst I酶切位點。構(gòu)建的重組質(zhì)粒命名為EGFP-N1-ERO1α。將重組質(zhì)粒轉(zhuǎn)入大腸桿菌DH5α感受態(tài)細胞中。挑取在含有氨芐青霉素的LB平板生長的單菌落,小量培養(yǎng)后,用特異性ERO1α引物對菌液進行PCR篩選,電泳驗證產(chǎn)物長度。同時將培養(yǎng)菌株送上海生工公司進行測序。肝細胞密度達80%時,用lipo2000將重組質(zhì)粒轉(zhuǎn)染入肝細胞,以無血清培養(yǎng)基孵育6h。除去培養(yǎng)基,以含10%胎牛血清的培養(yǎng)基孵育48 h。
1.2.5 MTT檢測肝細胞增殖活力 將肝細胞吹打成單細胞懸液,在96孔板中加入細胞懸液100μl/孔(約1×104),37℃、5%CO2環(huán)境培養(yǎng)24 h。除去培養(yǎng)液,分別加入普通培養(yǎng)液及含100μmol·L-1Hcy的培養(yǎng)液,每組8孔,孵育48 h后,除去培養(yǎng)液,每孔加50μl 1×MTT,37℃孵育4 h,除去上清,每孔加150μl DMSO,搖勻后用酶標儀測定550 nm波長處各孔的吸光度。
1.2.6 巢式降落式甲基化特異性 PCR(ntMSPCR)檢測ERO1α啟動子區(qū)DNA甲基化按DNA提取試劑盒說明書提取各組細胞全基因組DNA,亞硫酸鹽修飾法對全基因組DNA進行甲基化修飾。nt-MSP法檢測ERO1α啟動子區(qū)DNA甲基化程度的改變。針對 ERO1α啟動子區(qū),在線(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)設(shè)計一對外引物及兩對內(nèi)引物(外引物:上游5′-CCAATCCTAATCTTTTAA CATTCAAA-3′,下 游 5′-TAGTTTGGGTAATATGGTGAAATTT-3′;甲基化引物:上游5′-ACTAACCTACAATAATAC GATCGCA-3′,下游 5′-AGTTTGGGTAATATGG TGAAA TTTC-3′;非甲基化引物:上游 5′-ACTAACCTA CAATAAT ACAATCACA-3′,下游5′-AGTTTGGGTAATATGGTGAAATTTC-3′)。外引物擴增的反應(yīng)條件為:95℃ 5 min;95℃30 s,62℃ 30 s,72℃ 30 s,20個循環(huán),每個循環(huán)降0.5℃至49℃,72℃7min。以外引物的PCR產(chǎn)物為模板,進行內(nèi)外引物的擴增。反應(yīng)條件同外引物。取5μl PCR產(chǎn)物于2%的瓊脂糖凝膠上電泳,用凝膠成像分析儀成像并分析甲基化條帶及非甲基化條帶的光密度,按如下公式進行計算:甲基化/%=甲基化OD值/(甲基化OD值+非甲基化OD值)×100%。
1.3 數(shù)據(jù)處理與分析 采用SPSS11.5軟件進行統(tǒng)計處理,結(jié)果以ˉx±s表示。兩樣本間比較采用t檢驗,多樣本間比較采用單因素方差分析。
2 結(jié)果
2.1 Hcy抑制肝細胞增殖 100μmol·L-1Hcy刺激肝細胞48 h后,以MTT法檢測正常對照組及Hcy干預組肝細胞增殖活力的改變,結(jié)果顯示:與正常對照組相比,Hcy組肝細胞增殖活力明顯降低,差異有統(tǒng)計學意義(P<0.01),見 Fig 1。
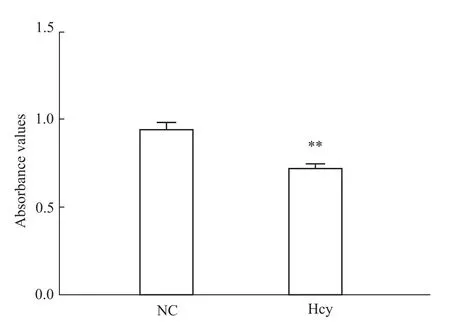
Fig 1 Hcy inhibits proliferative activity of hepatocytesCellswere treated with 100μmol·L-1 Hcy for48h.**P<0.01 vs NC group
2.2 Hcy抑制 ERO1α的表達 100μmol·L-1Hcy刺激肝細胞48 h后,分別以熒光定量PCR及Western blot檢測正常對照組及Hcy干預組ERO1α mRNA及蛋白的表達水平。結(jié)果顯示,Hcy干預后,ERO1αmRNA和蛋白表達水平均明顯降低(P<0.01),見 Fig 2。
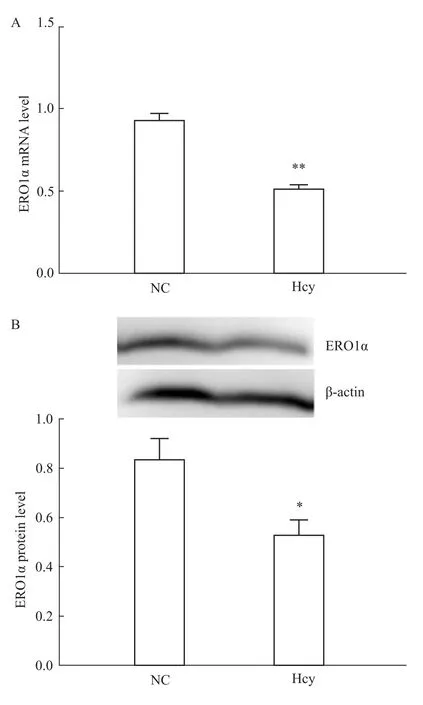
Fig 2 Hcy inhibits expression of ERO1αA:Change of ERO1αmRNA expression of the NC and Hcy groups;B:Change of ERO1αprotein expression of the NC and Hcy groups.Cells were treated with 100μmol·L-1 Hcy for48 h.*P<0.05,**P<0.01 vs NC group
2.3 ERO1α參與Hcy抑制肝細胞增殖 測序結(jié)果證明ERO1α重組質(zhì)粒構(gòu)建成功,見Fig 3A。轉(zhuǎn)染肝細胞后,熒光顯微鏡下觀察可見綠色熒光蛋白表達明顯,見 Fig 3B。qRT-PCR及 Western blot驗證ERO1αmRMA及蛋白表達增加,見Fig 3C,D。MTT法檢測ERO1α過表達后肝細胞增殖活力的改變,與對照組相比,ERO1α重組組肝細胞增殖活力明顯升高,差異有顯著性(P<0.01),見 Fig 3E。
2.4 Hcy導致 ERO1αDNA甲基化改變 100 μmol·L-1Hcy刺激肝細胞后,分析ERO1αDNA甲基化水平的改變。結(jié)果顯示:與正常對照組相比,ERO1αDNA甲基化程度增加,差異有顯著性(P<0.05),見 Fig 4。
3 討論
肝損傷病人依賴于肝臟的再生恢復正常代謝,而肝細胞增殖是肝臟再生的基礎(chǔ)。HHcy被認為是肝纖維化、非酒精性脂肪肝等的獨立危險因子[5-6]。研究表明Hcy可擾亂肝細胞正常的細胞周期進而抑制其增殖[4]。本研究結(jié)果顯示Hcy刺激后肝細胞增殖活力減弱,與文獻報道一致。
ERs是Hcy誘導細胞發(fā)生功能障礙的機制之一,ERO1α又名內(nèi)質(zhì)網(wǎng)氧化還原樣蛋白(endoplasmic reticulum oxidoreduclin-like protein1α),是一種黃素蛋白,主要存在于內(nèi)質(zhì)網(wǎng),其編碼基因位于人類第14號染色體上,研究表明,其主要作用為參與新生肽鏈正確折疊成有生物活性的蛋白質(zhì)[2]、維持細胞增殖等,其表達異常可引起內(nèi)質(zhì)網(wǎng)應(yīng)激。ERO1α依賴的內(nèi)質(zhì)網(wǎng)應(yīng)激可引起Ca2+釋放,進而觸發(fā)細胞凋亡途徑。而ERO1α是否參與了Hcy導致的肝細胞增殖抑制未見報道。本研究結(jié)果表明:Hcy在抑制肝細胞增殖的同時,也導致了ERO1αmRNA及蛋白表達水平的明顯下降。多次重復試驗均得到一致的結(jié)果,提示ERO1α可能參與了Hcy抑制肝細胞增殖的過程。為了進一步驗證此結(jié)果,構(gòu)建了ERO1α重組質(zhì)粒并轉(zhuǎn)染肝細胞使其過表達,發(fā)現(xiàn)ERO1α過表達后Hcy對肝細胞增殖的抑制作用明顯降低,表明ERO1α在Hcy抑制肝細胞增殖過程中發(fā)揮了關(guān)鍵作用。
Hcy是一種含硫氨基酸,是甲硫氨酸代謝的中間產(chǎn)物,參與了甲硫氨酸循環(huán)的關(guān)鍵環(huán)節(jié)[7]。Hcy濃度異常可導致甲硫氨酸循環(huán)紊亂,使甲基供體生成量改變引起多個基因甲基化狀態(tài)的改變。DNA甲基化是指CpG位點的胞嘧啶被甲基修飾,從而在基因結(jié)構(gòu)不發(fā)生改變的基礎(chǔ)上調(diào)節(jié)基因的轉(zhuǎn)錄,DNA甲基化是發(fā)現(xiàn)較早的表觀遺傳學修飾方式之一,大量研究表明,DNA甲基化能引起染色質(zhì)結(jié)構(gòu)、DNA穩(wěn)定性、DNA與轉(zhuǎn)錄因子結(jié)合情況的改變[8-9],從而控制基因表達。前期研究也發(fā)現(xiàn) Hcy可使多種基因的甲基化狀態(tài)發(fā)生改變,進而影響其表達。一般來講,DNA甲基化改變包括低甲基化和高甲基化,低甲基化可促進基因的表達,而高甲基化則抑制基因表達[10]。ERO1α啟動子區(qū)富含CpG位點,因此設(shè)想,DNA甲基化這一表觀遺傳學機制可能參與了Hcy調(diào)控ERO1α的表達進而抑制肝細胞增殖,因此我們進一步檢測了Hcy干預后ERO1α啟動子區(qū)甲基化程度的改變。研究結(jié)果表明:Hcy提高了ERO1α啟動子區(qū)DNA甲基化程度,而DNA高甲基化是基因轉(zhuǎn)錄抑制的重要標志,與ERO1α mRNA及蛋白表達水平降低相一致。
綜上所述,Hcy可能增加 ERO1α啟動子區(qū)DNA甲基化程度,使ERO1α表達水平降低,進而導致肝細胞增殖抑制。此發(fā)現(xiàn)可能是Hcy導致肝功能障礙的重要機制,為進一步了解Hcy與肝臟疾病的關(guān)系提供了新的實驗依據(jù)。
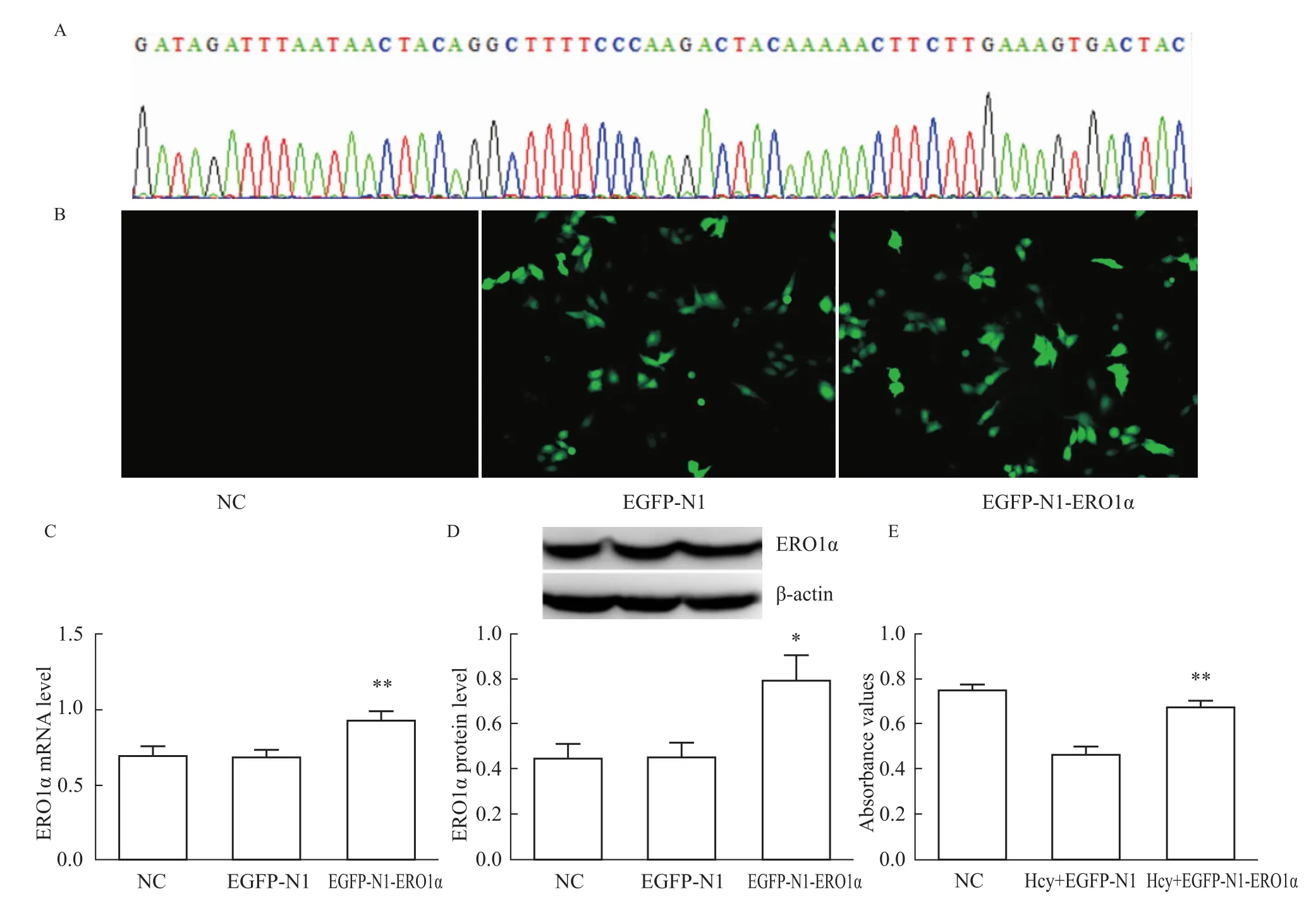
Fig 3 ERO1αinvolved in Hcy-induced proliferation inhibition of hepatocytesA:Result of sequencing of ERO1αrecombinant plasmid;B:Fluorescence images of hepatocyteswith recombinant plasmids;C:Change of ERO1α mRNA expression after transfected with recombinant plasmids;D:Change of ERO1αprotein expression after transfected with recombinant plasmids;E:Change of proliferative activity after transfected with recombinant plasmids.*P<0.05,**P<0.01 vs NC group
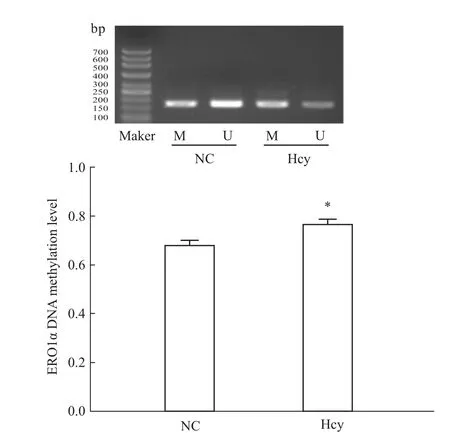
Fig 4 Hcy causes the change of ERO1αDNA methylation levelM:Methylated production;U:Unmethylated production.Cells were treated with 100μmol·L-1 Hcy for 48 h.*P<0.05 vs NC group.
參考文獻:
[1] Jiang Y,Zhang H,Sun T,etal.The comprehensive effects of hyperlipidemia and hyperhomocysteinemia on pathogenesis of atherosclerosis and DNA hypomethylation in ApoE-/-mice[J].Acta Biochim Biophys Sin,2012,44(10):866-75.
[2] Masui S,Vavassori S,F(xiàn)agioli C,et al.Molecular bases of cyclic and specific disulfide interchange between human ERO1 protein and protein-disulfide isomerase(PDI)[J].J Biol Chem,2011,286(18):16261-71.
[3] Rutkevich L A,Williams D B.Vitamin K epoxide reductase contributes to protein disulfide formation and redox homeostasiswithin the endoplasmic reticulum[J].Mol Biol Cell,2012,23(11):2017-27.
[4] Yu X,Lv JJ,Zhu Y Z,et al.Homocysteine inhibits hepatocyte proliferation via endoplasmic reticulum stress[J].Plos One,2013,8(1):e54265.
[5] Liu W H,Zhao Y S,Gao SY,etal.Hepatocyte proliferation during liver regeneration is impaired in mice with methionine diet-induced hyperhomocysteinemia[J].Am J Pathol,2010,177(5):2357-65.
[6] Aissa A F,Tryndyak V,de Conti A,et al.Effect ofmethioninedeficient and methionine-supplemented diets on the hepatic onecarbon and lipid metabolism in mice[J].Mol Nutrit Food Res,2014,58(7):1502-12.
[7] 楊安寧,王 磊,周龍霞,等.ABCA1、ACAT1 DNA甲基化在Hcy致THP-1單核細胞源性泡沫細胞膽固醇流出中作用研究[J].中國藥理學通報,2014,30(3):340-4.
[7] Yang A N,Wang L,Zhou L X,etal.Effectsof Hcy on cholesterol effux of THP-1 monocyte-derived foam cells and mechanism of ABCA1 and ACAT1 DNA methylation regulation[J].Chin Pharmacol Bull,2014,30(3):340-4.
[8] Wang R,Xu J.Genomic DNA methylation and histone methylation[J].Yi Chuan,2014,36(3):191-9.
[9] Pacaud R,Sery Q,Oliver L,et al.DNMT3L interacts with transcription factors to target DNMT3L/DNMT3B to specific DNA sequences:Role of the DNMT3L/DNMT3B/p65-NFκB complex in the(de-)methylation of TRAF1[J].Biochimie,2014,18,[Epub ahead of print].
[10]楊 程,田 玨,蔡 欣,等.動脈粥樣硬化患者基質(zhì)金屬蛋白酶組織抑制劑1基因DNA高甲基化的研究[J].實用醫(yī)學雜志,2013,29(21):3530-2.
[10]Yang C,Tian J,Cai X,etal.A research ofmatrixmetalloproteinases inhibitor 1 DNA hypermethylation in atherosclerosis[J].J Pract Med,2013,29(21):3530-2.