生物技術藥物發展現狀及我國的對策研究
孟祥海,高山行,舒成利
(1.西安交通大學管理學院,陜西 西安 710049;2.陜西醫藥控股集團有限責任公司,陜西 西安 710075)
一、引言
生物醫藥產業是一個知識密集型、技術密集型和關系國計民生的產業,主要包括化學藥品、中藥、生物技術藥物等領域,是七大戰略性新興產業之一[1]。生命體是多層次、非線性、多側面的復雜結構體系,人體內有大約25000個基因,每個基因負責一個特定蛋白質,基因產生身體所需的酶、激素、抗體和蛋白質等。如果一個基因缺失或有缺陷,身體將不會產生特定功能的蛋白質或者產生導致疾病的蛋白質[2]。生物技術是當代最具潛力和活力的科技領域之一,它作為醫藥科技革命的推進器正在悄然拓展和創新醫藥功能。生物技術藥物是從生物體提取或生產而來的,以預防和治療為目的的藥物制品,其中經常會運用到DNA重組技術,主要包括單克隆抗體、疫苗、重組激素/蛋白質、基因治療、細胞療法等。生物技術藥物使得很多傳統醫藥無法處理的遺傳性和后天病理性的代謝、免疫、內分泌、心血管以及生殖等疾病能夠獲得有效治療[3]。近年來,以基因工程、細胞工程、蛋白質工程等為代表的現代生物技術發展迅速,采用生物技術生產的藥物在發達國家中持續快速增加。目前,大部分發達國家均把生物技術作為發展醫藥工業的戰略重點。
我國生物技術藥物突破性的創新還比較少,處于行業前端的生物技術公司也相對較少,與世界先進水平還有較大距離。由于生物技術藥物研發與產業化難度大、門檻高,需要大量資金和優秀科研團隊,導致我國大部分生物技術藥物公司心有余而力不足。
二、全球生物技術藥物發展現狀和趨勢
生物技術藥物研發要經過藥物發現階段、臨床前研究階段、臨床研究階段,最后才能獲得藥品監管部門的批準。在美國,研發時間平均為97.7個月,以2005年美元計算,包括時間成本,估計臨床前研究需支出6.15億,臨床研究需支出6.26億美元,共需耗費12.41億美元,總花銷與小分子新藥研發支出(13.18億美元)相近[4]。結構決定了功能,大多數生物技術藥物具有特別復雜的分子結構,其分子量大小甚至會超過500000道爾頓,現有的科學還不能完全分析其結構特征,因此經常根據制造工藝保證他們的結構。溫度或是其他因素的細微變化都會顯著地影響生物技術藥物的安全性和臨床療效[5]。
(一)生物技術藥物發展現狀
自1982年第一個重組人胰島素上市以來,經過30余年的發展,目前有150多個生物技術藥物上市,其中一些成為市場上重磅炸彈式的藥物[5]。生物技術藥物銷售收入已連續多年保持了15%以上的增速,世界前20位暢銷藥中有7個生物技術藥物[6]。一般講,生物技術藥物生產企業是指生物技術藥物貢獻了一半以上營業收入的醫藥企業[7]。據此,2011年,全球10大生物技術藥物公司如表1所示,羅氏以371億美元居首,安進以156億美元次之。2011年10大生物技術藥物如表2所示,藥物以單抗為主,雅培的治療類風濕性關節炎的阿達木單抗以79億美元成為最暢銷生物技術藥物。
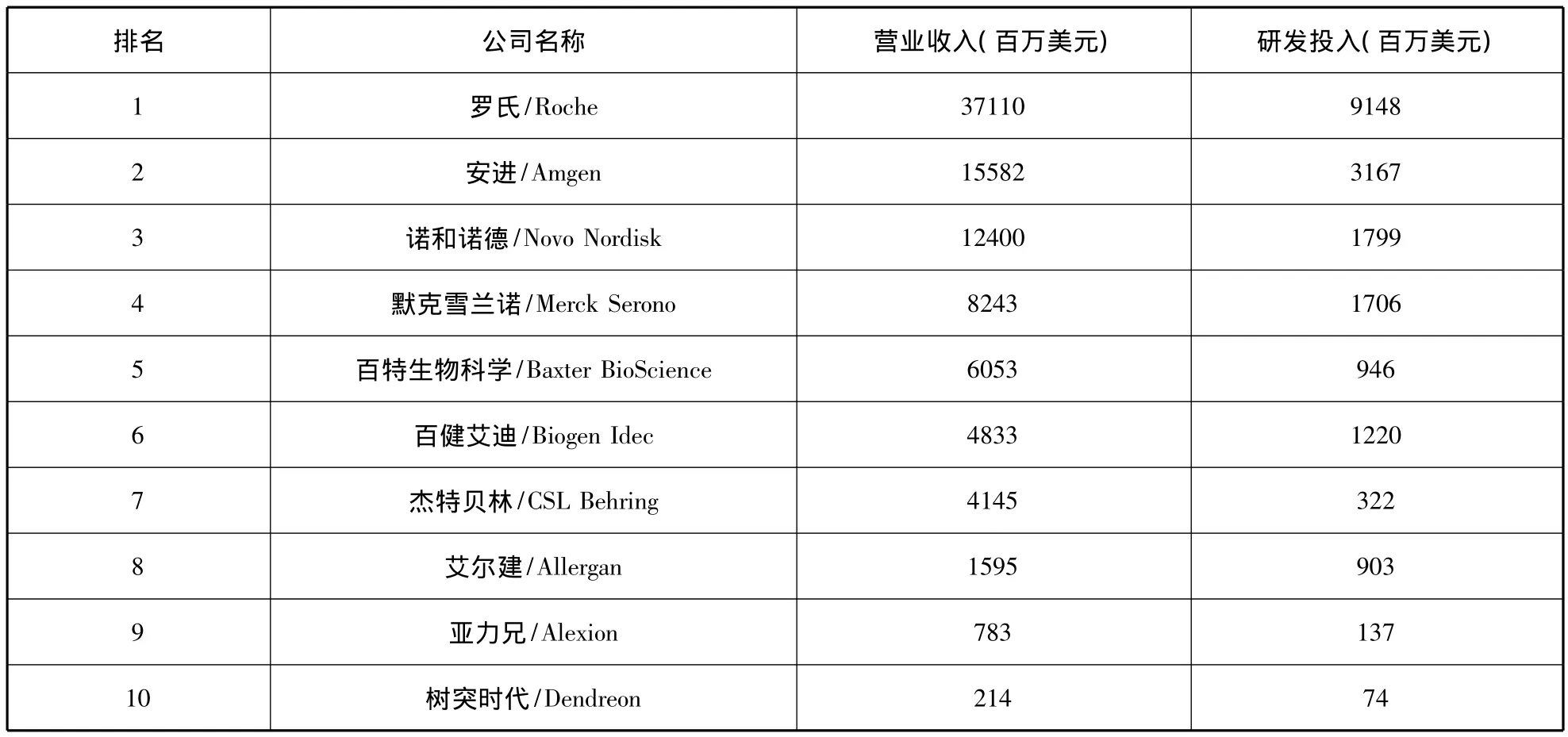
表1 2011年10大生物技術藥物公司(根據生物技術藥物營業收入排名)
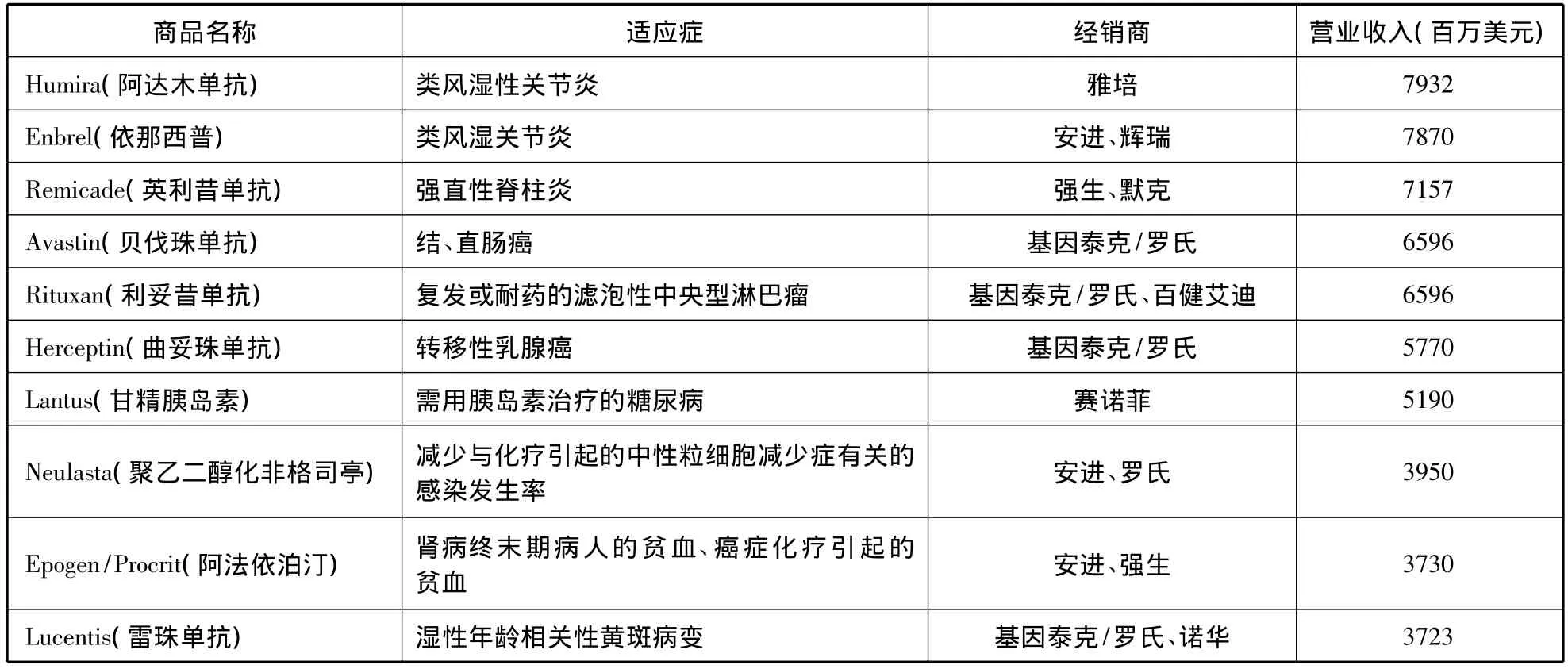
表2 2011年10大生物技術藥物
(二)生物技術藥物發展趨勢
1.生物技術成為發展醫藥工業的戰略重點
主要發達國家對生物技術寄托了很大的期望。美國于2009年和2011年兩度發布《國家創新戰略》,將生物技術作為國家優先發展領域之一;歐盟于2010年3月制定了《歐洲2020戰略》,確立了生物技術作為優先發展領域的戰略[9]。美國有一套較為完整、相互配合的促進創新的法律體系,從20世紀80年代開始,美國制定和實施了大量促進技術創新和轉移的政策,包括《史蒂文森——懷德勒技術創新法》(Stevenson-Wydler Technology Innovation Act)、《貝耶——多爾大學及小企業專利法》(Bayh-Dole University and Small Business Patent Act)、《聯邦技術轉移法》(Federal Technology Transfer Act)、《加強小企業研究與發展法》(Small Business Research and Development Enhancement Act)和《技術轉移商業化法》(Technology Transfer Commercialization Act),基本上涵蓋了從研究開發到產業化的全過程[10],對技術創新、技術轉移、知識產權、支持小企業等多個方面的內容都作出了明確的規定。針對生物技術藥物,美國加大對基礎研究與轉化研究的支持力度,制定政策重點在于支持創新型小企業的發展,引導風險資本進入生物技術藥物研發領域,支持具有潛力的生物技術公司通過首次公開募股(IPO)募集研發資金。在審評上,美國食品藥品管理局(FDA)不斷完善生物技術藥物與生物仿制藥審批的規定、指導原則與流程,為了鼓勵研發,提高創新性藥品的審批速度和質量,FDA以臨床需要為主要導向,讓社會亟需的生物技術藥物通過優先審評(priority reviews)、加速審批(accelerated approval)和快速通道(fast-track)三類特殊的審批機制,縮短審批時間,加速創新產品上市。
2.生物技術公司在不斷成長
生物技術公司是將生物技術新發現與醫藥結合的重要紐帶,它對于市場具有很強的嗅覺,雖然面臨全球金融危機,但生物技術公司伴隨著生物技術的新發現與新應用,優勝劣汰,仍在不斷成長。美國和歐洲培育有眾多成長中的生物技術公司,他們是未來生物技術藥物研發的重要生力軍。根據安永公司報告[11],2012年,美國生物技術公司共計2175家,其中上市公司316家。上市公司收入為637億美元,研發支出為193億美元,凈利潤為45億美元,市值3603億美元,員工人數為100100人,相比2011年,分別增加了8%、7%、34%、30%和2%。在金融危機中,美國生物技術公司仍然保持著較好的成長。2012年,歐洲生物技術公司共計1964家,其中上市公司165家。上市公司收入為204億美元,研發支出為49億美元,市值798億美元,員工人數為51740人。在歐元區仍存在著經濟挑戰和主權債務危機,許多公司獲得資本相比美國更為困難,上市公司研發投入相比2011年降低了1%。
3.集群效應顯現
集群是在某一特定領域中,大量產業聯系密切的企業以及相關支撐機構在空間上集聚。美國生物技術研究組織與企業聚集的波士頓-劍橋、舊金山灣區、新英格蘭、圣迭戈和新澤西地區對于孵化NIH知識進行商業化起到非常重要的作用,地理鄰近和網絡中關鍵成員的組織特征從根本上改變了集群網絡中的信息流[12]。英國的生物技術公司主要集中在牛津郡、劍橋、曼徹斯特、桑德蘭等地區,德國的生物技術公司主要集中在巴伐利亞、慕尼黑、萊比錫、斯圖加特等地區,古巴的生物技術公司主要集中在哈瓦那西部園區。在充滿知識活力的產業集群區開辦的企業有利于知識的傳播和擴散,緘默知識和交互作用的思想在地理上的不斷集聚,增加了企業進行外部學習的機會,推動了創新與產業發展[13]。
4.合作成為藥物創新的重要模式
生物技術藥物研發對生物技術和資本要求很高。2011年羅氏投入了91億美元[7],約占其主營業收入的25%。為了能夠穩定推出用于臨床試驗的候選藥物,同時在生物技術藥物領域占據主導地位,大型制藥公司投入大量資金用于獨立、合作研發,或直接收購新的技術和候選藥物。具有新技術的生物技術中小型企業,研發資金多來源于大型生物醫藥企業、風險投資與首次公開募股(IPO)市場,其研發成果的價值直接影響后續研發資金是否充裕。例如,為了進入生物技術藥物領域,1990年羅氏控股了基因泰克,使基因泰克亟需的研發資金得以有效解決,羅氏不干涉基因泰克的管理,基因泰克的生物技術產品優先輸送給羅氏,使得羅氏很快成為生物技術領域的領軍者。為了獲得源源不斷的生物技術藥物,降低運營成本,并取得絕對控制權,2009年,羅氏斥巨資收購基因泰克的剩余股份,掌握了基因泰克100%股權。控股和收購基因泰克,羅氏獲得了豐厚的收益:2011年10大生物技術藥物中的貝伐珠單抗、利妥昔單抗、曲妥珠單抗和雷珠單抗均來自基因泰克;2013年羅氏公司有將近40種生物技術藥物處于臨床階段,基本上都是單克隆抗體,其中有30多種是基因泰克主導研發的[2]。
5.單克隆抗體成為研發重點
隨著化學新藥創制難度增大,生物技術藥物逐步成為創新藥物的重要來源[6]。早期的生物技術藥物主要包括重組激素/蛋白質、重組生長因子、細胞因子等產品,自1987年第一個治療性單克隆抗體藥物(Orthoclone OKT3)獲準上市,在隨后的20多年中,基于抗體技術的藥物,其市場得到快速擴張,成為領先的重磅炸彈式的藥物[5]。
在生物技術藥物領域,美國在研究、開發與生產方面一直處于領先地位。2013年美國企業針對100多種疾病利用生物技術正在研發907種生物技術藥物(已進入臨床研究階段),如圖1所示。癌癥以及相關疾病、傳染病、自體免疫疾病、心腦血管疾病是重點研究領域。單克隆抗體、疫苗、重組激素/蛋白質、細胞療法是開發重點,其中在研的抗體藥物約占正在研發生物技術藥物數量的37%。單克隆抗體是天然免疫系統蛋白的實驗室制造版本,由淋巴細胞雜交瘤產生、只針對復合抗原分子上某一單個抗原決定簇的特異性抗體。單克隆抗體的一項重要應用就是與藥物相偶聯,組成抗體藥物偶聯物,運用單克隆抗體只與特定靶標相結合的原理,將藥物或放療物質攜帶至靶器官,直接殺傷靶細胞,隨著診斷技術的突破與生物技術的發展,在血癌和實體腫瘤領域,有針對24個靶標的30個抗體藥物偶聯物正在進行臨床試驗[14]。
6.市場前景廣闊
生物技術藥物最能代表醫藥高科技發展的方向和水平,從重組人胰島素到干擾素再到單克隆抗體,它們挽救、延長了眾多患者的生命,提高了深受糖尿病、感染性疾病、癌癥和血友病等疾病困擾的患者的生活質量[15]。隨著生物技術水平的提升,科學家對于疾病有了更深層次、更多角度的認識,生物技術藥物將不斷走向成熟,伴隨著人們收入的提高,更多的患者將會選擇生物技術藥物。2011年生物技術藥物的市場約為1570億美元,預計到2016年,藥品市場會接近1.2萬億美元,生物技術藥物市場將達到約2100億美元,占全球藥品 費用總支出的17%左右[16]。
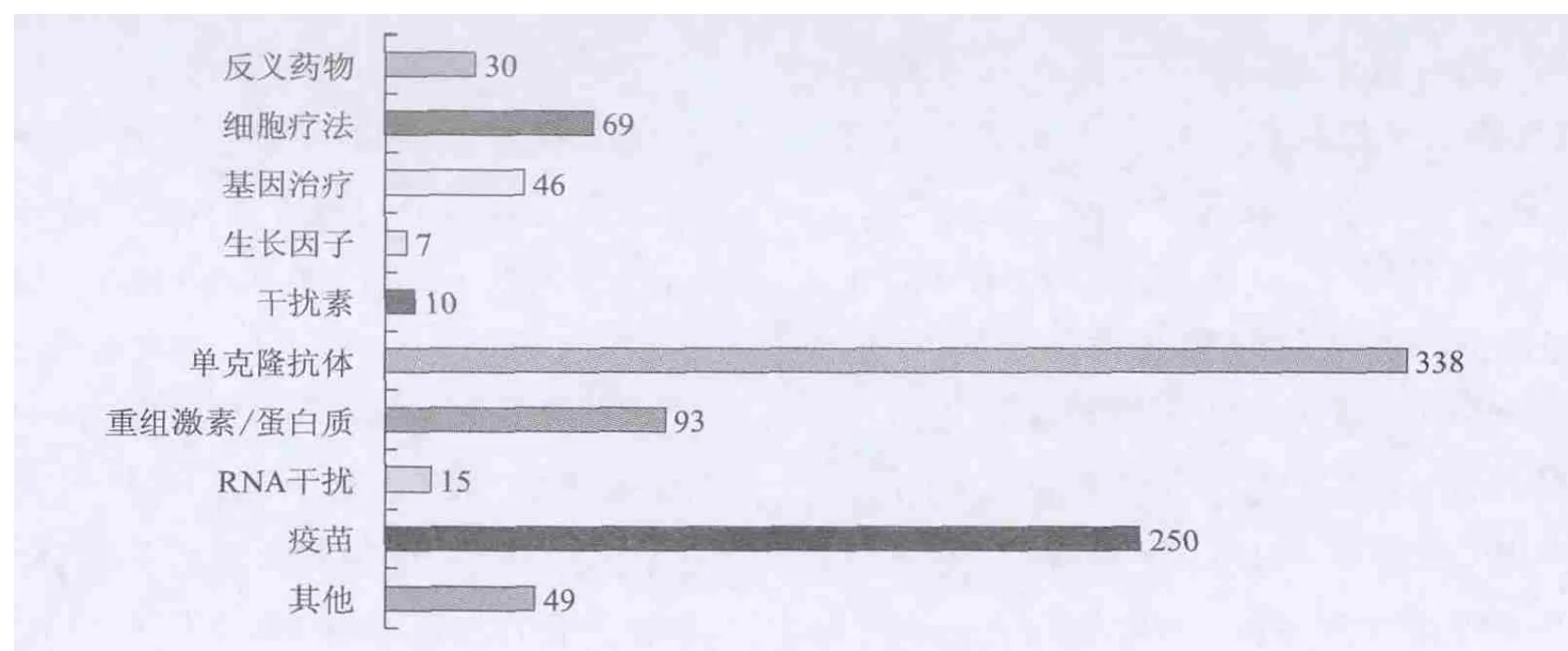
圖1 研發中的生物技術藥物(按產品分類)
三、我國生物技術藥物發展中的主要問題及分析
隨著生物技術的發展,我國生物制藥企業開始跟隨參與到主流生物技術藥物的研發生產中,但還存在著許多問題,例如,我國生物技術藥物領域高水平人才較少,生物技術藥物產業仍處于起步階段,企業規模小、核心技術少、產品競爭力不強。因為生物技術產業化的水平有限,致使企業競爭優勢不高,獲得的利潤較低,不能夠投入大量的資金進行研發,導致企業的創新能力較弱,無力開發具有知識產權的新產品,由此形成不良循環。提高生物技術藥物產業化的能力是解決問題的關鍵因素之一,而學術創業是提高生物技術藥物產業化的重要手段。目前我國主要的問題是生物技術創業的能量還未被激活,支持生物技術創業發展的政策和制度環境還不完善,高水平具有轉化潛力的生物技術候選藥物較少,生物技術科學家不能及時將生物技術進行商業化,所以我國生物技術藥物創業企業較少,成功的生存發展模式亟待探索與實踐。實力并不雄厚。據對1995-2009年關于重組蛋白、疫苗和單克隆抗體方面文獻的統計,美國在這三個領域都排在第一位,分別占據了40%以上的份額,我國在這三個領域分別排在第六(5.74%)、第八(4.89%)、和第十(2.84%)[17]。
我國生物技術藥物基礎研究主要集中在科研院所,科研人員大多依靠國家科研資金支持來開展基礎研究,具有一定的體制約束,冒險精神不足,缺乏創業激情,對待科研成果有一定的遲滯性,對市場反應不夠靈敏。因為缺乏市場導向,導致基礎研究往往脫離應用,或者不能及時將研究領域的重大發現進行商業轉化,不能及時為新成果成立生物技術公司,使成果不能及時從實驗室走到臨床,大部分研發產品處于實驗室階段或者取得專利、獲得獎勵后便束之高閣。即使一部分生物技術藥物科學家成立了公司,也大都會因為缺乏必要的經驗與社會資源,不能將他們的知識和技術轉化為商業上可行的產品[18]。
(二)實力雄厚的企業較少,投融資渠道不暢
(一)高水平人才與團隊不足,學術創業環境尚不成熟
生物技術藥物研發需要生物技術、藥理、生物化學、臨床研究和管理等高水平人才團隊與創新氛圍。雖然我國生物技術科研隊伍聲勢浩大,并且很多人在國外接受教育,具有國外工作經驗,但
我國生物技術藥物企業主要有復興醫藥、天壇生物、長春高新(金賽藥業)、華蘭生物、雙鷺藥業、沃森生物、安科生物、上海萊士等。通過分析相關數據可知,上市企業主要產品為血液制品、疫苗、基因工程藥品,其中較大的天壇生物和華蘭生物2012年的主營收入分別為15億和9.72億元,產品主要為血液制品和疫苗制品,長春高新生產的基因工程藥品主營收入為9.74億元[19]。上市企業在生物技術藥物方面總體規模較小,產品研發投入不足,缺乏資金與平臺,吸引不到高水平人才,導致創新能力有限,不能及時捕捉前沿生物技術帶來的機遇,研發總體上還處于跟蹤仿制階段,核心技術少,產品競爭力不強。
同時,由于生物技術藥物研發投資高、時間長、風險大,而風險投資往往注重短期資本,希望投資風險低、回報高、收回快。如果生物技術藥物研發項目不能從另外的渠道取得資金,很快的給予風險投資回報,風險投資將很少有積極性投入到這一行業,我國目前還沒有建立起與生物技術藥物產業發展規律和特點相適應的的投融資體系。在美國,生物技術公司大都由科學家和風險資本聯合創辦,稱之為“科學家+風險資本”模式[20]。如果生物技術公司的產品取得重大突破,例如進入臨床,臨床表現較好,或者取得新藥證書,生物技術公司便會進行IPO或者贏得大型制藥公司并購的青睞,這樣風險投資便很快的得到回報。風險投資已成為美國生物技術藥物公司不可或缺的組成部分,在2001-2006年,276億美元的風險投資投到了生物技術藥物公司,24.8%的資金投資在舊金山地區,17.6%的資金投在波士頓-劍橋區域,12.8%投在圣迭戈地區,12.4%投在了紐約-新澤西北部地區[21]。
(三)產品更新換代緩慢
我國生物技術藥物產品主要包括干擾素系列、促紅細胞生成素、集落刺激因子系列、腫瘤壞死因子、胰島素和生長激素等,因為缺乏具有知識產權的產品,大部分品種擁有多個廠家,同質化競爭嚴重[22]。目前國際上主流生物技術藥物產品與研發重點以單克隆抗體為主,通過SFDA數據查詢,截止2012年底,我國批準上市的主要國產抗體藥物如表3所示。
國產抗體藥物多是第一代單抗藥物——鼠抗,技術水平較低,具有較大的免疫原性,而在全球單抗藥物領域,單抗藥物已逐步由鼠抗發展到人-鼠嵌合抗體、人源化單克隆抗體和完全人單克隆抗體[5]。當然,隨著我國對生物技術藥物重視程度的提高,國內企業也在加強人源化單克隆抗體的創仿步伐,目前,百泰生物藥業有限公司與上海中信國健藥業股份有限公司都取得了一定的突破。
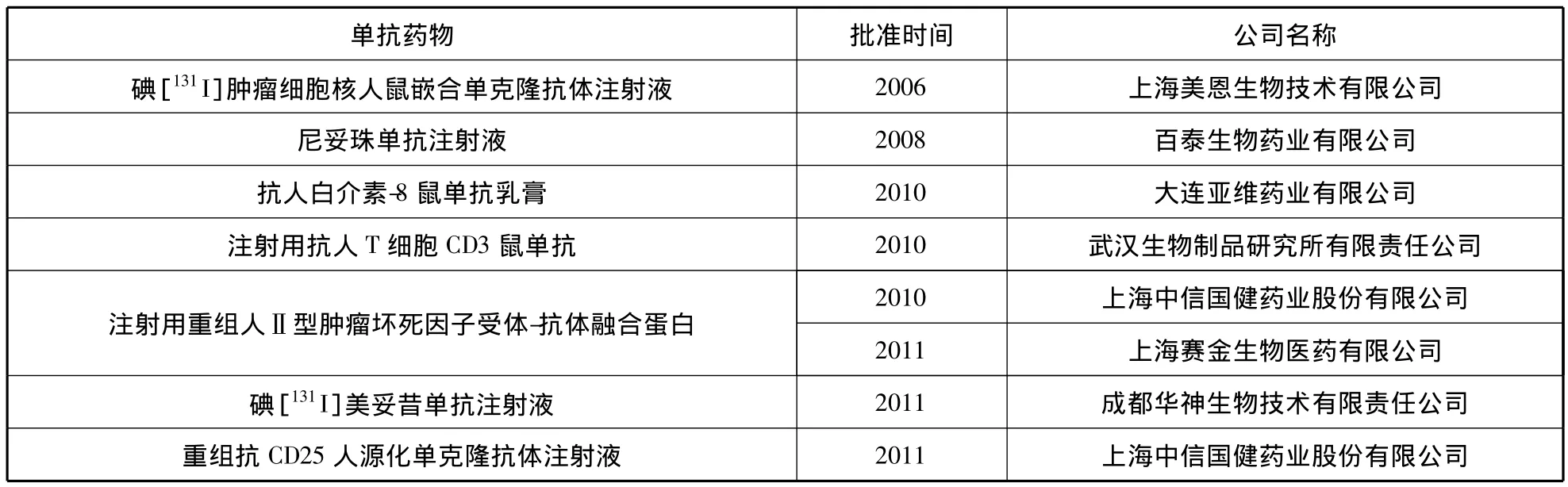
表3 國產主要單抗藥物
(四)亟需生物技術藥物咨詢等中介服務公司
生物技術藥物屬于新興行業,許多投資者或潛在的參與者希望進入這一領域,但由于對這一領域并不是太熟悉,也不太了解生物技術藥物的特點與趨勢,導致顧慮重重,而我國目前顯然缺乏熟知這一領域,能夠為投資者或者感興趣的公司提供了解渠道,為開展生物技術藥物研發、生產的企業提供信息、技術和溝通支撐的技術、管理團隊。相應地,生物技術發達國家在這方面的中介服務公司較多且較專業,例如艾美仕市場研究公司(IMS Health)、藥品研究與制造商協會(PhRMA)、生物技術產業組織(BIO)等,它們已發展成為領先的為生物技術藥物產業提供專業信息和戰略咨詢服務的公司,為投資者、學術界、產業界相互聯通架起了橋梁。
(五)高價格更顯保險支付體系不完善
生物技術藥物工藝流程復雜,技術難度較大,因此生產生物技術藥物的企業往往具有壟斷性質。目前高水平的生物技術藥物價格較高,如適用于治療HER2(人類表皮生長因子受體2基因)過度表達的轉移性乳腺癌的注射用曲妥珠單抗每支售價高達20000多元,6支一療程,一個療程的費用約120000元;用于治療成年中重度活動性類風濕關節炎的阿達木單抗注射液(修美樂)每支約7900元,每兩周皮下注射單劑量給藥,一個月費用約為16000元。這些生物技術藥物的價格遠遠超出了普通家庭的承受能力,因為它們并未納入我國醫保目錄,也少有商業保險支付,公眾需要使用時,往往負擔不起高額的治療費用。
四、對策建議
近年來我國非常重視生物技術藥物行業,為縮小我國生物技術藥物與歐美發達國家的差距,力爭在國際生物技術藥物領域占據一席之地,2010年9月通過的《國務院關于加快培育和發展戰略性新興產業的決定》將生物產業列入戰略性新興產業,生物技術藥物在生物產業中被重點規劃。2011年發布的《“十二五”生物技術發展規劃》和2012年出臺的《醫藥工業“十二五”規劃》為發展生物醫藥技術及產品制定了相關研究方向,明確了生物技術藥物產品和技術發展重點。如何來發展生物技術藥物,針對生物技術藥物的特性與我國目前的實際情況,筆者提出了鼓勵學術創業、支持創新與國際化合作、建立產業集群和完善配套政策的對策建議。
(一)加強轉化研究,鼓勵學術創業
雖然我國在生物技術方面的基礎研究取得了一定的成績,但在生物技術藥物行業的實力不能單純以文獻數量來反映,因為學術文獻將更多的精力放在基礎研究上,學術研究距離市場還很遠[17]。轉化研究就是要將基礎的科學發現與思維轉化為具體的產品,連接早期基礎研究與臨床試驗,涵蓋目標識別與確認。理解干細胞如何分化屬于基礎科學研究,發展運用干細胞治療糖尿病的假設與觀點屬于轉化研究[23]。我國要加大對轉化研究的支持,政府資助的覆蓋范圍需要進一步由基礎向下游延伸,風險投資、大型制藥企業的創新資金應向轉化研究傾斜,積極引導慈善資金對影響面廣,亟需治療藥物的特定疾病進行專項支持。轉化研究也是學術創業的重要基礎。學術創業是科研成果實現商業化、創造社會價值和社會財富的重要方式。在美國,大多數生物技術公司由專注于探索特定發現的科學家或者源于大學的工作團體形成[23]。我國要鼓勵學術創業,如果沒有創業活動,科研成果就很可能停留在實驗室階段,以論文和專利形式存在,因為缺乏管理、營銷與資金,不能及時將技術成果轉化為滿足人們需求的商品,從而無法創造巨大的社會和經濟價值。
生物技術科學家或團隊依靠某項技術或重大發現創辦生物技術企業,由于取得成果具有長期性的特點,因此得到政府支持或風險投資后,如果不能及時推進科研取得階段成果,就不能獲得更大的資金支持。生物技術企業要明確研發產品的價值定位和主張,要證明其研發產品的市場潛力與價值,盡管研發具有很大的不確定性,如何讓投資者對研發項目進行投資,讓其相信研發項目具有高質量的回報,這是生物技術藥物研發必須要面對的問題。我國政府要強有力地支持科研成果的商業化,讓有價值、有前景的生物技術企業即使沒有商業化的產品也能夠進行IPO,營造學術創業的良好的環境與氛圍。鼓勵具有真正高水平的科學家們通過創辦或者通過技術參股等方式加入到生物技術藥物企業中。通過創業讓他們獲得應有的尊重與回報,從而激勵更多的有志之士投入到行業中,生物技術藥物產業才能具有實力與活力,才能欣欣向榮。
(二)支持創新與國際化合作
1.積極支持跨學科研究
生物技術藥物的研發需要整合學術、商業和管理資源,研發團隊成員所涉專業包括生物化學、化學、數學、計算機科學、物理、醫學、管理學等學科,成立由高水平科學家組成的跨學科研究組織對于生物技術研究具有重要作用。生物技術屬于高端技術,開發這些技術具有很高的不確定性,根據新進入缺陷的理論,新進入者具有較高的失敗率[24]。因此國家對生物技術進行重點支持與引導,對于藥物研發具有重要的作用。2010年,美國國立衛生研究院(NIH)為從事生物醫藥研發的大學和其他非營利性的研究組織投資超過200億美元,龐大的公共投資促進帶動了生物技術在醫藥領域的研究,對藥物發現起到了重要的促進作用[25]。
我們必須對生物技術藥物發展趨勢與動態進行正確判斷,了解其研究動向,分析其制約因素,加大政府科研資金支持力度,鼓勵跨學科的協同創新研究,支持共性關鍵技術的研究,對可成藥的靶點進行重點關注,并且確保各項基金基于項目的科學價值進行支持,在評審過程中最大程度保證公平、公正、公開。同時需要增強在研產品信息的溝通與對稱,引導風險投資進入生物技術藥物研發領域。因為風險投資是早期生物技術藥物研發的助推器,我們應鼓勵多個風投基金投資一個項目,為項目提供資金,同時降低風險,促進知識產權共享。
2.強化企業危機與創新意識
企業的競爭優勢主要取決于企業的技術優勢和管理優勢。企業間的競爭是企業創新能力的競爭。通過創新開發的新知識會改變的企業面臨的機遇,促使稀缺資源重新部署到新的領域和遠離邊緣業務[26]。生物技術發展迅速,單個公司的能力是有限的,很少有公司具有能夠成功創新的全部能力[27]。我國大型制藥公司一定要具有強烈的危機感和創新責任意識,認識到創新是醫藥產業保持旺盛生命力并持續發展的核心動力,應積極參與到生物技術藥物的全球研發戰略中,引進戰略合作者,通過投資、聯盟、并購等方式引進創新性技術與產品。中小型生物技術公司在擁有技術能力的同時,應努力提高管理能力,當管理能力與技術能力同時較高時,公司才會有更好的績效表現[28]。生物技術藥物企業要及時感知環境與技術的發展,并在創新計劃中采取合適的戰略[17],通過整合內外資源進行創新,在一定程度上形成很難被其他企業復制和模仿的研發能力,從而得到較高的績效回報[29]。
3.增強學術界與產業界的互動,組建研發聯盟
外部知識可以使公司克服能力陷阱[27],制藥企業需要最新的技術,這些技術經常可通過生物技術公司獲得。而生物技術公司需要制藥企業在特定治療領域的開發技能,因為新的生物技術企業缺少將基礎知識轉化為最終新藥的開發與管理經驗[18]。聯盟的目標是開發一種有價值的藥物。在這個過程中,生物技術企業或高校一般負責研究藥物的基本性質,而制藥公司負責該技術轉化成獨特治療特性的最終藥物[18]。為了得到更好的效果,制藥企業盡量不要去過多干預聯盟成員的活動[30],但聯盟的選擇和最終成功受到每個合伙人能力的影響[24]。
生物醫藥創新網絡呈現出從企業內部創新網絡、本地化創新網絡向全球化創新網絡過渡的階段性變化特征[31]。在我國,科學家缺少資金將成果進行轉化,制藥企業缺少技術生產新的產品。大型制藥企業與生物技術企業、高校應積極組建研發聯盟。生物技術企業與高校,要充分運用最新生物技術,發展具有獨立知識產權的成果。制藥企業要具有前瞻的思維,認識到某一類藥物的發展方向,及時支持聯盟成員的科研活動,彌補自身科研能力不高的短板,并運用科研成果,加快產品的更新換代步伐,提升生物技術藥物的科技含量。政府要鼓勵和支持專業類生物技術藥物咨詢等中介服務公司的建設,為大型制藥企業與科技型公司以及生物技術科學家搭建起橋梁,建立信息通道。隨著技術創新能力的提升和發展的需要,我國企業要站在新的高度,以參與和引領的視野,善于發現和運用全球的生物技術研發成果,建立跨國的產學研技術聯盟,實現全球范圍內的研發網絡化,將資本、人才與技術結合起來,促進生物技術藥物的發展,縮小與先進企業之間的差距,提高競爭優勢。
(三)有針對性地發展生物仿制藥
生物仿制藥被WHO(世界衛生組織)定義為與已許可的治療性生物制品對照藥在質量、安全性和有效性方面相似的治療性生物制品。對專利到期的生物技術藥物進行仿制,一方面可以盡早推出生物技術藥物專利藥的替代品,另一方面可以降低生物技術藥物價格,占領原來專利藥的市場,為更廣大的患者提供低價位的藥品。2004年,歐盟提出了生物仿制藥(similar biotherapeutic products,SBP)的概念,近10年來歐洲藥品管理局(EMA)發布了一系列有關生物相似物的技術指導原則,如《相似生物醫藥產品指南》、《以生物技術來源蛋白為活性成分的相似生物醫藥產品指南:質量部分、非臨床和臨床部分》等[3]。2010年WHO的《生物藥標準專家委員會出臺了生物仿制藥評價指導原則》(Guidelines on Evaluation of Similar Biotherapeutic Products),作為指導全球生物仿制藥的質量、安全和有效性的原則。2011年,生物仿制藥的市場為6.9億美元,據IMS預測,2016年生物仿制藥的市場將達到40-60億美元[16]。我國目前對生物仿制藥缺乏較為明確的定義,沒有專門針對生物仿制藥的相關指導原則。在現行法規下,生物仿制藥需經歷比較完整的藥物研發流程,研究成本和周期較新藥優勢不夠明顯,影響了生物仿制藥的研發。食品藥品監督管理總局需要加大生物仿制藥領域的國際交流與合作,根據國際通行的規則,借鑒WHO與歐盟的作法,及時制定符合我國實際的生物仿制藥相關準則,引導對專利即將到期的生物技術藥物進行分析,重點對其制造工藝進行研究,為企業發展生物仿制藥提供建議與幫助,讓企業生產出等效、安全的生物仿制藥。企業要不斷追蹤市場上的生物技術藥物的專利信息,重點關注技術能力能夠滿足的生物技術藥物,通過獨立、聯合或與專利擁有者合作的方式,提前開展相關研究,當該專利到期后,能夠及時推出該仿制藥物。
(四)在知識基地構建產業集群
知識基地是企業孵化和生物技術企業成長的中心,許多歐洲領先的制藥公司都通過研發聯盟、收購美國企業或者在美國設立研發部門的方式積極進入美國生物技術研究領域。例如,在2002年,瑞士的諾華公司在馬賽諸塞州的劍橋,緊鄰麻省理工大學,成立了其研發總部[21]。我國需要在生物技術發達的北京、上海等地,建設生物技術聚集地區,增強企業間或企業與科學家的互信,加快生物技術轉移、擴散的速度,降低交易成本。構建生物技術藥物從實驗室到中試到臨床再到生產的創新鏈條,政府要加大對生物技術知識基地研發的支持力度,科學家也需讓研究中的生物技術藥物及時從實驗室走到聚光燈下,讓更多的潛在投資人了解藥物的性能與進展。另外有實力的企業可以積極進入到美國和歐洲生物技術發達地區,這樣就能接觸到生物技術最新的知識與技術,有助于先進生物技術加快流動到我國。
(五)制定量身政策,加大扶持力度
我國政府要為生物技術藥物量身制定相應的政策。在確保臨床數據質量的基礎上,加快臨床試驗審批流程,提高審批效率;改革藥品生產許可制度,建立藥品上市許可人制度,讓創新型制藥企業無需自行建廠即可獲得上市許可[15];加大對生物技術藥物創業企業的金融支持力度,用稅收杠桿鼓勵企業提高自主創新能力;建立生物技術藥物進口補貼規定,促進進口數量增加,降低其價格水平,并建立相應的公共保險計劃與私人保險計劃[21],適時將生物技術藥物納入省級和國家醫保報銷目錄,讓更多的患者有足夠的醫療保險或者存款來接受生物技術藥物。
五、結論
經過30年的發展,我國生物技術藥物仍處于初級發展階段[15],隨著生命科學與生物技術研究不斷深入,糖基化技術、聚乙二醇化技術和蛋白質工程不斷取得進展,下一代的生物技術藥物將會不斷提高藥物性能,降低免疫原性[5],滿足更多患者的需求。未來,創新的生物技術藥物將會不斷涌現,逐步呈現多元化,生物仿制藥也會不斷上市。消費者對生物技術藥物的認識水平與認可程度將會逐步提高,生物技術藥物普及程度將會不斷提升,其價格將會有所減低,能夠承擔得起的患者也會越來越多,市場前景廣闊,容量巨大。作為一種知識密集、技術含量高、多學科高度綜合互相滲透的產業,生物技術藥物極具有競爭優勢。我們需對生物技術藥物產業進行剖析,加強科學與商業的嵌合,制定出科學的發展對策與模式,參與到全球的生物技術藥物研發生產鏈中,加快新藥的創仿步伐,以征服棘手的疾病,提高患者的生存質量,并創造巨大的財富。
[1]國務院.生物產業發展規劃[OL].http://www.gov.cn/zwgk/2013-01/06/content_2305639.htm,2013-01-06.
[2]PhRMA.Medicines in development-Biologics[R].America's Biopharmaceutical Research Companies,2013.
[3]梁成罡,王軍志.我國治療性“生物仿制藥”發展對策與思考[J].中國新藥雜志,2012,21(8):851-856.
[4]DIMASI J A,GRABOWSKI H G..The cost of biopharmaceutical R&D:is biotech different?[J].Managerial and Decision Economics,2007,28:469-479.
[5]JAE K R,HYO S K,DOO H N.Current status and perspectives of biopharmaceutical drugs[J].Biotechnology and Bioprocess Engineering,2012,17:900-911.
[6]工業和信息化部.醫藥工業“十二五”發展規劃[OL].http://www.gov.cn/gzdt/2012-01/19/content_2049023.htm,2012-01-19.
[7]Contract Pharma.Top 10 biopharmaceutical companies[OL].http://www.contractpharma.com/heaps/view/68,2012-07-19.
[8]Contract Pharma.Top 50(or so)biopharma products[OL].http://www.contractpharma.com/issues/2012-07/view_features/top-50-or-so-biopharma-products/,2012-07-18.
[9]薛 瀾,林澤梁,梁 正,等.世界戰略性新興產業的發展趨勢對我國的啟示[J].中國軟科學,2013(5):18-26.
[10]譚 輝.美國合作創新政策研究[J].科技進步與對策,2008,25(2):6-12.
[11]ERNST&YOUNG.Beyond borders:biotechnology industry report 2013 [OL].http://www.ey.com/beyondborders,2013-09-01.
[12]OWEN-SMITH J,POWELL W W.Knowledge networks as channels and conduits:the effects of spillovers in the Boston biotechnology community[J].Organization Science,2004,15:5-21.
[13]翁媛媛,饒文軍.生物技術產業集群發展機理研究——以美國波士頓地區為例[J].科技進步與對策,2010,27(6):54-59.
[14]MULLARD A.Maturing antibody-drug conjugate pipeline hits 30 [J].Nature Reviews Drug Discovery,2013,5(12):329-332.
[15]在中國打造世界領先的創新型生物技術藥物產業[R].中國外商投資企業協會研制和開發行業委員會與美國全球生物技術工業組織,2013.
[16]The global use of medicines:outlook through 2016[R].IMS Institute for Healthcare Informatics,2012.
[17]CHAN L,DAIM T U.Multi-perspective analysis of the Chinese pharmaceutical sector[J].Journal of Technology Management in China,2011,6(2):171-190.
[18]DIESTRE L,RAJAGOPALAN N.Are all'sharks'dangerous?new biotechnology ventures and partner selection in R&D alliances [J].StrategicManagementJournal,2012,33:1115-1134.
[19]東方財富網.經營分析[OL].http://www.eastmoney.com,2013-05-06.
[20]李天柱,銀 路,程 躍.美國生物制藥企業的發展路徑研究及其啟示[J].中國軟科學,2010(5):136-142.
[21]LAZONICK W,TULUM ?.US biopharmaceutical finance and the sustainability of the biotech business model[J].Research Policy,2011,40:1170-1187.
[22]China pharmaceuticals & healthcare report Q22013[R].Business Monitor International,2013.
[23]PISANO G P.Can science be a business?lessons from biotech[J].Harvard Business Review,2006,8:114-125.
[24]ROTHAERMEL F T,BOEKER W.Old technology meets new technology:complementarities,similarities,and alliance formation [J].Strategic Management Journal,2008,29:47-77.
[25]TOOLE A A.The impact of public basic research on industrial innovation:evidence from the pharmaceutical industry[J].Research Policy,2012,41:1-12.
[26]KAUL A.Technology and corporate scope:firm and rival innovation as antecedents of corporate transactions [J].Strategic Management Journal,2012,33:347-367.
[27]POWELL W W,KOPUT K W,SMITH-DOERR L.Interorganizational collaboration and the locus of innovation:networks of learning in biotechnology[J].Administrative Science Quarterly,1996,41:116-145.
[28]WELTER C,BOSSE D A,ALVREZ S A.The interaction between managerial and technological capabilities as a determinant of company performance:an empirical study of biotech firms[J].International Journal of Management,2013,30(1):272-284.
[29]DEEDS D L,DECAROLIS D,COOMBS J.Dynamic capabilities and new product development in high technology ventures:an empirical analysis of new biotechnology firm [J].Journal of Business Venturing,1999,15:211-229.
[30]LACETERA N.Different missions and commitment power in R&D organizations:theoryand evidenceon industryuniversity alliances[J].Organization Science,2009,20(3):565-582.
[31]王 飛.生物醫藥創新網絡演化機理研究——以上海張江為例[J].科研管理,2012,33(2):48-54.

