微生物學抗擊耐藥性
蔡立英/編譯
微生物學抗擊耐藥性
蔡立英/編譯

當耐甲氧西林金黃色葡萄球菌感染坦帕灣海盜隊時,美國橄欖球界感受到了抗菌藥物效力日益衰退帶來的恐懼
● 科學回歸自然界,去破譯和瓦解病菌逃避抗菌藥物的機制。
2013年10月20日,周日,美國橄欖球亞特蘭大獵鷹隊打敗了坦帕灣海盜隊。那天的比賽在亞特蘭大鬧市區心臟地帶的喬治亞穹頂體育場舉行,它不是因為比賽的精彩而被人們記住——兩支隊伍都在聯賽中墊底,而是因為賽后發生的事情上了新聞頭條。另一支“參賽隊伍”——穿的不是橄欖球隊服而是白色危險品防護服,進入了賽場并且對海盜隊使用的更衣室進行了徹底的消毒。
追溯海盜隊在佛羅里達州訓練的時候,若干名隊員就已經染上了耐甲氧西林金黃色葡萄球菌(MRSA),這是一種正變得日益流行的耐藥性細菌——短短五年之內,美國被這種細菌感染的住院患者數量就翻了一倍。獵鷹隊的官員擔心MRSA已經從他們的對手海盜隊的皮膚搭便車傳給了亞特蘭大獵鷹隊。不只是海盜隊擔心感染 MRSA。 MRSA和其他葡萄球菌感染是如此常見,以至于美國的中學和大學會常規地監測它們。例如,北卡羅來納州的教堂山中學在其摔跤手冊中,就警告年輕運動員 “如果發現皮膚上有不尋常的斑點,要立即報告教練,”并且補充道:“為了防止感染其他隊員,迅速處理這種異常情況至關重要。”這所中學里幾乎每個人都認識曾感染過MRSA的人。
然而,我們感染耐抗菌藥物病菌的最大風險可能并不來自于人類同胞,而是來自于牛、豬和雞。2011年,美國大約80%的抗菌藥物用于牲畜,使它們在集約化養殖環境下保持健康,并促進牲畜繁殖,因為這種環境下病菌感染很常見,且傳播迅速(參見“公共衛生之抗生素政治”一文)。住在美國頂尖的豬肉生產州——愛荷華州的工廠化養豬場一公里內,感染MRSA的幾率增長到近三倍。在英國,生豬養殖在斯塔福德郡和德比郡的擴張已經引起民眾對失控的耐抗菌藥物病菌的恐懼。
最近幾年,學術研究者在一個隱喻的遺傳學市場中,理解諸如MRSA、耐碳青霉烯腸桿菌科細菌和其他耐藥性傳播甚廣的病菌如何傳遞逃避抗菌藥物的機制方面,取得了飛躍性進展。
移動的耐藥性
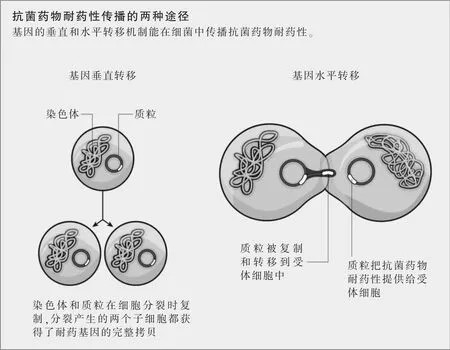
細菌通過兩種基本途徑形成耐藥性:垂直方向上,通過在細胞復制時傳遞突變;水平方向上,耐藥基因在稱為質粒的DNA片段上從一個細胞傳遞到另一個細胞(參見圖示“抗菌藥物耐藥性傳播的兩種途徑”)。“質粒在基因水平轉移(HGT)中是一個主導力量,”華盛頓大學(位于密蘇里州圣路易斯)的微生物學家高塔姆·丹塔斯(Gautam Dantas)說,“但是也有基因水平轉移能夠發生的其他重要方式,包括通過噬菌體的作用把染色體的線性部分從一個細胞轉移到其他細胞,以及從死細胞中攝取裸露DNA。”或是攝取不再封裝在活的細菌細胞內,而是裸露在自由環境中的DNA。許多研究者現在認為基因水平轉移是產生抗菌藥物耐藥性的主要驅動力。
“單個的基因會表達出單個的表型。”丹塔斯說,他指的是一個有機體觀察得到的特征和特質。“但是我們不應該認為抗菌藥物耐藥基因是獨自存在的。”任何一個基因都會受到相鄰基因的影響,而且基因常常在基因簇中相互作用。一些基因還會變得更加可移動——擅長從一個細菌跳躍到另一個細菌。丹塔斯指出,宏基因組學方法——即對所有基因進行測序,以便“我們能識別出耐藥基因和它們所處的遺傳學情境”,將有助于我們闡明耐藥機制,并且辨別那些特別會轉移耐藥性或是會與其他耐藥基因共同作用而使其很難定位的基因。就像他解釋的,“這種方法使得我們有可能區分出不會成為臨床問題的那部分耐藥基因和可能成為臨床問題的那一小部分耐藥基因。”
丹塔斯把“遺傳上位性”(兩個或更多基因相互影響)這個概念視為一種數量優勢。“我們已經看到,比如,從進化學研究中,無論是回顧性的或是前瞻性的研究,那些編碼了耐藥性的特定基因傾向于聚簇在一起。”他說。
通過對耐藥基因及其相互作用方式進行分類,丹塔斯希望科學家們能開始做預測。例如,某個特定的耐藥基因從一個導致疾病群發的有機體轉移到一個通常不導致疾病群發的有機體的可能性有多大?“這些基因在一個特定的有機體中表達出一個特定的表型的概率有多大?”
耐藥性逆轉
抗菌藥物濫用的話題并不新鮮,經常被暗示為耐藥性產生的原因。所以減少抗菌藥物的使用將會增加抗菌藥物的敏感性看起來似乎合乎邏輯。幾年前,在瑞典的烏普薩拉大學和韋克舍醫院,進化微生物學家丹·安德森(Dan Andersson)及其合作者檢驗了這個想法。減少抗菌藥物的使用,要么是通過總體減少——也就是通過減少處方的總用量或是療程長度,要么是使用可控制的特定抗菌藥物。
安德森的研究組嘗試了第二種方法,讓一組病人使用一種抗菌藥物直到產生高水平的耐藥性,然后改變藥方,讓病人使用另一種藥物,希望對第一種藥物的耐藥性會下降。這個實驗失敗了。“總體而言,我認為通過減少抗菌藥物用量的方式很難降低耐藥性,”安德森說,“經過一段很長的時間,耐藥性是會降低,但是在很多情況下,耐藥性降低的效果不夠快。從我們醫學的立場來看,這種逆轉必須在幾年內發生才是有用的。”一旦耐藥性開始產生,就很難停止。
安德森指出,細菌與抗菌藥物耐藥性在逆轉耐藥性這個問題上所需的時間長度并不相同。導致抗菌藥物耐藥性的大多數機制對病菌會產生負面影響,比如減緩其生長,這就是人們所知的“適合度代價”。“這個代價可以非常小,但是幾乎總是存在。也有一些例外是耐藥性細菌實際上比易感性細菌的適合度更大,即使在缺少抗菌藥物的環境下,這的確令人擔憂。”在這些情況下,安德森說,“我們根本不會期待耐藥性的逆轉,因為那時驅動耐藥性的逆轉沒有代價。”當耐藥性提高了細菌的適合度之后,這個問題可能會擴大,即使不再繼續使用抗菌藥物。
耐藥性加上適合度的增大,這個聯合效應來自于一個叫做補償進化的過程。安德森給出了一個例子:“我們研究了影響蛋白質合成的很多抗菌藥物,這些抗菌藥物與核糖體相連;如果耐藥機制是由于核糖體中的某個蛋白質發生突變,補償的突變可能會在核糖體的另一個蛋白質上發生。”所以第一個突變使細菌產生了耐藥性,但是也使它生存的適合度下降了;第二個突變使細菌變得更適應環境,而沒有降低其對抗菌藥物的耐藥性。簡而言之,第二個突變在細菌的生存和繁殖能力方面補償了第一個突變。最終的結果是細菌變得比以前更有抗菌藥物耐藥性,而且更適應環境。
總之,逆轉耐藥性并不是“我們應該指望在未來有可能的事情,”安德森斷定,“它不會拯救我們,我們需要新的抗菌藥物。”他補充道:“醫藥行業和學術研究者必須行動起來,研發新的抗菌藥物,但是這個事情說起來容易做起來難。”
同樣困難的事情是當一定人口的耐藥性頻率達到一個不再上升的最高值時,讓醫生停止使用藥物,而醫生仍然需要替代性藥物。美國埃默里大學(位于佐治亞州亞特蘭大)人口與進化生物學家布魯斯·萊文(Bruce Levin)及其同事正在研究一個能顯示耐藥性水平何時會下降的模型。
在這個尚未發表的模型里,萊文與西班牙馬德里的拉蒙-卡哈爾研究所微生物學家費爾南多·巴克羅(Fernando Baquero)以及挪威特羅姆瑟大學研究細菌進化的帕爾·約翰森(Pal Johnsen)指出,如果使用抗菌藥物直到感染的細菌達到目標的耐藥性頻率——比方說 20%的細菌獲得了耐藥性——“我們能把對這種藥物的耐藥性水平保持在可控水平,”萊文說,“如果我們有無數種藥物,那么效果會很好。”當然事實上我們沒有,不僅缺乏新的抗菌藥物,還存在多藥耐藥菌株的問題,它們對于很多年沒使用的藥物都具有耐藥性。萊文的研究團隊在日托中心采集的糞便樣本表明,大約25%的隔離的大腸桿菌對鏈霉素有耐藥性,這種抗菌藥物除了用來治療結核病之外,已經將近半個世紀沒有作為療法使用了。但是鏈霉素的耐藥基因通過一個質粒被載運,這個質粒對于通常使用的抗菌藥物具有耐藥性。“在太多案例中,耐藥性似乎都停留在這里了。”萊文說。
阻斷通信
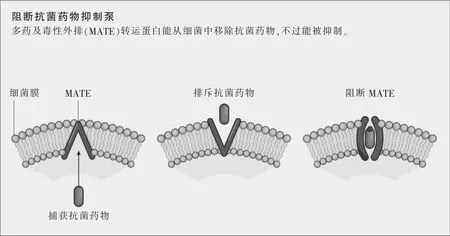
新的抗菌藥物可能來源于對細菌的結構要素和通信網絡的更深理解,想法是破壞那些導致抗菌藥物耐藥性的成分。日本東京大學的結構生物學家濡木理領導的一個研究組去年吸引了全世界的注意,他們宣布破解了一種多藥及毒性外排(multidrug and toxic extrusion,MATE)轉運蛋白的分子結構,正是這種蛋白賦予了抗菌藥物耐藥性。本質上說,MATE轉運蛋白會從細菌中移除外物,比如毒素或抗菌藥物。當揭開MATE轉運蛋白的晶體結構時,濡木的研究組還描述了一種抑制MATE轉運蛋白的分子,首次提示了阻斷這種耐藥機制的一種途徑,并為藥物研發者提供了一種可能的靶點(參見圖示“阻斷抗菌藥物抑制泵”)。
“很多微生物學家都試圖找到細菌的 ‘阿喀琉斯之踵’,從而制造新類別的抗菌藥物。”普林斯頓大學的分子生物學家、霍華德·休斯醫學研究所研究員邦尼·巴斯勒(Bonnie Bassler)說。例如,她的實驗室正在尋找攻擊被稱為“群體感應(quorum sens-ing)”的細菌通信網絡的方法,細菌在這個網絡中能夠確定它們何時數量眾多,處于強勢地位,可以進行攻擊 [哈佛大學的光生物學家約翰·伍德蘭德·黑斯廷斯(John Woodland Hastings)最早在1970年發表了群體感應的研究]。
簡而言之,群體感應是這樣起作用的:細菌分泌叫做自體誘導物的分子,如果細菌的濃度很低的話,這些分子就會漂走。細菌數量越多,自體誘導物也越多。“這是一種集聚效應,”巴斯勒說,“人群中的每一個細胞都在制造和分泌它自己的一份這種信號分子;細胞外的這種分子與細胞數量成比例增長。”她繼續說:“所以當這種分子達到一個臨界濃度,細菌就會與這些分子接觸,從而推斷出它們在附近有鄰居。”這個特定的臨界值或者叫“群體閾值”,取決于細菌的種類。
當致病細菌的數量達到這個群體閾值,接下來發生的事情對宿主來說會很丟臉。“細胞同時開啟生物膜基因、毒性基因和毒素,并作為一個群體開始分泌使宿主生病的所有化合物,就像派遣了一個作戰部隊一樣。”
就像巴斯勒所直率地描繪的,妙處在于阻斷細菌的群體感應,這樣即使當細菌集聚的時候,細菌也不能檢測到它們的鄰居,也不能傳遞信息來建造生物膜——這是細菌細胞的一層很難殺死的膜——或是分泌毒素。“這種方法看起來很有前景,”她說,“我們能制造出結構與真的自體誘導物類似的分子,在試管中堵塞細菌的受體,它們能阻止細菌發動它們的毒性戰役。”結果,她說,“我們發現細菌不能制造生物膜了;它們不會殺死組織培養細胞了。 ”
然而,這還仍然是一個夢想,她說,因為人們在遭到一個既定感染后通常都會延醫診治,而且在細菌意識到它們有一個群體閾值并發動了它們協調一致的劇毒猛攻之后,這種做法是否有效還不確定。除此之外,“我們需要能在群體閾值測序通路的不同點起作用的各種分子,從而知道哪個位置在療法上是最好的。”巴斯勒說。
即使這些分子研發出來,它們很可能需要改進,通過藥物化學變得更有效力,只有到那時它們才能作為療法在動物并且最終在人類身上進行試驗。可能我們還需要數十年之后才能利用群體感應研發出新的抗菌藥物。
夢想“落地”
像安德森、丹塔斯和其他科學家一樣,以色列理工學院和哈佛醫學院的系統生物學家羅伊·基洪尼(Roy Kishony)設想了基于對藥物相互作用以及對耐藥性與敏感細菌之間競爭的深刻理解的藥物組合。基洪尼及其同事比較了自然環境和臨床環境下的抗生素耐藥性。他們疑問,為什么抗菌藥物耐藥性和細菌敏感性——也就是對抗菌藥物的易感性——之間的平衡能在自然界中保持,但在臨床環境中細菌耐藥性就會迅速戰勝細菌敏感性?基洪尼指出,自然界為了遏制生活在土壤中的微生物,早在數億年前就形成了抗菌藥物。“我們人類在這項事業中還是新手,我們還需要學習很多東西才能揭示抗菌藥物耐藥性在自然界是如何作用的。”他說。
在自然界,抗菌藥物“不是單獨存在的”,基洪尼說,“它們在有許多其他化合物而且有多種細菌的環境中存在。”“我們過去的研究把抗菌藥物從環境中孤立出來了,”他解釋說,“我們已經刪除了制衡機制。 ”
基洪尼解釋說,耐藥性通常只涉及單個或幾個基因,“許多這些基因已經被人類識別,在機制和分子方面顯示出相當多很好的細節。”
基洪尼的研究組特別關注自然界中抵制耐藥性的機制,從而為臨床用途尋找候選療法。“我們知道當單個藥物總是選擇耐藥性的時候,一些藥物組合能實際上選擇對那些開始對任何一種單一藥物產生耐藥性的細菌起作用。”作為原理的一個證明,基洪尼引用了他實驗室的一項研究成果:藥物組合降低了人群中耐多西環素大腸桿菌的耐藥性。
他說,土壤中可能還有更多類似的機制在起作用,包括“數量巨大的不同化合物,它們可能以新的方式相互作用,從而抑制抗菌藥物耐藥性進化。”從土壤中尋找這些相互作用的例子,可能會產生對耐藥性進化更具彈性的新的抗微生物療法。正如基洪尼所說,“我們能自己發明東西,但是我們很有可能僅僅通過研究泥土而發現偉大的想法和創新。”
[資料來源:Nature][責任編輯:彥 隱]

